miR-26a调控PTEN基因降低小鼠慢性淋巴白血病细胞的耐药性
2021-06-17毛洪宾
毛洪宾,何 明
(1.开封市人民医院 临床药学科,河南 开封 475000; 2.河南大学第一附属医院 临床药学科,河南 开封 475001)
慢性淋巴细胞白血病(chronic lymphocytic leukemia,CLL)是临床常见的一种白血病,以外周血淋巴细胞增高及骨髓成熟淋巴细胞浸润为主要特征[1]。患者在化疗过程中对药物的敏感性降低,继而产生耐药性,如何避免耐药现象出现是治疗CLL的关键[2]。微小RNA(microRNA)参与多种生理病理过程,与肿瘤细胞的化疗敏感性和耐药性有关,miR-26a能够调节化疗药物的敏感性[3]。第10号染色体缺失的磷酸酶及张力蛋白同源基因(phosphatase and tensin homolog deleted on chromosome ten,PTEN)是一种抑癌基因,其表达降低是肾癌预后不良的有效指标[4]。PTEN参与CLL细胞对氟达拉滨耐药,且miR-26a可通过调节PTEN表达参与肿瘤细胞生理病理过程,但两者在CLL耐药性中报道较少[5]。本研究通过观察miR-26a调控PTEN对小鼠L1210细胞系和小鼠耐顺铂(cisplatin,DDP)L1210/DDP细胞亚系耐药性的影响,探讨其可能作用机制,旨在为临床治疗CLL提供理论参考。
1 材料与方法
1.1 材料
1.1.1 细胞系:小鼠淋巴细胞白血病L1210细胞系(中国科学院上海细胞库)。小鼠耐DDP淋巴细胞白血病L1210/DDP细胞亚系(上海奥陆生物科技有限公司)。
1.1.2 药物、主要试剂:注射用DDP(山东齐鲁制药厂);DMEM培养基和胎牛血清(FBS)(Gibco公司);MTT试剂(Sigma Aldrich公司);pcDNA-miR-26a-inhibitor质粒、pcDNA-miR-26a-inhibitor-NC质粒(广州锐博生物科技有限公司);LipofectamineTM2000转染试剂(Invitrogen公司);野生型和突变型PTEN重组质粒(上海生工生物工程股份有限公司);兔抗小鼠PTEN、磷脂酰肌醇3激酶(phosphatidyl inositol-3-kinase,PI3K)、丝氨酸-苏氨酸蛋白激酶(serine-threonine protein kinase,AKT)多抗、p-AKT多抗和山羊抗兔IgG-HRP(Abcam公司)。
1.2 方法
1.2.1 细胞的培养及分组处理:将L1210细胞接种于质量分数10% FBS及1%青链霉素的DMEM培养基,于体积分数5% CO2培养箱内37 ℃常规培养;L1210/DDP细胞接种于DDP终浓度为0.1 mg/L的DMEM培养基,实验前1周撤药,取对数增殖期细胞用于后续实验。
将细胞分为对照组(L1210细胞)、耐药组(L1210/DDP细胞)、NC组(pcDNA-miR-26a-inhibits-NC质粒+L1210/DDP细胞)和抑制剂组(pcDNA-miR-26a-inhibits质粒+L1210/DDP细胞)。按照LipofectamineTM2000说明书将其进行转染,继续培养24 h。
1.2.2 RT-qPCR检测细胞中miR-26a、PTEN mRNA表达量:取稳定转染的各组细胞,提取总RNA,反转录cDNA,进行PCR扩增。扩增条件:95 ℃ 预变性5 min;95 ℃变性30 s,55 ℃退火20 s,70 ℃延伸30 s,共40个循环。miR-26a上游引物:5′-AATC GAATTCGCTGAGTCAGA-3′;下游引物:5′-CATAAG GCGTCGAGTGCAACC-3′。U6上游引物:5′-ACTG CATGCCATTGCAGTC-3′;下游引物:5′-ACCGTG AACTTGCCTGCAA-3′。PTEN上游引物:5′-AGGT TCAGCTAGCTATGGCA-3′;下游引物:5′-CAGCCTA AACTGCTAGCTAA-3′。β-actin上游引物:5′-AGC AGCAGTTATACTAGCA-3′;下游引物:ACTAGCTAG CATCATGCAA-3′。miR-26a以U6为内参,PTEN以β-actin为内参,采用2-△△Ct法计算miR-26a、PTEN mRNA表达水平。
1.2.3 miR-26a与PTEN靶向性的检测:预测miR-26a 3′UTR与PTEN之间的结合位点,分别构建野生型重组质粒pMir-PTEN-WT和突变型重组质粒pMir-PTEN-MUT,分为野生型NC组、野生型+miR-26a组、突变型NC组、突变型+miR-26a组,利用LipofectamineTM2000将miR-26a-mimics/miR-26a-mimics-NC与pMir-PTEN-MT/pMir-PTEN-MUT质粒共转染L1210细胞,按试剂盒说明书操作,计算相对荧光素酶活性。
1.2.4 耐药性的检测:取稳定转染的各组细胞,接种于96孔板,待细胞汇合至70%左右时,加入含DDP(0.02、0.2、2、20和200 g/mL)的DMEM培养基,48 h后,每孔加入MTT(5 g/L)溶液20 μL,继续培养2 h后弃上清液,加入DMSO 150 μL/孔,充分振荡10 min,用酶标仪测定490 nm波长处吸光度(A)值,计算细胞抑制率,细胞抑制率(%)=(1-实验组A值/对照组A值)×100%,绘制细胞抑制率曲线,根据曲线拟合方程求出L1210细胞、L1210/DDP细胞对DDP的半数抑制浓度(half maximal inhi-bitory concentration,IC50)。
1.2.5 流式细胞仪检测细胞凋亡率:取稳定转染的各组细胞,PBS洗涤,2 500 r/min离心5 min,结合缓冲液重悬细胞,加入5 μL AnnexinV-FITC混匀,4 ℃避光孵育15 min,10 μL PI染色5 min,使用流式细胞仪检测细胞凋亡情况。
1.2.6 Wetern blot检测细胞中PTEN、PI3K、AKT蛋白相对表达量:取稳定转染的各组细胞,加入RIPA 裂解液裂解细胞,离心取上清,BCA法测定蛋白浓度,蛋白变性,进行10% SDS-PAGE凝胶电泳,转膜,5%脱脂奶粉封闭1 h,TBST溶液洗膜,分别加入1∶1 000稀释的PTEN、PI3K、AKT、p-AKT和β-actin一抗,4 ℃孵育过夜,TBST溶液洗涤后加入HRP标记的山羊抗兔二抗(1∶4 000),室温孵育2 h,加入ECL化学发光试剂,显影、定影、拍照,分析各目标蛋白条带吸光度值,以目的蛋白条带吸光度值与内参β-actin条带吸光度值表示目的蛋白的相对表达量。
1.3 统计学分析
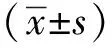
2 结果
2.1 细胞耐药对miR-216、PTEN mRNA表达的影响
L1210/DDP细胞中miR-26a mRNA表达明显降低,PTEN mRNA表达明显升高(P<0.05)(表1)。
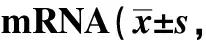
表1 细胞耐药对miR-26a、PTEN mRNA表达的影响
2.2 转染miR-26a对miR-26a、PTEN mRNA表达的影响
与NC组比较,耐药组、抑制剂组miR-26a mRNA表达降低,PTEN mRNA表达升高,且抑制剂组miR-26a mRNA表达低于耐药组,PTEN mRNA表达高于耐药组(P<0.05)(表2)。
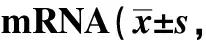
表2 转染miR-26a对miR-26a、PTEN mRNA表达的影响
2.3 miR-26a靶基因验证
生物信息预测显示,miR-26a与PTEN存在连续结合位点(图1)。
野生型NC组、野生型+miR-26a组、突变型NC组、突变型+miR-26a组相对荧光素酶活性分别为:(1.31±0.15)、(0.73±0.08)、(1.29±0.14)和(1.32±0.13)。与野生型+miR-26a组比较,野生型NC组、突变型NC组、突变型+miR-26a组相对荧光素酶活性显著升高(P<0.05)。野生型NC组、突变型NC组、突变型+miR-21组相对荧光素酶活性无差异(图1)。
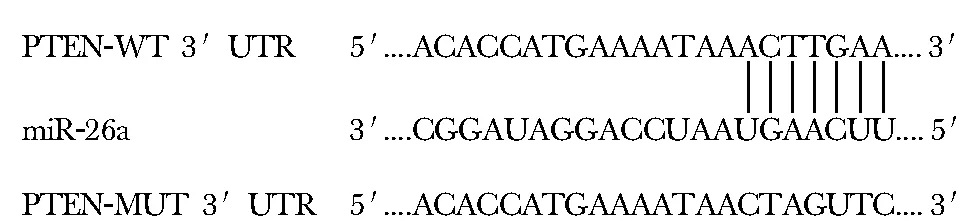
图1 miR-26a与PTEN的结合位点Fig 1 Binding site of miR-26a and PTEN
2.4 细胞抑制率及对DDP的IC50值比较
不同浓度DDP处理细胞后,耐药组细胞抑制率降低,抑制组细胞抑制率升高(P<0.05)(图2)。

图2 细胞抑制率比较Fig 2 Comparison of cytostatic rate
对照组、NC组、耐药组、抑制组细胞对DDP的IC50值分别为:(1.12±0.13)g/mL、(1.07±0.12)g/mL、(6.35±0.65)g/mL和(0.16±0.02)g/mL。与对照组、NC组比较,耐药组细胞IC50值升高,抑制组细胞IC50值降低(P<0.05);且抑制组细胞IC50值低于耐药组(P<0.05)。对照组和NC组细胞IC50值无差异。
2.5 细胞凋亡率比较
对照组、NC组、耐药组、抑制组细胞凋亡率分别为:(66.28±6.79)%、(64.68±6.64)%、(8.57±1.13)%和(84.26±8.45)%。与对照组、NC组比较,耐药组细胞凋亡率降低,抑制组细胞凋亡率升高(P<0.05),耐药组细胞凋亡率低于抑制组(P<0.05)。
对照组、NC组细胞凋亡无差异(图3)。
2.6 细胞中PTEN、PI3K、AKT蛋白水平比较
与对照组、NC组比较,耐药组、抑制组PTEN蛋白表达升高,PI3K蛋白表达及p-AKT/AKT降低(P<0.05);抑制组较耐药组PTEN蛋白表达升高,PI3K蛋白表达及p-AKT/AKT降低(P<0.05)(表3,图4)。
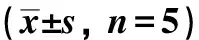
表3 蛋白表达水平比较

A.control group; B.NC group; C.resistance group; D.inhibitior group图3 细胞凋亡率比较Fig 3 Comparison of apoptosis rates

A.control group; B.NC group; C.resistancegroup; D.inhibitior group图4 细胞中各蛋白表达Fig 4 Expression of various proteins in cells
3 讨论
miRNA与血液肿瘤耐药性关系密切,其通过调控靶基因表达,抑制或激活下游信号通路,导致肿瘤细胞对药物的敏感度发生改变,引起肿瘤细胞多药耐药,造成化疗效果不佳甚至失败。
miR-26a通过调节靶蛋白表达,导致乳腺癌及非小细胞肺癌细胞对药物的敏感性,影响化疗效果[6-7]。本研究中耐药组细胞miR-26a mRNA表达较高,细胞抑制率和凋亡率较低,对DDP的IC50值维持在较高水平,抑制miR-26a表达后,细胞抑制率和凋亡率明显升高,对DDP的IC50值明显降低,提示过表达miR-26a可增强L1210/DDP细胞对DDP的耐药性。PTEN是体内重要的抑癌因子,具有蛋白磷酸酶和脂质磷酸酶双重活性,在多种肿瘤中表现缺失或低表达,参与肿瘤发生发展过程[8]。PTEN可以作为miRNA的靶基因,参与人肺腺癌及非小细胞肺癌细胞对化疗药物的耐药性[9-10]。本研究抑制组细胞中PTEN表达较耐药组明显升高,荧光素酶报告结果证实miR-26a与PTEN存在靶向性,提示抑制miR-26a可通过靶向上调PTEN,降低L1210/DDP细胞对DDP的耐药性。
PI3K/Akt信号通路是肿瘤发生发展过程中的重要信号通路,在许多肿瘤组织中过度表达和活化,通过翻译或转录水平引起肿瘤细胞失控性增殖,或下调肿瘤抑制蛋白p53的表达,还可抑制细胞凋亡进程参与肿瘤发生发展过程。PI3K/Akt信号通路与肿瘤耐药关系密切,过度活化的AKT通过抑制凋亡信号激酶活性导致肿瘤细胞产生耐药,与DDP、阿霉素多种化疗药物耐药有关,严重影响化疗效果,抑制PI3K/Akt通路可以逆转肿瘤细胞耐药[11]。PTEN是PI3K/Akt通路的主要抑制分子,通过PI3K抑制下游AKT活化。抑制PTEN表达可以激活PI3K/Akt信号通路,介导乳腺癌细胞的耐药性[12]。过表达PTEN通过抑制PI3K/Akt通路,增强胃肠道间质瘤细胞的化学敏感性[13]。本研究抑制组PTEN蛋白显著升高,PI3K、p-Akt蛋白水平显著降低,提示上调PTEN可以抑制PI3K/Akt通路,miR-26a通过靶向调节PTEN表达,进而影响PI3K/Akt信号通路激活,从而使L1210/DDP细胞耐药性发生改变。
综上所述,L1210/DDP细胞中过表达miR-26a通过靶向抑制PTEN,激活PI3K/Akt信号通路,提高细胞对DDP的耐药性,抑制miR-26a表达可以降低细胞耐药性,体内实验尚需进一步研究探讨,以期为临床治疗CLL提供参考。
