羧胺三唑增强小鼠脾脏淋巴细胞促进结肠癌细胞系MC38和C26凋亡
2021-06-17高洪婷黄雨晴杨黎星王钰铖
高洪婷,黄雨晴,杨黎星,马 瑞,王钰铖,鞠 瑞,郭 磊
(中国医学科学院基础医学研究所 北京协和医学院基础学院 药理系,北京 100005)
结肠癌(colon cancer)是目前世界上常见的癌之一[1]。结肠癌的发病往往具有隐匿性,通常在疾病中晚期才会被发现,迄今为止临床上尚无有效的根治性治疗方法。因此,探索更加有效的治疗结肠癌的方法和策略,对人类早日摆脱结肠癌困扰具有重要意义。
羧胺三唑(carboxyamidotriazole,CAI)是一种非细胞毒类小分子抗肿瘤药物[2]。研究表明,CAI可以抑制钙离子内流[3],抑制肿瘤细胞的增殖和血管生成并调节肿瘤微环境[4],同时该药物具有抗感染作用[5]。肿瘤微环境是一个极其复杂的系统,与肿瘤的发生发展密切相关。近年来,针对肿瘤微环境调节的肿瘤免疫疗法已逐渐成为一种新的治疗手段[6]。脾脏是机体中最大的免疫器官,含有大量淋巴细胞以及巨噬细胞,在免疫平衡和免疫调节中具有重要作用。目前,CAI对脾脏淋巴细胞抑瘤作用的影响尚不明确。本研究拟通过观察CAI对结肠癌细胞系存活和凋亡的影响以及CAI对小鼠脾脏淋巴细胞抑制结肠癌细胞存活、促进细胞凋亡的影响,初步探究其作用机制,以期为结肠癌的治疗提供一定的理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物:C57BL/6小鼠和BALB/c小鼠(6~8周龄,SPF级,雌性,体质量18~20 g,中国医学科学院基础医学研究所动物中心)。常温环境饲养(温度22 ℃±2 ℃,湿度 40%~70%),12 h明/暗交替。动物自由摄食、饮水。
1.1.2 细胞系:结肠癌细胞系MC38和C26(中国医学科学院基础医学研究所细胞资源中心)。
1.1.3 药品与试剂:羧胺三唑(CAI)(中国医学科学院药物研究所);胎牛血清(Gibco公司);RPMI-1640培养基和DMEM高糖培养基(中国医学科学院基础医学研究所细胞资源中心);CCK-8试剂盒(上海翊圣生物科技有限公司);小鼠淋巴细胞分离液(深圳市达科为生物工程有限公司);Annexin V/PI细胞凋亡检测试剂盒、CD4流式抗体、CD8流式抗体和CD3流式抗体(BioLegend公司)。
1.2 方法
1.2.1 细胞的培养与处理:将MC38细胞培养于RPMI-1640培养基中,C26细胞培养于DMEM高糖培养基中。按小鼠淋巴细胞分离液说明书分离C57BL/6小鼠和BALB/c小鼠的脾脏淋巴细胞,将与MC38细胞同品系的C57BL/6小鼠脾脏淋巴细胞与MC38细胞按照20∶1的比例共培养,将与C26细胞同品系的BALB/c小鼠脾脏淋巴细胞与C26细胞按照20∶1的比例共培养。不同浓度CAI处理细胞。
1.2.2 CCK-8法检测细胞存活:在96孔板中分别接种MC38和C26细胞悬液,调整细胞为1×105个/mL,每孔100 μL,待细胞贴壁后加入不同浓度的CAI,每组设3个复孔,培养48和72 h;或待细胞贴壁后与小鼠脾脏淋巴细胞共培养,1 h后加入不同浓度的CAI,每组设3个复孔,培养48 h。随后弃去孔中原培养液,每孔加入100 μL无血清培养液和10 μL CCK-8试剂,在培养箱内孵育1~4 h后用酶标仪测定450 nm处的吸光度。
1.2.3 流式细胞测量术检测细胞凋亡:用不含EDTA的胰蛋白酶消化细胞后,4 ℃,300×g离心5 min收集细胞。用预冷的磷酸盐缓冲液(PBS)洗涤细胞2次,每次均4 ℃,300×g离心5 min,收集1×105~5×105个细胞。吸弃PBS,加入100 μL 1×缓冲液重悬细胞。加入5 μL annexin V-FITC和10 μL PI染色溶液,轻轻混匀。避光,室温反应10~15 min。加入400 μL 1×缓冲液,混匀后放置于冰上,在1 h内用流式细胞仪检测。
1.2.4 流式细胞测量术检测小鼠脾脏淋巴细胞中CD4+CD3+T细胞和CD8+CD3+T细胞的比例:收集细胞至离心管中,室温,250×g离心10 min,PBS清洗细胞1次。加入流式抗体,4 ℃ 避光孵育30 min,PBS洗1遍,350 μL PBS重悬细胞,过筛后流式细胞仪检测。
1.3 统计学分析
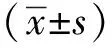
2 结果
2.1 CAI抑制MC38和C26细胞存活
不同浓度CAI处理MC38或C26细胞48、72 h后,A值显著低于0 μmol/L组(P<0.05、P<0.01和P<0.001)(图1)。
2.2 CAI增强小鼠脾脏淋巴细胞抑制MC38和C26细胞存活
MC38和C26细胞分别与小鼠脾脏淋巴细胞共培养48 h后,A值显著降低(P<0.001);不同浓度CAI处理共培养条件下的MC38或C26细胞48 h后,与单独小鼠脾脏淋巴细胞处理相比,A值进一步显著降低(P<0.001);活细胞数目相比单独培养的MC38或C26细胞同剂量CAI组的减少比例,超过小鼠脾脏淋巴细胞对肿瘤细胞数目的减少比例(图2)。
2.3 CAI促进MC38和C26细胞凋亡并增强小鼠脾脏淋巴细胞促进MC38和C26细胞凋亡
不同浓度CAI处理MC38或C26细胞48 h后,凋亡率显著高于0 μmol/L组(P<0.01和P<0.001);MC38和C26细胞分别与小鼠脾脏淋巴细胞共培养48 h后,凋亡率显著升高(P<0.001);不同浓度CAI处理共培养条件下的MC38和C26细胞48 h后,与单独处理小鼠脾脏淋巴细胞相比,凋亡率进一步显著升高(P<0.05和P<0.001);细胞凋亡相比单独培养的MC38或C26细胞同剂量CAI组的增加比例,超过小鼠脾脏淋巴细胞对肿瘤细胞凋亡的增加比例(图3)。

*P<0.05,**P<0.01,***P<0.001 compared with 0 μmol/L group图1 CAI对MC38和C26细胞存活的影响Fig 1 Effects of CAI on the survival of MC38 and C26 n=3)

*P<0.001 compared with 0 μmol/L group图2 CAI对小鼠脾脏淋巴细胞抑制MC38和C26细胞存活的影响Fig 2 Effects of CAI on that spleen lymphocytes of mice inhibit the survival of MC38 and C26 n=3)

*P<0.05,**P<0.01,***P<0.001 compared with 0 μmol/L group图3 CAI对MC38和C26细胞凋亡的影响以及CAI对小鼠脾脏淋巴细胞促进MC38和C26细胞凋亡的影响
2.4 CAI升高小鼠脾脏淋巴细胞中CD4+CD3+ T细胞和CD8+CD3+ T细胞的比例
不同浓度CAI处理小鼠脾脏淋巴细胞48 h后,小鼠脾脏淋巴细胞中CD4+CD3+T细胞和CD8+CD3+T细胞的比例显著升高(P<0.05,P<0.01)(图4)。
3 讨论
CAI是一种非细胞毒类抗肿瘤药物,在体内外均能抑制多种肿瘤细胞的增殖,促进肿瘤细胞的凋亡。本研究通过检测MC38和C26细胞的存活和凋亡,证实了CAI对结肠癌细胞MC38和C26存活的抑制作用和促进细胞凋亡的作用,更重要的是发现了CAI能够在体外促进小鼠脾脏淋巴细胞对结肠癌细胞的杀伤作用。
近年来,肿瘤微环境已逐渐成为肿瘤治疗领域的研究热点。靶向肿瘤微环境的肿瘤免疫疗法发展迅速,在恶性肿瘤治疗中显示出强大优势[7],同时也面临众多机遇与挑战[8]。其中,肿瘤浸润淋巴细胞(tumor-infiltrating lymphocytes,TILs)是肿瘤组织中的浸润型淋巴细胞,可对肿瘤细胞起到特定的杀伤作用。研究表明,CD8+肿瘤浸润淋巴细胞亚群与肺癌患者TILs高密度、细胞毒性增强和生存率提高有关[9]。文献提示,在原发性肿瘤中,T淋巴细胞浸润是无复发生存的独立预后因素[10]。本研究证实小鼠脾脏淋巴细胞使MC38和C26细胞的凋亡率显著升高,肿瘤细胞的存活受到明显抑制。CAI进一步加强小鼠脾脏淋巴细胞的抑瘤作用,使大量肿瘤细胞呈现晚凋和坏死状态,活细胞数显著减少,表明CAI促进小鼠脾脏淋巴细胞杀伤结肠癌细胞主要是通过增加MC38和C26细胞晚期凋亡以及坏死比例来实现的,显示出CAI在肿瘤免疫治疗上的潜力。进一步检测后发现CAI增强小鼠脾脏淋巴细胞抑瘤作用可能与上调CD4+CD3+T细胞和CD8+CD3+T细胞的比例有关,但具体作用机制有待进一步研究和探讨。

*P<0.05,**P<0.01 compared with 0 μmol/L group图4 CAI对小鼠脾脏淋巴细胞中CD4+CD3+ T细胞和CD8+CD3+T细胞所占比例的影响
综上所述,本研究初步证实CAI能够抑制MC38和C26细胞的存活、促进细胞凋亡,并可能通过上调小鼠脾脏淋巴细胞中CD4+CD3+T细胞和CD8+CD3+T细胞的比例增强小鼠脾脏淋巴细胞抑制MC38和C26细胞存活、促进细胞凋亡。这为进一步探索CAI在免疫治疗中的作用,探究更加有效的结肠癌治疗方法提供了实验依据。同时本研究也存在一定的局限性。肿瘤微环境极其复杂,涉及多种细胞类型,如炎性细胞、成纤维细胞、神经和血管内皮细胞。这些基质细胞通过释放各种分子重塑周围区域,在肿瘤的生长过程中起到重要作用[11]。因而单纯在体外将小鼠脾脏淋巴细胞与肿瘤细胞共培养可能无法有效模拟体内真实的肿瘤微环境。未来,本课题组将会通过在体实验继续探索CAI对肿瘤浸润淋巴细胞杀伤肿瘤细胞的影响及其作用机制。
