Dicer1缺失对小鼠早期神经发育的影响
2021-06-17刘高澳彭小忠舒鹏程
刘高澳,彭小忠,2*,舒鹏程*
(1.中国医学科学院基础医学研究所 北京协和医学院基础学院 生物化学与分子生物学系 医学分子生物学国家重点实验室 医学灵长类研究中心 神经科学中心,北京 100005;2.中国医学科学院医学生物研究所,云南 昆明 650118)
神经发生是哺乳动物大脑神经干细胞产生功能性神经元的过程[1],由多种信号通路、生长因子、编码和非编码RNA控制的。大脑皮层和海马是形成学习与记忆等功能的关键脑区,其发育异常会导致智力障碍。DICER属于RNaseIII[2],敲除Dicer1基因后不能产生成熟microRNAs(miRNAs)[3],在神经系统中Dicer1缺失会令小鼠出生后早期死亡[4]。miRNAs在神经干细胞中具有调节增殖、迁移、分化[5]以及调控凋亡和存活相关信号通路的作用[6]。因此,Dicer1敲除小鼠是研究miRNAs作用的必要工具鼠。D6是小鼠mDach1基因的增强子,其Cre重组酶活性主要表达在新皮层和海马区域[7],E10.5起始表达,E12.5时在背侧皮层广泛表达[8]。
本研究利用D6-Cre在发育早期条件性敲除Dicer1,结合RNA-seq技术,在转录水平上具体分析在神经干细胞中敲除Dicer1后的基因表达差异,研究miRNAs对大脑皮层早期发育的调控作用。
1 材料与方法
1.1 材料
1.1.1 细胞与动物:SPF级Dicer1-floxed小鼠(南京大学模式动物研究所)(JAC LAB NUMBER:006001);SPF级D6-Cre工具鼠(美国耶鲁大学钟伟民教授惠赠)。Dicer1-floxed纯合型小鼠与D6-Cre进行交配进而获得D6-Cre介导的Dicer1条件性敲除小鼠。
1.1.2 主要试剂:多聚甲醛(paraformaldehyde, PFA)、溴化乙啶(ethidium bromide, EB)、焦碳酸二乙酯(diethyl pyrocarbonate, DEPC)和4′,6-二脒基-2-苯基吲哚(4′,6-diamidine-2-phenyl indole, DAPI)(Sigma公司);蔗糖、蛋白酶K(Proteinase K)、Trizol(Invitrogen公司);Anti-NeuroD2 antibody(Abcam公司);琼脂糖(Gibco公司);苏木精-伊红(hematoxylin-eosin staining, HE)、辣根过氧化物酶偶联山羊抗兔 IgG(中杉金桥生物公司);二甲苯、无水乙醇、三氯甲烷、异丙醇(国药集团化学试剂有限公司);50 bp DNA Ladder(天根生化科技有限公司);引物合成(北京擎科生物技术公司)。
1.2 方法
1.2.1 PCR鉴定转基因小鼠基因型:剪取对应标号的脚趾组织,加入裂解液并提取DNA组,测定浓度后,进行上样、电泳。电泳后的琼脂糖凝胶置于Bio-Rad成像仪中曝光,并分析条带。
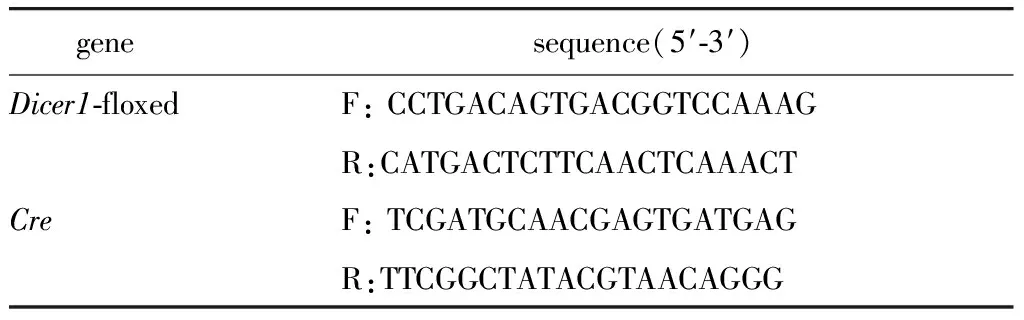
表1 PCR引物序列Table 1 Sequence of PCR primers
1.2.2 样品的获取、处理与测序:孕鼠脱颈法处死,采集E14.5小鼠大脑背侧皮层组织,液氮速冻,并置-80 ℃冰箱保存待测。使用Trizol法从小鼠脑组织中提取总RNA。NanoPhotometer spectrophotometer检测RNA纯度(A260/A280在1.8~2.1,A230不低于1.7)并纯化mRNA,将所得到的mRNA随机打断成片段,再用随机引物和反转录酶合成cDNA片段,再对cDNA片段进行末端修复,并连接测序接头,富集纯化的cDNA模板后用Agilent 2100 bioanalyzer自动化电泳分析,对文库进行质检,最后上机测序。制备的RNA样品委托诺禾致源生物信息科技有限公司进行分析。使用DESeq2软件(1.16.1)进行两个比较组合之间的差异表达分析。通过 clusterProfiler R软件实现差异表达基因的GO富集分析。
1.2.3 苏木精-伊红染色检查 D6-Cre-Dicer1条件性敲除小鼠表型:用4%多聚甲醛磷酸缓冲液固定脑组织标本,OCT包埋,切片,经HE染色后,在显微镜下观察脑组织整体形态变化。
1.2.4 免疫荧光检测D6-Cre-Dicer1条件性敲除小鼠表型:切片从-80 ℃冰箱取出,在室温放置10~15 min使之恢复至室温。同时,打开烘箱,调至50 ℃预热,烘烤15 min;浸入1×PBS中5 min,两次。以0.3% Triton-X100-PBS配制5%绵羊血清封闭液,封闭组织45 min。将一抗按照说明书比例稀释至0.3% Triton-X100-PBS中,一抗孵育组织4 ℃过夜。第2天,放置1×PBS中5 min,两次洗片后,加入二抗稀释液,置于湿盒内,放在室温下避光2~3 h。避光洗片后,在其上滴加含DAPI的荧光封片剂进行封片。使用激光共聚焦显微镜(Olympus,FV-1000)进行免疫荧光结果拍照,使用Photoshop CS6对图像进行裁剪,使用Adobe illustrator CS6进行图像编排与绘图。
1.3 统计学分析
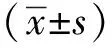
2 结果
2.1 Dicer1条件敲除小鼠的获得和表型分析
Dicer1-floxed小鼠根据敲除策略(图1A)以PCR鉴定小鼠基因型,Dicer1突变纯合型条带大小为420 bp,Cre条带大小为481 bp,D6-Cre-Dicer1小鼠构建成功(图1B)。
初步观察,Dicer1条件性敲除小鼠出生1个月左右,较野生型相比,体型瘦弱,行动迟缓运动无力。爬行缓慢,且对应激不敏感。分离出生后28 d的Dicer1条件敲除小鼠大脑组织,与野生型相比,敲除组大脑组织体积明显变小(图1C),质地较软,结构不清,边缘模糊。出生后3 d小鼠脑组织切片HE染色,与对照组比,敲除组大脑皮质明显变薄,海马变小且结构部分缺失。免疫荧光(immunofluorescence,IF)染色检测神经元情况(NeuroD2,神经元标志物),敲除组小鼠大脑皮质中NeuroD2+细胞减少且分布异常(图1D)。因此,D6-Cre介导的Dicer1条件性敲除,导致皮质神经元发育异常。
A.knockout strategy for Dicer1; B.genotype was identified by PCR; C.ablation of Dicer1 by D6-Cre seriously affects telencephalon structure(n≥3); D.HE staining to detect the tissue structure and morphology, hippocampus was smaller than controls; IF staining was used to detect neuronal dysplasia, neurons were greatly reduced(n≥3)
2.2 D6-Cre介导的Dicer1 cKO对神经干细胞干性的影响
提取E14.5小鼠背侧端脑组织总 RNA,利用RNA-seq对Dicer1敲除前后进行差异基因筛选(P<0.05)。与对照组相比,条件敲除组中Dicer1明显下调(P<0.01)。筛选得到差异表达基因45个,上调基因11个,下调基因34个(图2A)。
检测干细胞相关表型基因(Sox9、Id3、Aldoc、Clu、Sox2、Prom1、Ntm、Gja1、Atp1a2、Cenpf、Cdk1、Apoe、Pax6),实验组神经干细胞中高表达的Sox2、Pax6等基因无明显表达差异,其他在干细胞中高表达的基因在Dicer1敲除前后也无明显改变(图2B)。大脑皮层特异层次表达的标志物中,Cux1、Cux2、Brn2、Satb2在Dicer1敲除前后表达下调(P<0.05),Er81、Rorb、Tle4、Sox5在Dicer1敲除前后表达量无明显改变(图2C)。E14.5脑组织免疫荧光染色,Pax6+的放射状胶质细胞数量在神经元发生时期尚未见明显改变(n≥3)(图2D),Dicer1 cKO小鼠中神经元的减少并不是由于神经前体细胞的减少引起的。
2.3 D6-Cre-Dicer1 cKO主要影响的信号通路
GO功能富集分析,图3显示了部分差异表达基因参与的生物学过程、分子功能、细胞成分富集结果。Dicer1条件性敲除前后主要受影响的信号通路为NF-κB信号通路、Wnt信号通路、MAPK-ERK信号通路和JAK-STAT信号通路等。Dicer1敲除后,可诱发DNA损伤和相关通路的应激。

图3 差异表达基因GO 分析图Fig 3 GO term of the differentially expressed genes
2.4 Dicer1 cKO 对神经干细胞中lncRNA Xist表达的影响
RNA-seq测序差异表达倍数前10的下调基因如表2,Xist的表达在Dicer1敲除后大量减少(P<0.001)。Xist是雌性X染色体失活必须的,经检测Dicer1敲除后位于X染色体上的Acsl4、Clcn5、Brwd5、Chic1、Vma21、Magt1、Phf6、Zfp275基因表达量上调(P<0.05)(图4A)。Dmrta2、Dmrt3、Sox3、Sox9、Sox17、Sox21、Sox30等个体性别发育相关基因,在Dicer1敲除前后表达量无明显差异(图4B)。Dicer1敲除不影响常染色体Suz12和Ezh2编码产物表达量(图4C)。
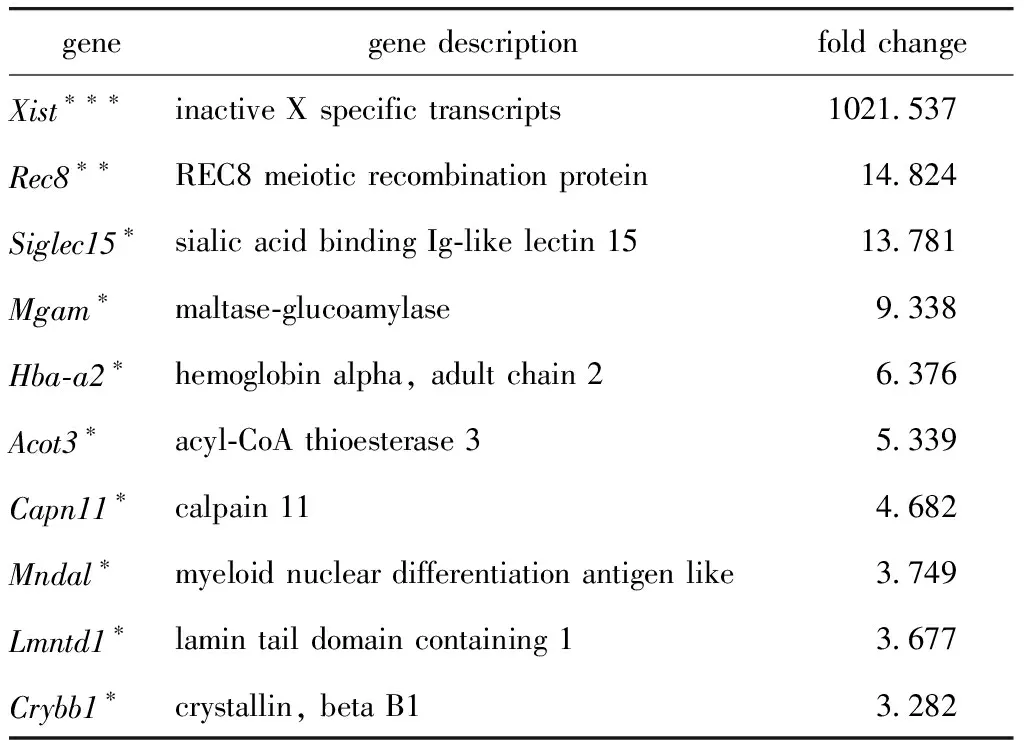
表2 Dicer1条件性敲除后差异表达前10的基因
3 讨论
70%的miRNAs在哺乳动物的大脑中表达[9],而且许多miRNAs的表达水平在大脑发育过程中都发生了变化[10],本实验通过HE染色和免疫荧光染色发现,D6-Cre介导的Dicer1的特异性敲除会导致出生后的小鼠大脑皮层发育异常,提示miRNAs可能在此过程中发挥重要调节作用。转录组学结合系统生物信息学在全基因组水平分析Dicer1条件性敲除前后的基因表达差异。Dicer1特异性敲除前后,干性相关基因表达量无明显差异,特定皮层标志物Cux1、Cux2、Brn2、Satb2表达量明显下调(P<0.05)。与此前报道的,miRNAs对干细胞自我更新是非必须的,对新皮层中指定皮层的命运决定是必不可少的[11]结果相一致。
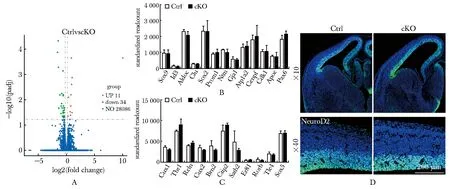
A.the differences in genes between the control group and Dicer1 cKO group were mapped to the volcano chart(P<0.05); B.statistical comparison the expression of neural stem cell markers; C.statistical comparison the marker expressed in specific layers of cerebral cortex; D.IF staining detected the expression differences of Pax6 in cerebral cortex of E14.5 mice(n≥3)
信号通路可被miRNAs靶向调节,实现通路之间的cross-talk。Dicer1敲除后主要受影响的信号通路为NF-κB信号通路、Wnt信号通路、MAPK-ERK信号通路和JAK-STAT信号通路。且神经发生早期Dicer1敲除,引发DNA损伤相关通路的应激。lncRNA Xist在雌性哺乳类X染色质沉默中发挥作用,是X染色体去活化的主要影响因子[12]。lncRNA Xist被DICER加工后可发挥生物学作用[13],Dicer1缺失的情况下,lncRNA Xist稳定性受影响[14]。转录组分析得到Dicer1敲除lncRNA Xist表达大量减少后,X染色体上Acsl4、Clcn5、Brwd5、Chic1等基因表达上调,X染色质沉默辅助多梳蛋白Suz12和Ezh2表达量无明显差异,结果与在胚胎干细胞(ES)中的检测结果一致[14]。此外,性别决定相关基因无明显表达差异,Dicer1对lncRNA Xist的调节作用与性别无关。在神经发生早期lncRNA Xist对神经干细胞的调节作用还需进一步探索。

A.genes expression on X chromosome were increased after Dicer1 cKO(P<0.05); B.influenced on sex-determined genes expression in Dicer1 cKO; C.red arrows showed increased significantly compared with Ctrl group(P<0.05); blue arrow showed decreased significantly compared with Ctrl group(P<0.05); black arrows showed no significantly difference compared with Ctrl group
综上所述,本研究利用Dicer1条件敲除鼠研究miRNAs对大脑皮层早期发育的调控作用。结果表明,miRNAs对于干细胞干性维持非必须,但参与指定皮层的命运决定过程。Dicer1的缺失将导致lncRNA Xist表达水平的下调,且其中的调控机制与性别无关。
