丁卡因急性中毒致死小鼠血清和组织的代谢组学变化
2021-06-17刘文乔白锐马春玲于峰谢冰董玫哈婧文迪
刘文乔,白锐,马春玲,于峰,谢冰,董玫,哈婧,文迪
1.河北医科大学法医学院 河北省法医学重点实验室 河北省法医分子鉴定协同创新中心 河北医科大学法医鉴定中心,河北 石家庄 050017;2.河北科技大学化学与制药工程学院,河北 石家庄050018
丁卡因(tetracaine)是一种高效的局部麻醉剂,相比其他麻醉剂具有起效快、作用持久、麻醉性能强等特点,多年来广泛应用于临床[1-2],然而,因药物过量、吸收快或操作不当误入血管等引起的中毒、致死案件时有发生[3-5]。但是,丁卡因中毒的特征性病理变化少,且缺乏中毒数据库,其相关案件的鉴定多数是通过排除其他死因后才能确定是否为中毒死亡。国内外法医学实践中,通常根据中毒者体液或者组织中丁卡因的含量来判断其是否中毒或推断死亡原因[6-8],而对其诱导的代谢改变及其与潜在毒性机制的关系知之甚少。代谢组学是系统生物学的重要分支,代谢物可反映细胞所处的环境,且与细胞的营养状态、药物和环境污染的作用以及其他外界因素的影响密切相关,被广泛应用于疾病诊断、预后判断、个体化治疗及发病机制的研究[9]。本研究采用超高效液相色谱-静电场轨道阱高分辨质谱联用(ultra-high performance liquid chromatography-electrostatic field orbitrap high resolution mass spectrometry,UPLC-Orbitrap HRMS)技术和代谢组学方法对丁卡因急性中毒致死相关代谢物的变化进行观测,结合模式识别方法,筛选出丁卡因急性中毒致死小鼠血清和组织中内源性小分子生物标志物,分析代谢通路变化规律,为丁卡因急性中毒的死因判定和毒性机制研究提供可靠的技术方法。
1 材料与方法
1.1 材料
1.1.1 实验动物
7~8 周雄性SPF 级ICR 小鼠40 只,体质量(40±2)g,购自辽宁长生生物技术股份有限公司,动物许可证号为SCXK(辽)2015-0001。将小鼠饲养于室温(23±2)℃、相对湿度(50±5)%、12 h∶12 h 光/暗循环的环境下,实验前禁食不禁水12 h。
本实验严格按照河北医科大学动物伦理学委员会的相关规定执行操作。
1.1.2 主要仪器与试剂
UltiMateTM3000高效液相色谱仪串联Q ExactiveTMFocus 质谱仪、MicroCL 21R 微量离心机(美国Thermo Scientific 公司),ME204 电子分析天平(瑞士Mettler公司),LSETM涡旋振荡器(美国Corning 公司),KQ-500DE 型数控超声波清洗机(昆山市超声仪器有限公司),Milli-Q 超纯水系统(美国Millipore 公司),G50 组织研磨器[卡尤迪生物科技(北京)有限公司]。
丁卡因盐酸盐(北京百灵威科技有限公司),色谱纯乙腈(美国Thermo Fisher Scientific 公司),色谱纯甲酸(北京迪科马科技有限公司)。
1.2 方法
1.2.1 动物模型建立及样本收集
将40 只小鼠随机分为对照组(20 只)和丁卡因急性中毒致死组(20 只)。急性中毒致死组小鼠给予50 mg/kg 丁卡因盐酸盐溶液腹腔注射,以呼吸心搏停止,角膜反射、疼痛反射、大血管搏动消失来判断小鼠是否死亡。24 h 内小鼠死亡表明急性丁卡因中毒死亡模型建立成功[7],若小鼠在24 h 内未死亡则排除于本实验。
急性中毒致死组小鼠于死后立即进行解剖,采集腹主动脉血于不添加抗凝剂的离心管中,在冰上凝固30 min,然后于4 ℃下以离心半径8.5 cm,8 000 r/min,离心10 min,收集血清于离心管中并迅速在液氮中冷冻。取心脏、肝、肺、脑、肾和肌肉,所有组织均用去离子水冲洗以去除多余的血液,取出部分组织置于含10%中性甲醛溶液的离心管中用于组织病理学检验,剩余组织在滤纸上吸干,置于离心管,在液氮中淬灭。
对照组小鼠用等量生理盐水腹腔注射,注射后0.5 h 颈椎脱臼处死,之后按照急性中毒致死组相同的程序和时间处理并提取血清和组织。
所有样本置于-80 ℃保存。
1.2.2 组织病理学检验
将心脏、肝、肺、脑、肾和肌肉组织置于10%中性甲醛溶液中固定24 h,石蜡包埋、切片后进行HE 染色,在光镜下进行形态学观察。
1.2.3 样本前处理
血清样本处理:取100 μL 血清样本,加入300 μL预冷的萃取溶剂(V乙腈∶V甲醇=1∶1),充分涡旋振荡后超声10 min,放入-20 ℃冰箱中静置20 min,然后于4 ℃下以离心半径8.5 cm,12 000 r/min,离心10 min。吸取上清液,微孔滤膜过滤后进行UPLC-Orbitrap HRMS分析。
组织样本(心脏、肝和肾)处理:将冷冻的组织样本用研磨器研磨,称取粉碎后的组织样本约100 mg(湿质量),迅速转移至干冰预冷的离心管中,再放回干冰中,然后加入300 μL 预冷的纯水,用组织研磨器充分匀浆,再加入300 μL 预冷的萃取溶剂(V乙腈∶V甲醇=1∶1),充分涡旋振荡后超声10 min,放入-20 ℃冰箱中静置20 min,然后于4 ℃下以离心半径8.5 cm,12 000 r/min,离心10 min。吸取上清液,微孔滤膜过滤后进行UPLC-Orbitrap HRMS 分析。
质量控制(quality control,QC)样本的制备:分别取每个处理完成的样本10 μL 混合为QC 样本,用于评价实验过程中系统的稳定性。
1.2.4 UPLC-Orbitrap HRMS检测
色谱条件:ACQUITY UPLC HSS T3 色谱柱(100 mm×2.1 mm,1.8 m,美国Waters 公司),柱温40 ℃,流速300 μL/min,进样量5 μL。流动相:0.1%甲酸水溶液(A)和0.1%甲酸乙腈(B)。线性梯度洗脱程序:0~1 min,2% B;1~3 min,2%~15% B;3~6 min,15%~50% B;6~9 min,50%~95% B;9~12 min,95% B;12~12.01 min,95%~2% B;12.01~15 min,2% B。整个分析过程,样品置于4 ℃自动进样器中。为避免仪器检测信号波动造成的影响,采用随机顺序进行样本的连续分析。样本队列中先连续设置5 个QC 样本,然后每间隔10 个实验样本设置1 个QC 样本,用于监测和评价系统的稳定性及数据的可靠性。
质谱条件:采用加热电喷雾电离(heated electrospray ionization,HESI)正负离子同时扫描模式进行检测。喷雾电压2.5 kV,毛细管温度250 ℃,加热器温度400 ℃,鞘气、辅助气体和吹扫气体流速分别为50.0、13.0 和3.0 L/min。在Full MS/ddMS2扫描模式下进行分析,扫描范围(m/z)为80~1 200;一级质谱扫描的分辨率设置为70 000,二级质谱扫描的分辨率设置为17 500;归一化碰撞能量(normalized collision energy,NCE)为12.5、25.0 和37.5 eV。
1.2.5 数据预处理
将原始数据导入Compound Discoverer 3.0 软件(美国Thermo Fisher Scientific 公司)中进行数据预处理。使用空白样本进行背景扣除和噪声去除,原始数据预处理步骤:色谱峰提取、保留时间对齐、空值填充、基于QC 的峰面积校正和归一化[变异系数(coefficient of variation,CV)<30%[10]]。被检测到的最小峰值强度设置为1×106,质量数匹配公差为5×10-6,强度公差为30%,信噪比(S/N)阈值为3,碎片首选加合离子设置为[M+H]+1、[M-H]-1。
1.3 数据分析
将预处理的数据导入SIMCA-P 14.1 软件(瑞典Umetrics 公司)中进行多元统计分析。采用无监督的多元统计分析方法主成分分析(principal component analysis,PCA)模型反映总体样本的分布状态、自然聚集以及异常样本,通过QC 样本的聚集度考察数据采集的质量。采用有监督的正交偏最小二乘-判别分析(orthogonal partial least square-discriminant analysis,OPLS-DA)模型使组间区分最大化。多变量分析之前,对变量进行对数变换和数据归一化(通过Pareto scaling)。使用R2Y(表示解释能力)和Q2Y(表示预测能力)这两个指标评价OPLS-DA 模型的拟合效果,指标越接近1,表明OPLS-DA 模型数据拟合效果越好。可接受的Q2Y阈值应该超过0.5[11]。进行200 次置换检验来确定模型是否过拟合。基于OPLS-DA 还可对每个变量求一个变量投影重要性(variable importance in projection,VIP)值来选择最重要的代谢物,并对VIP 值大于1.0 的代谢物进一步分析。
在Compound Discoverer 3.0 软件中做火山图,以差异倍数(fold change,FC)≥2 或FC≤0.5 以及t检验(检验水准α=0.05)为标准,筛选出具有统计学意义的差异代谢物。在本研究中,同时满足VIP>1、FC≥2 或FC≤0.5、P<0.05 的化合物被认为是差异代谢物。
通过与数据库METLIN(http://metlin.scripps.edu)和HMDB(http://www.hmdb)的标准质谱图匹配准确的质量数和片段信息,进一步鉴定筛选出的差异代谢物,并应用MetaboAnalyst 3.0 软件(http://www.metaboanalyst.ca)进行代谢途径分析,以富集分析(P<0.05)和拓扑分析(impact>0.1)为标准进一步评估潜在的生物标志物。以京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG;https://www.genome.jp/kegg/)为参考依据,得到丁卡因急性中毒致死扰乱的主要代谢途径。
2 结果
2.1 动物模型
丁卡因急性中毒致死组小鼠在腹腔注射丁卡因后1~5 min 即出现颤抖、步履蹒跚、全身抽搐、耸毛、不能直立等症状,稍后有流涎、惊厥、瘫痪和自残行为,所有小鼠均在注射丁卡因后0.5 h 内死亡,表明丁卡因急性中毒致死小鼠模型建立成功。对照组小鼠腹腔注射生理盐水后,无明显异常表现。
2.2 组织病理学改变
丁卡因急性中毒致死组小鼠肝细胞肿胀,胞质疏松,肝板结构消失,空泡变性;心肌间质水肿,间隙变宽;肾组织中可见肾小管淤血,血管扩张;肺、脑和肌肉组织内未见明显的改变。组织病理学改变见图1。

图1 丁卡因急性中毒致死小鼠的组织病理学改变(HE×400)Fig.1 Histopathological changes of mice died of acute tetracaine poisoning(HE×400)
2.3 代谢组学分析
对血清、肝、心脏和肾组织样本进行前处理后,用UPLC-Orbitrap HRMS 在正负离子同时扫描模式下进行分析检测。对原始数据进行预处理,结果血清样本中得到976 个变量,肝组织样本中得到1 264 个变量,心脏样本中得到875 个变量,肾组织样本中得到1 074 个变量。PCA 得分图(图2)显示:QC 样本均表现出良好的聚集现象,说明该方法具有良好的重复性和系统稳定性;对照组和丁卡因急性中毒致死组样本均有明显的分离趋势,说明两组样本代谢物含量差异较大。

图2 对照组和丁卡因急性中毒致死组小鼠血清和组织样本以及QC样本的PCA得分图Fig.2 PCA score plots of serum and tissue samples of mice in the control group,acute tetracaine poisoning death group and QC samples
2.4 差异代谢物的筛选与鉴定
为了筛选出与丁卡因急性中毒致死相关的差异代谢物,进一步采用OPLS-DA 模型对丁卡因急性中毒致死组和对照组样本进行分析,两组均有良好的区分,且聚类趋势明显(图3)。两组间OPLS-DA 模型的R2Y和Q2Y值均大于0.5 并接近1(表1)。
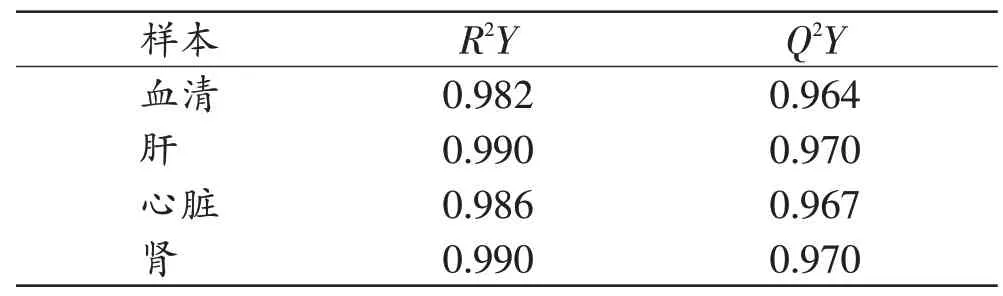
表1 血清和组织样本的OPLS-DA模型参数Tab.1 OPLS-DA model parameters in serum and tissue samples
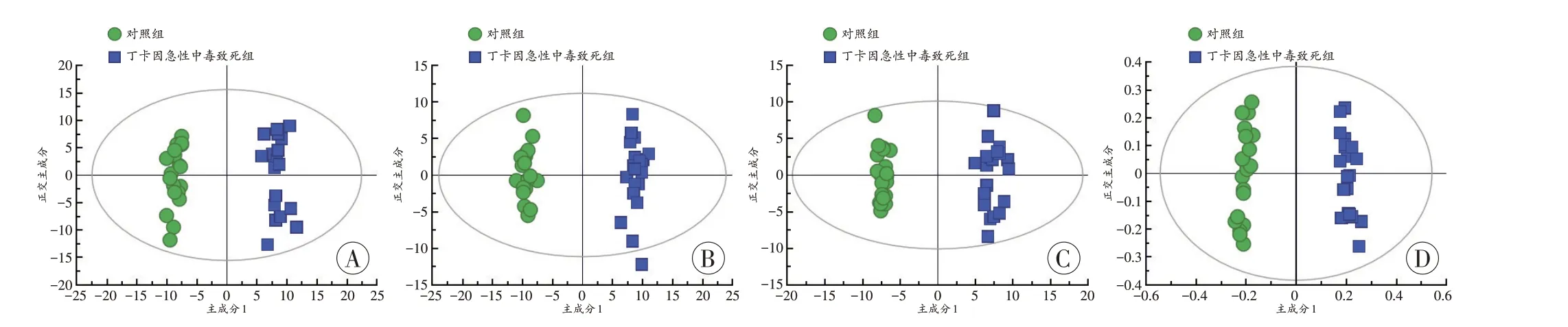
图3 对照组和丁卡因急性中毒致死组小鼠血清和组织样本的OPLS-DA得分图Fig.3 OPLS-DA score plots of serum and tissue samples of mice in the control group and acute tetracaine poisoning death group
为了进一步验证各OPLS-DA 模型的可靠性,采取200 次置换检验方法进行评价,结果见图4。经置换检验得到的R2和Q2值均小于右侧原点实际模型值,Q2回归直线在y轴上的截距小于0,说明模型没有过拟合。基于OPLS-DA 模型还对每个变量求出一个VIP 值,以VIP>1 为筛选条件,找到重要的变量。再以FC≥2或FC≤0.5,P<0.05为筛选条件,找到差异代谢物。

图4 对照组和丁卡因急性中毒致死组血清和组织样本OPLS-DA的200次置换检验结果Fig.4 Permutation test results(200 times)of OPLS-DA of serum and tissue samples in the control group and acute tetracaine poisoning death group
对筛选出的差异代谢物的精确分子质量和二级碎片离子进行在线数据库匹配,鉴定结果见表2。血清样本中鉴定出11 种差异代谢物,其中7 种上调,4 种下调;肝组织样本中鉴定出25 种差异代谢物,其中17 种上调,8 种下调;心脏样本中鉴定出12 种差异代谢物,其中7 种上调,5 种下调;肾组织样本中鉴定出4 种差异代谢物,全部上调。

表2 血清和组织样本中的差异代谢物Tab.2 Differential metabolites in serum and tissue samples
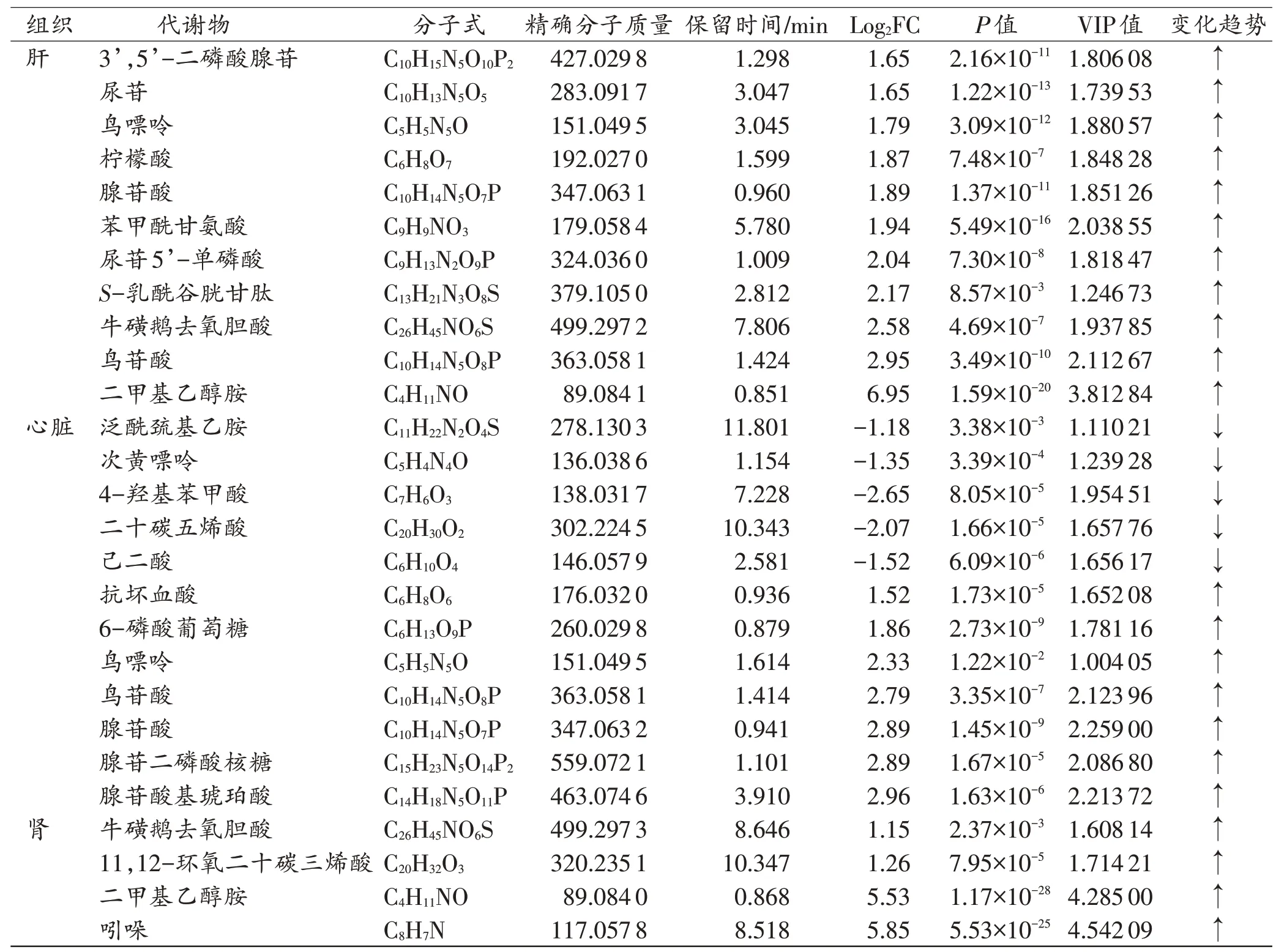
续表2Continued Tab.2
2.5 相关代谢途径分析
将血清、肾、肝和心脏样本中鉴定出来的差异代谢物用MetaboAnalyst 3.0 软件进行代谢通路分析,结果如图5 所示。嘌呤代谢在血清、肝和心脏样本代谢通路分析结果中均显示受到显著影响。肝组织样本代谢通路分析结果显示三羧酸循环,丙氨酸、天冬氨酸和谷氨酸代谢也受到显著影响(P<0.05)。肾组织样本代谢通路分析结果显示某些受到干扰的代谢通路如花生四烯酸代谢的-lgP值与impact 值均较低,意味着这些途径中变化的代谢物可能在丁卡因中毒中没有起关键作用。丁卡因急性中毒致死扰乱的主要代谢途径见图6。
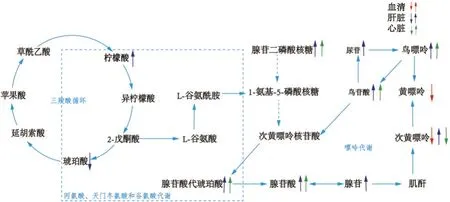
图6 差异代谢物的显著相关代谢通路示意图Fig.6 Schematic diagram of significant related metabolic pathways of differential metabolites

图5 对照组和丁卡因急性中毒致死组小鼠血清和组织样本差异代谢物的代谢通路分析Fig.5 Metabolic pathway analysis of differential metabolites in serum and tissue samples of mice in the control group and acute tetracaine poisoning death group
3 讨论
近年来,随着美容整形行业的兴起,局部麻醉剂的应用逐渐增多,同时,所引起的中毒、致死案件频繁发生。在这些中毒案件中,用药过量或误入血管是导致死亡的主要原因。在局麻药中,丁卡因是常见的致死药物之一,其使用方便,但缺乏安全管理措施。因此,本研究选择丁卡因建立中毒小鼠死亡模型,通过预实验确定了丁卡因单次腹腔注射的最小致死剂量为50 mg/kg。过量丁卡因被吸收进入血液循环后,立即以较高的浓度到达脑和心脏,引起急性毒性反应,如恶心、呕吐、神色不安、眩晕、抽搐等[12-13],本实验观察到的小鼠急性中毒症状与其一致。组织病理学检验结果发现,除肝、心脏水肿以及肾淤血外,并无其他明显的致死性改变。利用PCA 和OPLS-DA 对血清、肝、心脏和肾组织的实验数据建立模式识别模型,经置换检验模型未过拟合,说明模型可靠。
代谢组学是系统生物学研究方法之一,主要研究生物样品中的低分子量内源性代谢物[14],是研究环境或内源性因素引起的代谢表型变化的一种新兴的组学方法,对于复杂系统的深入研究具有潜在的应用优势[15-16],近年来在法医毒理学中的应用已有较多报道[17]。目前,在小分子识别过程中主要应用高效液相色谱-高分辨质谱平台,利用高分辨质谱可以分析化合物的结构信息,特别是生物体内的代谢物。轨道离子阱质谱仪具有较高的灵敏度和分辨率,在代谢组学研究中得到了很好的发展和广泛的应用[18]。本研究通过UPLC-Orbitrap HRMS 的非靶向代谢组学研究,发现了一些与丁卡因急性中毒致死相关的潜在生物标志物。
虽然多种代谢物在死亡后发生变化,但并非都与丁卡因急性中毒致死有关。一般根据OPLS-DA 模型的VIP 值选择差异代谢物,VIP 值大于1 的代谢物被认为是重要的变量[19],然而,对于代谢物的选择并没有一个客观的标准。为了在法医学实践中构建一个快速的死因判定估计模型,理想的方法是使用较少但具有较高准确性的代谢物。本研究以FC≥2 或FC≤0.5且P<0.05 为标准筛选生物标志物[20]。研究发现,这些代谢物在不同组织之间有很大的差异,表明每种组织中的代谢对丁卡因急性中毒有不同的反应。但在组织间存在共同的差异代谢物,包括4-羟基苯甲酸、腺苷二磷酸核糖、腺苷酸琥珀酸、鸟嘌呤、鸟苷酸和腺苷酸(肝、心脏);牛磺鹅去氧胆酸、二甲基乙醇胺(肾、肝、血清);3-羟基丁酸、邻氨基苯甲酸(血清、肝);次黄嘌呤(肝、心脏、血清);吲哚(肾、血清)。这表明不同组织中的代谢对丁卡因急性中毒致死反应存在共同的特征。本研究还探讨了与差异代谢物相关的代谢途径,主要影响了嘌呤代谢,三羧酸循环,丙氨酸、天冬氨酸和谷氨酸代谢,揭示了主要受影响的代谢途径与丁卡因急性中毒的关系。
有报道[21]称,局麻药的毒性机制可能是氧化应激和细胞凋亡,但丁卡因的中毒机制目前尚未完全明确。三羧酸循环是所有需氧生物中通过将从蛋白质、脂肪和碳水化合物中提取的十六烷基-辅酶A 氧化成二氧化碳和三磷酸腺苷(adenosine triphosphate,ATP)而产生能量的一系列生化反应[22-23]。同时,三羧酸循环提供某些氨基酸的前体作为其他生化反应的物质和细胞活动的可用化学能[24-26],在许多生物学途径中的中心作用表明其是碳水化合物、脂肪和蛋白质代谢的枢纽。柠檬酸和琥珀酸是三羧酸循环的中间产物。本研究中,在丁卡因中毒致死小鼠肝组织中,柠檬酸含量显著增加,琥珀酸含量降低,提示三羧酸循环功能障碍,与文献[21]报道一致。在真核细胞中,三羧酸循环是产生ATP 的主要途径[27]。在本研究中,随着中间产物柠檬酸、琥珀酸在三羧酸循环中浓度的改变,表明三羧酸循环代谢水平的降低以及随后ATP 的产生和能量代谢的下降。由于过量使用丁卡因诱导的三羧酸循环受损导致ATP 产生不良,不仅影响细胞能量代谢,还影响其他需要足够ATP 供应的途径。本研究结果显示,丙氨酸、天冬氨酸和谷氨酸代谢途径的改变也可能是线粒体代谢紊乱的结果,因为参与能量代谢的代谢物也是上述许多途径的重要中间产物。此外,有研究[28]结果表明,三羧酸循环的紊乱与药物性肝损伤密切相关,本研究结果与其一致,说明丁卡因中毒可诱导肝毒性。同时,本研究组织病理学检验结果显示肝细胞损伤也证明了这一点。
嘌呤是一组重要的细胞成分,在多种生物过程中起着重要的作用。在细胞增殖过程中,DNA 复制和RNA 生成为蛋白质合成提供了支持,因此,有必要在细胞周期的不同阶段增加核苷酸的合成[29]。本研究发现,急性丁卡因中毒致死组小鼠在肝、心脏和血清中均鉴定出嘌呤代谢物,肝组织中嘌呤相关代谢物显著增加,包括鸟苷酸、尿苷、腺苷、腺苷酸、腺苷酸基琥珀酸和次黄嘌呤,提示嘌呤代谢增强,意味着丁卡因急性中毒促进了细胞的增殖。次黄嘌呤可通过黄嘌呤氧化酶转化为黄嘌呤,在单磷酸腺苷降解过程中,黄嘌呤是一种中间体,对于形成活性氧(reactive oxygen species,ROS)至关重要[30]。心脏中黄嘌呤上游代谢物鸟苷酸、鸟嘌呤、腺苷酸和腺苷酸基琥珀酸均增加,而次黄嘌呤降低,可能是由于黄嘌呤氧化酶的下调所致。总的来说,嘌呤代谢活动的增加导致ROS 形成,从而可能发生氧化应激。血清中黄嘌呤和次黄嘌呤水平的降低,表明丁卡因急性中毒死亡的过程中氧化应激可能得到了缓解。
本研究建立了代谢组学分析方法,筛选与丁卡因中毒相关的潜在生物标志物,确定发生显著变化的代谢通路。研究结果表明,该方法和模型在丁卡因中毒小鼠的死因判定研究中具有一定的潜力。本研究为药物过量中毒死因判定提供了研究基础,提示了运用该方法在实际检案中进行毒物中毒死因判定的可能性。
