大鼠皮肤切创损伤时间与血清标志代谢物的关系
2021-06-17田甜李雪榕翟豪杰张旭东李明刘敏
田甜,李雪榕,翟豪杰,张旭东,李明,刘敏
1.四川大学华西基础医学与法医学院,四川 成都 610041;2.山西医科大学法医学院,山西 太原 030001;3.黄南藏族自治州公安局,青海 黄南811399
皮肤切创是法医学实践中常见的损伤之一,研究发现磷酸化c-Jun 氨基端蛋白激酶(phosphorylated c-Jun N-terminal protein kinase,p-JNK)[1]、肌成纤维细胞[2]等多种生化标志物均表现出与切创损伤时间相关的变化规律,但因为生化指标多呈波形改变,同一表达量可对应多个时间点,无法确定具体时间,且伤后短时间内的组织形态学变化也无特异性,因此,切创的损伤时间推断一直是法医学实践的难点及研究热点。
代谢组学是应用现代分析方法对某一生物组织、细胞在一特定生理时期内所有相对分子质量低的代谢产物进行定性和定量分析的一门新学科[3],现已广泛应用于药物分析、疾病诊断等领域。柳丹凤[4]发现烧死与不同原因死后焚尸的大鼠肝组织代谢物存在差异,代谢组学方法可用于烧死与死后焚尸的鉴别。田甜等[5-6]使用代谢组学方法检测出电击死与死后电击大鼠血清、血浆的代谢产物均存在差异,该方法有望用于电击死和死后电击的鉴别。本研究拟建立大鼠皮肤切创模型,使用气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)技术对切创后不同时间点的血清进行代谢组学检测,应用正交偏最小二乘-判别分析(orthogonal partial least squarediscriminant analysis,OPLS-DA)模型进行多元数据分析,筛选血清标志代谢物,建立标志代谢物含量变化与损伤时间之间的回归模型,以期为切创损伤时间的推断提供新的思路。
1 材料与方法
1.1 动物分组及模型建立
健康成年SPF 级SD 大鼠21 只,其中雌鼠9 只(体质量219~225 g)、雄鼠12 只(体质量325~411 g)。适应性饲养1 周后,将大鼠随机分为对照组(3 只)和实验组(18 只),实验组再分为切创后1、2、4、8、16、24 h组,每组3 只。实验前12 h 禁食禁水处理。所有大鼠均用乙醚麻醉。
麻醉生效后,实验组大鼠于背部正中备皮,使用洁净手术刀片纵向切割长度为3 cm 深达浅筋膜的皮肤全层创口;对照组大鼠麻醉后不做任何处理。
本实验获得四川大学动物伦理学委员会批准。
1.2 样本采集及前处理
实验组大鼠于伤后1、2、4、8、16、24 h 取股动脉血液1.5 mL。对照组大鼠于麻醉后直接取股动脉血液1.5 mL。血样以离心半径5.5 cm,3 000 r/min,离心10 min,取上清液置于-20 ℃冰箱中待检。
1.3 样本前处理
血清样本:取血清10 μL 置于1.5 mL 离心管中,加入-20 ℃冰乙腈30 μL,涡旋2 min 后,在4 ℃下,以离心半径10 cm,12 000 r/min,离心10 min,吸取20 μL上清液至杜氏小管中,氮吹仪吹干。加入10μL质量浓度为15 mg/mL 的甲氧胺盐酸盐吡啶溶液,密封涡旋2 min 后,置于16 ℃的黑暗环境中肟化16 h。肟化完成后迅速加10 μLN,O-双(三甲基硅烷基)三氟乙酰胺[N,O-bis(trimethylsilyl)trifluoroacetamide,BSTFA]+1%三甲基氯硅烷(trimethyl chlorosilane,TMCS),密封涡旋2 min 后,置于70 ℃烘箱中硅烷化,1 h 后取出在黑暗环境中冷却1 h。待冷却至室温后加入100 μL质量浓度为10 μg/mL 的硬脂酸甲酯庚烷溶液作为内标,涡旋2 min 后静置10 min,取上清液行GC-MS分析。
质量控制(quality control,QC)样本:取各组血清各10 μL于5 mL离心管中离心混匀,获得QC样本。取10μL QC样本于1.5mL离心管中,余操作同血清样本。
空白样本:取洁净杜氏小管,加入-20 ℃冰乙腈30 μL,氮吹仪吹干,余操作同血清样本。
1.4 GC-MS检测
采用MA 等[7]报道的GC-MS 的检测条件进行检测,参数如下。
(1)色谱条件:DB-35ms 毛细管色谱柱(30 m×250 μm,0.25 μm;美国Agilent 公司),载气为高纯氦气,流速1 mL/min,进样口温度250 ℃,辅助加热器温度230 ℃,分流比为10∶1;柱温为起始温度60 ℃,保持1 min,以8 ℃/min 升至300 ℃,保持5 min。
(2)质谱条件:离子源温度230 ℃,四极杆温度150 ℃;采用电子轰击电离方式,电离能量70 eV,溶剂延迟4 min;采用全扫描模式监测,全扫描范围m/z50~600,扫描速度为2 spectra/s。
(3)进样条件:自动进样,每次进样量为1 μL,进样前用异丙醇清洗进样针。
(4)进样顺序:按照1 针空白样本、3 针QC 样本、10 针血清样本、1 针QC 样本、11 针血清样本、2 针QC样本的顺序完成进样。
1.5 数据预处理
使用AMDIS 6.51 软件(美国国家标准与技术研究院)对获得的GC-MS 原始谱图进行去卷积后,用NIST 2014 质谱库对各色谱峰(匹配度大于80%且峰面积大于10 000)进行定性,并与人类代谢组学数据库(https://hmdb.ca/)比对,获得代谢产物的名称、保留时间和峰面积。再按接近的保留时间将色谱峰对齐、排列(保留时间偏差<2%)。删除血清样本中保留时间一致的代谢物中峰面积大于空白样本和QC 样本的数据,以排除色谱峰噪声。使用算术平均值填补空白,得到每一种代谢物的相对峰面积,即代谢物峰面积/本组内标峰面积。
1.6 统计分析及标志代谢物筛选
使用SIMCA-P 14.1 软件(瑞典Umetrics 公司)对数据进行OPLS、OPLS-DA 置换检验,得到R2、Q2值,R2表示模型的解释能力,Q2表示模型的预测能力,R2、Q2终点越接近,同时Q2回归直线与Y 轴有负截距,说明模型有效,无过度拟合现象,实验组与对照组之间数据存在差异。OPLS-DA 模型验证参数为R2X、R2Y、Q2。R2X为模型对自变量X数集上的解释能力,R2Y为模型对因变量Y数集上的解释能力,Q2表示模型的预测能力。当Q2>0.4,且与R2Y差值不超过±0.3 时,认为模型有效,数据可靠[8]。
使用SIMCA-P 14.1 软件对验证成功的数据进行多元统计分析。使用主成分分析(principal component analysis,PCA)对含QC 样本的多组样本进行识别分析,得出PCA 得分图,QC 样本聚集在小范围内表示仪器稳定及代谢物数据可靠。使用OPLS-DA 的识别方法对各组样本进行两两比对,筛选标志代谢物,得到所有变量的变量投影重要性(variable importance in projection,VIP),选取VIP 值大于1.0 的变量,再通过SPSS 22.0 软件进行单因素方差分析筛选出同时满足VIP>1.0 且P<0.01 的损伤时间相关性标志代谢物。
最后对标志代谢物进行OPLS 分析,得到以预测损伤时间为自变量、实际损伤时间为因变量的线性回归模型,获得复相关系数(multiple correlation coefficient,R)。R值范围为0~1,其值越接近1,线性回归关系越密切,回归模型建立越成功。
2 结果
2.1 QC样本检测结果
将实验组样本、空白样本及QC样本数据一起使用SIMCA-P 14.1软件进行PCA分析,获得得分图(图1),QC 样本分布较为集中,说明系统误差小,结果可靠。

图1 所有样本数据的PCA得分图Fig.1 PCA score plot for all sample data
2.2 GC-MS谱图
使用GC-MS 技术对各组样本进行检测,获得代谢产物的原始色谱图。比较不同损伤时间点的样本色谱图,发现各实验组之间的色谱峰存在差异。
2.3 标志代谢物的初筛
选取得到色谱峰数量最多的QC 样本进行物质定性并作为峰对齐的参照标准。QC样本共有197个色谱峰,将其逐一与NIST 2014质谱库比对,以匹配度>80%为条件筛选出46 个色谱峰,结合人类代谢组学数据库进一步匹配出21 种内源性代谢物,包括有机酸类(乳酸、琥珀酸、壬酸、碳酸、三氯乙酸、软脂酸、反式亚麻酸、11-亚油酸、硬脂酸、花生四烯酸),糖类(来苏糖、甘露糖、阿洛糖、葡萄糖、半乳糖),醇类(甘油、肌醇、油酰二乙醇胺),以及甲酰胺、胆固醇、2,4-二叔丁基苯酚等。随后对这21 种内源性代谢物归一化,获得相对峰面积。
2.4 多元统计分析
2.4.1 模型验证结果
经SIMCA-P 14.1 软件处理,所有实验组样本作为一个整体与对照组进行比较,在置换检验数量为200 的条件下,R2=0.386,Q2=-0.696,且两者在终点趋于重合(图2),提示模型验证成功,无过度拟合现象,实验组与对照组之间数据存在差异。各实验组与对照组以及实验组之间进行模式识别时,置换检验结果同样提示模型验证成功,各组之间数据存在差异,本实验所得数据均可用于进一步分析。
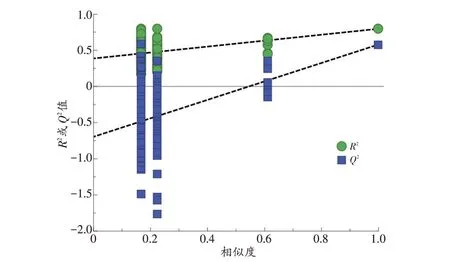
图2 实验组与对照组OPLS-DA的200次置换检验结果Fig.2 Permutation test(200 times)results of OPLS-DA in the experimental group and the control group
2.4.2 多元统计分析结果
使用OPLS-DA 模式分别对各实验组和对照组进行多元数据分析,伤后2 h 组与对照组相比,R2Y=1,Q2=1,说明获得的数据可靠,模型对差异的识别能力强、预测能力好,并获得得分图(图3),两组数据能完全分开。其余各实验组与对照组之间比较的结果与伤后2 h 组类似。

图3 伤后2 h组和对照组OPLS-DA分析的得分图Fig.3 Score plot of OPLS-DA analysis in the 2 h after injury group and the control group
对相邻两实验组进行多元数据分析,伤后1 h 组与伤后2 h 组相比,R2Y=1,Q2=0.991,并获得得分图(图4),两组数据能完全分开。其余相邻两组之间的比较结果同伤后1 h 与伤后2 h 组比较结果类似。

图4 伤后1 h组和伤后2 h组OPLS-DA分析的得分图Fig.4 Score plot of OPLS-DA analysis in the 1 h after injury and the 2 h after injury group
对实验组整体与对照组进行多元数据分析,R2Y=0.943,Q2=0.64,并获得得分图(图5),实验组内各时间点数据能完全分开,说明各实验组间数据存在差异,可用于后续分析。
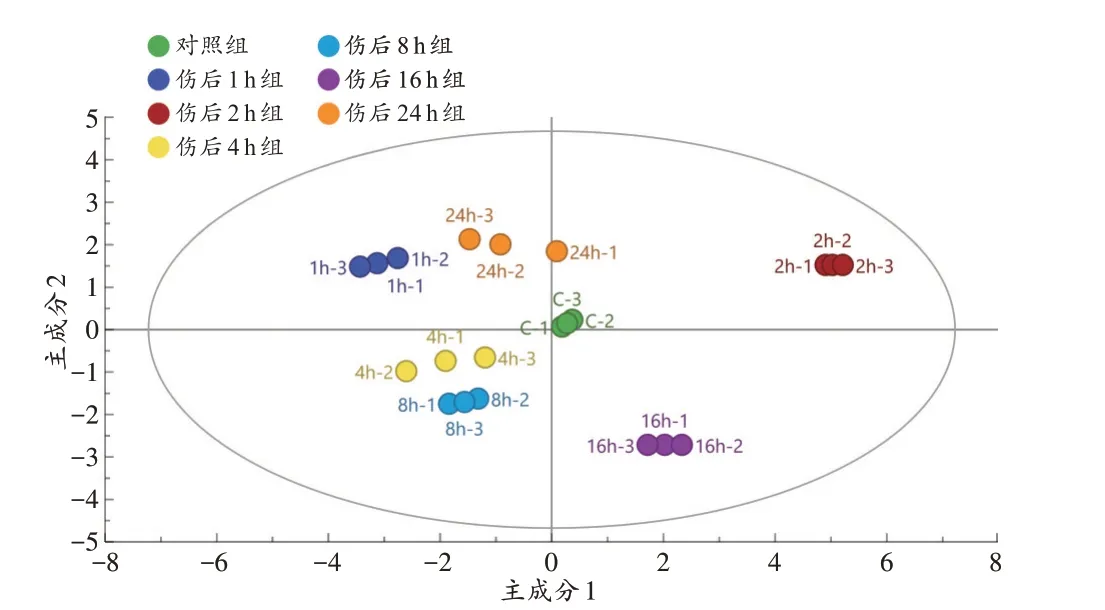
图5 实验组和对照组OPLS-DA分析的得分图Fig.5 Scores plot of OPLS-DA analysis in all experimental groups and the control group
2.5 标志代谢物筛选结果及随损伤时间的变化
将筛选出的21 种标志代谢物数据进行OPLS-DA分析,结合VIP 值,通过单因素方差分析,最终获得4 种标志代谢物,分别是胆固醇、2,4-二叔丁基苯酚、琥珀酸和甘油。
2,4-二叔丁基苯酚含量在伤后8 h 内缓慢增加,8~16 h 迅速上升至最高值,16 h 后迅速下降,变化曲线呈平缓走行-快速上升-快速下降形态,其余标志代谢物含量无明显变化(表1)。
表1 实验组和对照组中4种标志代谢物的相对峰面积Tab.1 The relative peak area of 4 marker metabolites in each experimental group and the control group (n=3,)

表1 实验组和对照组中4种标志代谢物的相对峰面积Tab.1 The relative peak area of 4 marker metabolites in each experimental group and the control group (n=3,)
注:1)与对照组比较,P<0.05;2)与相邻上组比较,P<0.05。
大鼠皮肤切创后,4 种标志代谢物含量随损伤时间的推移发生一定变化,但各标志代谢物含量与损伤时间之间无明显规律,利用4 种标志代谢物的含量变化情况无法直接推算损伤时间。
2.6 皮肤切创损伤时间推断回归模型的建立
2.6.1 4 种标志代谢物与皮肤切创损伤时间之间回归模型的建立
将4 种标志代谢物的数据输入SIMCA-P 14.1 软件,使用OPLS 模式进行处理,获得回归直线及回归方程y=x-2.174×e8(e为自然常数,R2=0.704 9,图6),说明血清中4 种标志代谢物的相对峰面积与损伤时间之间的关系较密切。应用该回归方程对损伤时间进行预测,预测时间与损伤时间的差别波动较大(表2),损伤时间推断准确性低。

图6 使用OPLS模式得到的4种标志代谢物的回归曲线Fig.6 Regression curve of 4 marker metabolites using OPLS model
表2 利用4种和21种标志代谢物的回归曲线预测所得的损伤时间Tab.2 The wound age predicted using regression curves of 4 and 21 marker metabolites (n=3,,h)
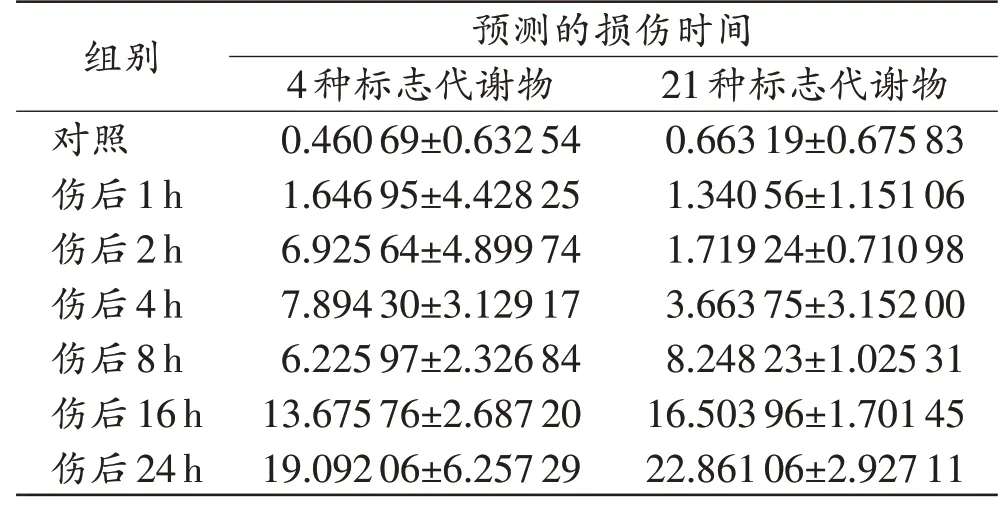
表2 利用4种和21种标志代谢物的回归曲线预测所得的损伤时间Tab.2 The wound age predicted using regression curves of 4 and 21 marker metabolites (n=3,,h)
2.6.2 21 种标志代谢物与皮肤切创损伤时间之间回归模型的建立
将21 种标志代谢物的数据输入SIMCA-P 14.1软件,使用OPLS 模式进行处理,获得回归直线及回归方程y=x+2.858×e7(e为自然常数,R2=0.961 1,图7),说明血清中21 种标志代谢物的相对峰面积与损伤时间之间的关系较密切。应用该回归方程对损伤时间进行预测,发现预测时间与损伤时间的差别明显减小(表2),损伤时间推断准确性有所提升,提示使用全部21 种标志代谢物所获得的回归模型对皮肤切创的损伤时间推断准确性较高。
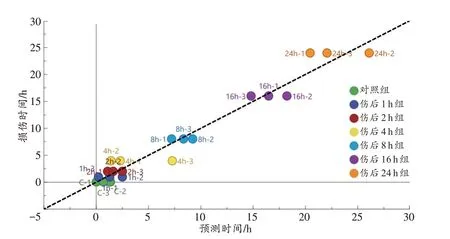
图7 使用OPLS模式得到的21种标志代谢物的回归曲线Fig.7 Regression curve of 21 marker metabolites using OPLS model
3 讨论
3.1 GC-MS数据评价
GC-MS 作为代谢组学研究中常见的检测手段之一,其性能已得到公认。但由于仪器每次运行时稳定性及响应性不同、实验人员操作水平不一等多种因素,会对代谢组学获得的原始数据产生一定影响,设置QC 样本是对仪器稳定情况及数据可靠程度进行监测的最快捷有效的方法。QC 样本由所有样本等量混合后均分,其组分相同,于样本前、样本间、样本后穿插进样。所有数据进行PCA 分析后,QC 样本在PCA得分图上分布集中,代表QC 样本经GC-MS 检测所获得的数据差别微小,说明仪器稳定性较好,实验操作误差等对实验结果的影响较小,实验数据可靠,可用于后续分析。
3.2 血清中4种标志代谢物的含量变化与损伤时间的关系
对于损伤时间的推断,目前多采用免疫组织化学法[9-10]和Western 印迹法[11-12],有学者尝试通过检测损伤后体内mRNA[13-14]或DNA[15]的表达情况对损伤时间进行推测,但mRNA 和DNA 都存在易降解、稳定性差的问题。研究结果表明,在皮肤切创后,随着损伤时间的推移,机体在基因层面[16]、蛋白层面[17]、组织微观层面[16]都发生了不同程度的变化,这些变化最终都会导致体内代谢产物发生改变。代谢组学正是通过分析机体内源性代谢产物的变化情况来反映机体当时的整体状态[18]。近年来,代谢组学技术开始向法医学科渗透,但目前应用较多的为法医毒物分析领域[19]。
国内在法医病理学领域应用代谢组学的研究目前才刚起步。鲁翰霖[20]研究发现,大鼠骨骼肌挫伤后出现了明显的代谢差异,筛选出的5 种特征标志代谢物表现出与时间相关的表达规律,联合受试者操作特征(receiver operating characteristic,ROC)曲线进行损伤时间推断具有较高的准确性,本研究所得结果与其存在相似性。
本研究发现,由皮肤切创后血清中的代谢产物可获得4 种标志代谢物(甘油、琥珀酸、2,4-二叔丁基苯酚、胆固醇)。尽管这4 种标志代谢物的含量均随损伤时间延长而出现不同的变化规律,但这些变化规律与损伤时间无对应关系,推测可能与伤后局部应激反应和全身应激反应代谢产物入血的时间存在差异有关。因此,仅从本研究所得结果来看,无法直接使用这4 种标志代谢物的含量推断损伤时间。
3.3 OPLS 回归模型在皮肤切创损伤时间推断中的应用评价
3.3.1 4种标志代谢物的OPLS回归模型
使用OPLS 模式对4 种标志代谢物进行多组间统计分析,获得了回归模型,但用模型预测的损伤时间和实际损伤时间之间的差别较大,提示此模型的拟合度虽然较好,但准确性低,难以用于损伤时间推断。
3.3.2 21种标志代谢物的OPLS回归模型
使用OPLS 模式对21 种标志代谢物进行多组间统计分析,获得了回归模型,用模型预测的损伤时间和实际损伤时间之间的差别明显减小,提示此模型的拟合度好,准确性大幅提升,故使用21 种标志代谢物的含量变化进行皮肤切创的损伤时间推断更有价值。
综上,本研究应用代谢组学方法,获得4 种标志代谢物与21 种标志代谢物的数据,均可获得OPLS回归模型,但使用4 种标志代谢物的数据所建立的OPLS 回归模型预测所得损伤时间的准确性远不及21 种标志代谢物的数据所建立的OPLS 回归模型。原因可能是,较多代谢物所得数据矩阵更大,在空间中的映射数量更多,有效相关性数据量更大,对结果的描绘也更为精确。本研究结果表明,代谢组学方法可以用于损伤时间推断研究,但在后期研究中,建议设置大容量样本,并选取尽量多的代谢物数据获得预测更加准确的回归模型,使皮肤切创损伤时间推断的准确性进一步提升。
