两性离子多肽改善GLP-1生物活性的粗粒化分子模拟
2021-06-16滕家曼刘玉婷朱国梁谌庄琳陈彦涛
滕家曼, 刘玉婷, 朱国梁, 谌庄琳, 陈彦涛
(深圳大学化学与环境工程学院,深圳市环境化学与生态修复重点实验室,广东 深圳 518071)
蛋白药物具有生物活性高、特异性强及毒副作用小等优点,但在临床应用过程中也遇到了一系列问题[1]。比如蛋白药物通常热稳定性差,需要同时面对肾脏过滤及蛋白酶解作用,导致药代动力学严重低于预期。作为一种提升蛋白药物体内半衰期的修饰方法,利用共价键在蛋白质表面缀合高分子长链,有效推动了医药产业的发展[2]。蛋白质-聚乙二醇(PEG)偶联物是目前最成功的偶联物形式,其PEG长链以无规线团的形式把目标蛋白包覆、保护起来,将其体内循环半衰期成功延长10~100倍[3]。目前已有十几种蛋白-PEG偶联物作为长效药物获得了上市批准,被应用于糖尿病、肝炎等重大恶疾的临床治疗[4]。然而,PEG自身不可生物降解,易在肾脏中聚集,长期给药易导致免疫应答甚至较高的肝脏脂肪含量[5]。利用化学或生物手段,寻找具有低免疫原性、可生物降解的PEG替代物是目前该领域亟待解决的难点[6,7]。
作为一种潜在的PEG替代物,两性离子多肽(ZIPP)近年来获得了极大关注。ZIPP保持了多肽链的先天优势,如可生物降解、可序列设计等。另一方面,与两性离子聚合物类似[8],ZIPP在序列中含有等物质的量之比的阳离子残基(如赖氨酸)和阴离子残基(如谷氨酸),空间上近邻的正负电荷赋予ZIPP优良的亲水性、抗吸附特性及“隐身”能力,有效延长了在血浆中的停留时间[9]。Jiang课题组首先揭示了以赖氨酸和谷氨酸为重复单元的聚多肽poly(KE)有着最强的抗吸附能力[10];poly(KE)与内酰胺酶形成偶联物后,环境耐受性及催化活性都得到大幅度提高[11,12]。2019年,Chilkoti课题组[13]利用类弹性蛋白聚多肽(ELP)修饰胰高血糖素样肽GLP-1后,体内半衰期延长了71倍;对ELP序列进行突变,获得两性离子多肽ZIPP,其偶联物生物活性再次提高1.7倍,体内半衰期由5~6 h延长到12 h[13]。现有的偶联物构效关系认为[3],长链高分子具有无规线团构象,其把目标蛋白包覆起来后,有效避免了肾脏清除和酶解作用,但也阻碍了目标蛋白与其受体的有效结合。Chilkoti课题组[13]的实验研究说明,在相同分子量或类似空间尺寸情况下,两性离子特性也能够提高偶联物药效动力学特性。受限于仪器分辨率,相关实验研究仍然停留在宏观或介观层面,尚不能在分子层面上给出结构与功能的关系。
本文借助于分子模拟手段,以GLP-1蛋白为研究对象,试图在微观层面揭示出两性离子多肽与GLP-1蛋白的相互作用模式,探究ZIPP与普通多肽(如ELP)在物理化学性质上的差异。一般来说,蛋白偶联物的药代动力学行为受到多重因素的影响,如高分子链的链长、序列差异及接枝位点等。已有模拟研究中,乙二醇寡聚物,而非长链高分子,被成功用来探究PEG与目标蛋白的相互作用模式[14,15],这有效避免了其他因素对研究对象的干扰。考虑到两性离子长链多肽也呈无规线团状构象[13],本文采取了类似的策略,利用五肽与GLP-1蛋白的混合体系,试图研究ZIPP五肽与GLP-1的相互作用模式。研究结果显示,3种五肽都能够有效稳定GLP-1蛋白的螺旋构象;尤其是含有赖氨酸和谷氨酸的ZIPP五肽,其适当的疏水性和静电相互作用,既能够有效保护GLP-1蛋白,也不易被其他物质识别而表现出“隐身”特性。
1 模型及方法
1.1 序列及结构信息
本文研究对象GLP-1及五肽的序列信息参考了Chilkoti课题组[13]的相关实验研究。GLP-1的氨基酸序列为AAHGEGTFTSDVSSYLEEQAAKEFIAWLVKGAG,是内源性GLP-1的突变体,在体内有着更高的稳定性。3种五肽序列为:VPGAG、VPKEG和VPREG,文中分别简写为GA-pep、KE-pep和RE-pep。其中,GA-pep可以认为是类弹性蛋白多肽(ELP)的充分单元,而KE-pep和RE-pep是两性离子多肽(ZIPP)。
研究对象GLP-1及五肽的初始结构由Chimera软件[16]生成。GLP-1被设置为α-螺旋结构,肽平面二面角夹角分别为:Φ= 57°,Ψ= 47°;3种五肽被设置为β-片层结构,肽平面二面角夹角分别为:Φ= 139°,Ψ= 135°。为避免链末端的电荷影响,五肽N端和C端分别被乙酰基和酰胺基封端。
本文以GLP-1与五肽的混合体系为主要研究对象,分别称为GLP@GA、GLP@KE、GLP@RE。体系中GLP-1的浓度为7.9 mol/L,GLP-1与五肽的物质的量之比为1∶40。作为对照组,本文也对不含五肽的GLP-1水溶液进行了模拟,该体系简称为GLP@WAT。
1.2 粗粒化力场
考虑到GLP-1与五肽的混合物体系较为庞大,本文使用粗粒化力场PACE(ver 1.3)[17,18]加速模拟进程。PACE力场由吴云东院士及韩伟教授主导开发,其忽略了蛋白质中的非极性氢,但是保留了蛋白质的大部分原子细节,同时对水分子进行了粗粒化处理。其势能函数(E)表示如下:

式中的能量项既考虑了残基间的近程相互作用(Ebond表 示与键长有关的能量,Eangle表示与键角有关的能量,Edihedral和Eimproper表示与二面角有关的能量,Eϕ,ψ,χ1表示与旋转偏差有关的能量);同时也包含了残基间远程相互作用,如Epolar表 示的极性库仑相互作用和Enon−polar表 示的非极性范德华相互作用;此外,还囊括了ECGW−CGW表示的粗粒化水分子(CGW)之间的非共价相互作用,以及ECGW−UA表示的水与残基之间的非共价相互作用。到目前为止,PACE粗粒化模型已被成功应用于对蛋白质折叠、多肽自组装、蛋白-多肽相互作用的研究[19]。
1.3 分子模拟流程
本工作的所有模拟都基于GROMACS软件包(ver 2018.1)[20]来进行。在210 nm3的立方盒子内,先把GLP-1蛋白放置于中央,将40条五肽随机插入到盒子内,继续加入钠离子和氯离子使得体系整体呈电中性,并设置NaCl最终浓度为0.1 mol/L。盒子中充满水分子,且所有原子的运动符合周期性边界条件。
正式的分子模拟可分为3个阶段:能量最小化、热力学弛豫及成品模拟。在能量最小化阶段,利用最速下降法对模拟体系进行5000步的能量优化。在热力学弛豫阶段,将模拟体系温度从100 K缓慢升到310 K,模拟步长设置为2 fs,该过程持续500 ps,并对蛋白质进行位置限制,力常数设置为1000 kJ/nm,且体系体积保持不变。在成品模拟阶段,将体系放置在恒温恒压系综中进行模拟,系统温度和压力分别保持在310 K和0.1 MPa,模拟步长为5 fs,该过程持续1000 ns。
在模拟运行过程中,每10步更新一次近邻列表,短程近邻列表的阈值为1.2 nm。非键范德华相互作用及长程静电相互作用的阈值为1.2 nm,相对介电常数设为15。利用Nose-Hoover方法及Parrinello-Rahman方法维持体系的温度和压力在设定值,耦合时间常数分别为1.0 ps和2.0 ps。
本研究中的4个模拟体系各进行了2次分子动力学模拟,总模拟时间超过8000 ns。
1.4 数据分析
成品模拟的最后200 ns的模拟被用来开展数据分析。利用VMD软件[21]的Timeline模块获得蛋白质二级结构的时间演化趋势;利用GROMACS的聚类函数获取模拟体系的典型构象,进一步使用PyMol软件[22]对构象进行渲染;利用GROMACS软件自带的分析模块获取体系的径向分布函数(RDF)、原子接触(Atomic contact)、GLP-1蛋白的位置涨落(RMSF)、均方位移(MSD)及末端距(Distance)。GLP-1蛋白的末端距定义为N端α碳与C端α碳之间的距离。参考文献[19],当氨基N原子与羰基O原子之间距离小于0.32 nm时,定义为发生静电相互作用;当残基原子与水原子之间的距离小于0.5 nm时,定义为发生了原子接触。
2 结果与讨论
2.1 GLP-1蛋白的二级结构演化情况
已有研究显示,游离态的GLP-1蛋白不具有稳定的二级结构[23];而GLP-1蛋白与受体结合后,以长螺旋的形式存在[24]。在五肽存在的情况下,GLP-1蛋白空间构象如何变化,至今未有相关的实验研究。本研究中,GLP-1蛋白和五肽的初始构象分别被设定为α-螺旋和β-片层结构。由图1(a)可知,模拟开始后,游离GLP-1的构象变得非常不稳定,初始螺旋结构被分子热运行迅速破坏。由图1(b, c, d)可知,体系中引入40条五肽后,GLP-1蛋白的螺旋结构得以稳定;尤其在GLP@RE体系中,除2个末端外,GLP-1整体呈现长螺旋结构。

图1 各模拟体系中GLP-1蛋白的二级结构随时间的变化情况Fig. 1 Time evaluation of the secondary structures for GLP-1 protein in different simulated systems
为定量观察体系的演化情况,本研究统计了混合体系中五肽与水的接触数。如图2(a)所示,接触数在前100 ns内快速下降,这说明五肽分子能够在短时间内调整空间分布。五肽与GLP-1的接触数(见图2(b))呈现出较大的涨落,但250 ns以后围绕平均值周期性变动,说明整个模拟体系基本到达热力学平衡态。在3个混合物体系中,GA-pep与水形成了最少的接触数,这说明GA-pep具有较强的疏水性,形成了较为致密的聚集体,同时与GLP-1蛋白形成了最多的接触数。KE-pep和RE-pep等两性离子多肽具有一定的亲水性,形成了的聚集体较为疏松;相较而言,KE-pep形成的聚集体最为疏松,与GLP-1蛋白形成了最少的接触数。
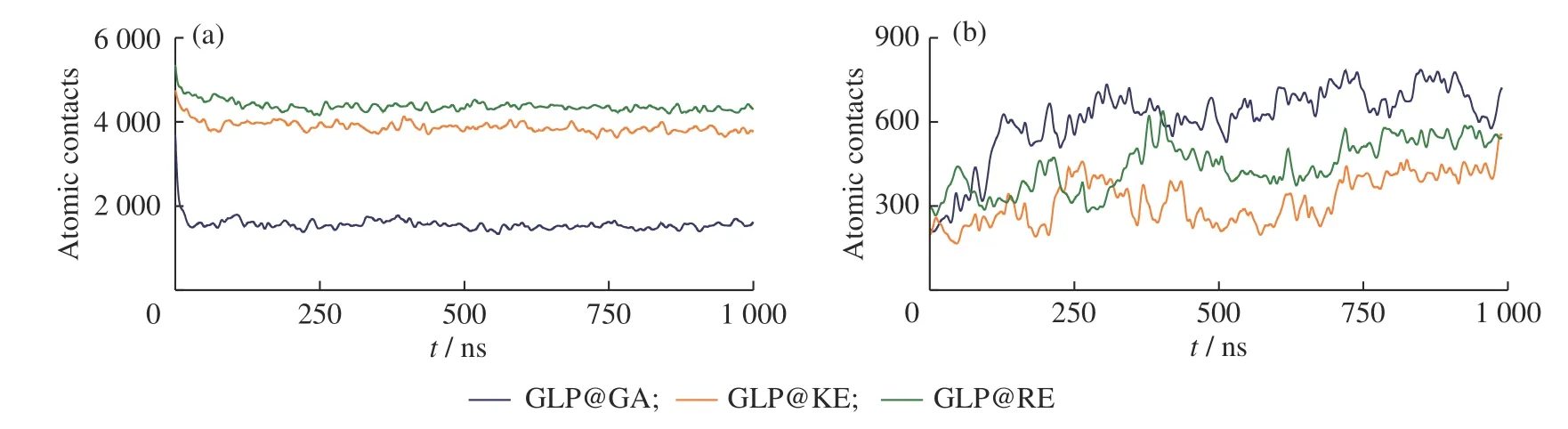
图2 各模拟体系中五肽的原子接触数(Atomic contact)随时间的变化情况:(a)五肽与水溶剂的接触数;(b)五肽与GLP-1蛋白的接触数Fig. 2 Time evaluation of the atomic contacts for pentapeptides with (a) water and (b) GLP-1 protein in different simulated systems
2.2 GLP-1蛋白在室温下的典型构象
模拟体系进入平衡态后,本研究进一步统计了GLP-1蛋白的末端距及二级结构分布。如图3所示,游离GLP-1蛋白的螺旋比例仅为30.8%,其末端距也最小(0.67 nm);在得到五肽保护后,其螺旋比例则明显提高。相比GA-pep,ZIPP更有利于GLP-1形成螺旋构象;特别是在GLP@KE体系中,螺旋比例增加到60.4%,近乎是GLP@WAT体系的2倍。图4给出了GLP-1在不同体系中的典型构象。游离GLP-1蛋白的整体构象呈现为无规线团,N端与C端相互靠拢,呈闭环状,并形成少量β-片(见图1(a))。引入五肽后,GLP-1蛋白的两个末端被迫分开,增强了形成螺旋的概率;尤其是在GLP@RE体系中,GLP-1形成了单根长螺旋。而在GLP@GA和GLP@KE体系中,GLP-1蛋白形成了多个短螺旋。

图3 热力学平衡后,各模拟体系中GLP-1蛋白的(a)二级结构分布及(b)末端距Fig. 3 (a) Distribution of secondary structures and (b) end-to-end distance of GLP-1 protein in different simulated systems when reaching thermodynamic equilibrium

图4 热力学平衡后,各模拟体系中GLP-1蛋白的典型构象Fig. 4 Typical conformation of GLP-1 protein in different simulated systems when reaching thermodynamic equilibrium
综合图1及图3,GLP-1蛋白N端片段倾向于形成线团(coil)或转折(turn)等结构,而多肽片段Asp15-Val33是否形成螺旋则依赖于微环境。相关实验也发现了类似规律,如Thornton等[25]发现十二烷基磷胆碱(DPC)胶束有助于GLP-1形成含有两个螺旋片段的构象,而Chang等[26]发现三氟乙醇水溶液有助于GLP-1形成单个长螺旋构象。
2.3 五肽在GLP-1蛋白周围的分布情况
本研究利用径向分布函数(g(r))探讨了五肽在GLP-1蛋白周围的分布情况(图5(a))。GA-pep在形成致密聚集体的同时,也倾向于紧紧包围在GLP-1蛋白表面,因而在r= 0.5 nm附近呈现最高峰;KE-pep倾向于分散在水溶液中,从而远离GLP-1蛋白表面。图5(b)显示,五肽主要与GLP-1的10-12位残基和C端螺旋发生接触,而很少能接触到GLP-1蛋白的中间序列部分,这也说明五肽聚集体并没有完全把GLP-1蛋白包埋。
图6(a~c)给出了3个混合体系的模拟快照(snapshot),更直观地显示出五肽在GLP-1蛋白周围的分布情况。GA-pep形成了较为致密的聚集体,只对GLP-1蛋白的两个末端形成了局部包覆,混合体系整体呈现左右结构;KE-pep形成的聚集体非常疏松,均匀分布在GLP-1蛋白周围,但是只与两个末端形成原子接触,混合体系整体呈现核壳结构;RE-pep聚集体介乎其间,更接近GA-pep情形,只与GLP-1蛋白两个末端形成原子接触。本研究还对五肽分子单独存在的溶液体系进行了粗粒化模拟。经过500 ns的热力学松弛,3种五肽分子在水溶液中呈现出了不同的聚集状态,如图6(e~f)所示。与混合体系模拟结果,可见3种五肽分子的不同聚集行为与是否引入GLP-1蛋白无关;换言之,五肽分子的内在特性决定了五肽与目标蛋白之间的相互作用模式。
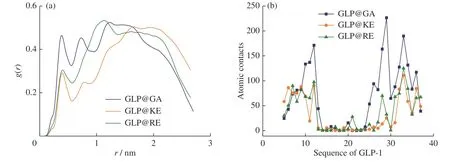
图5 (a)五肽在GLP-1周围的径向分布情况;(b)GLP-1各个残基与多肽的原子接触情况Fig. 5 (a) Radial distribution functions (RDF) of around GLP-1; (b) Atomic contacts with pentapeptides for each residue of GLP-1
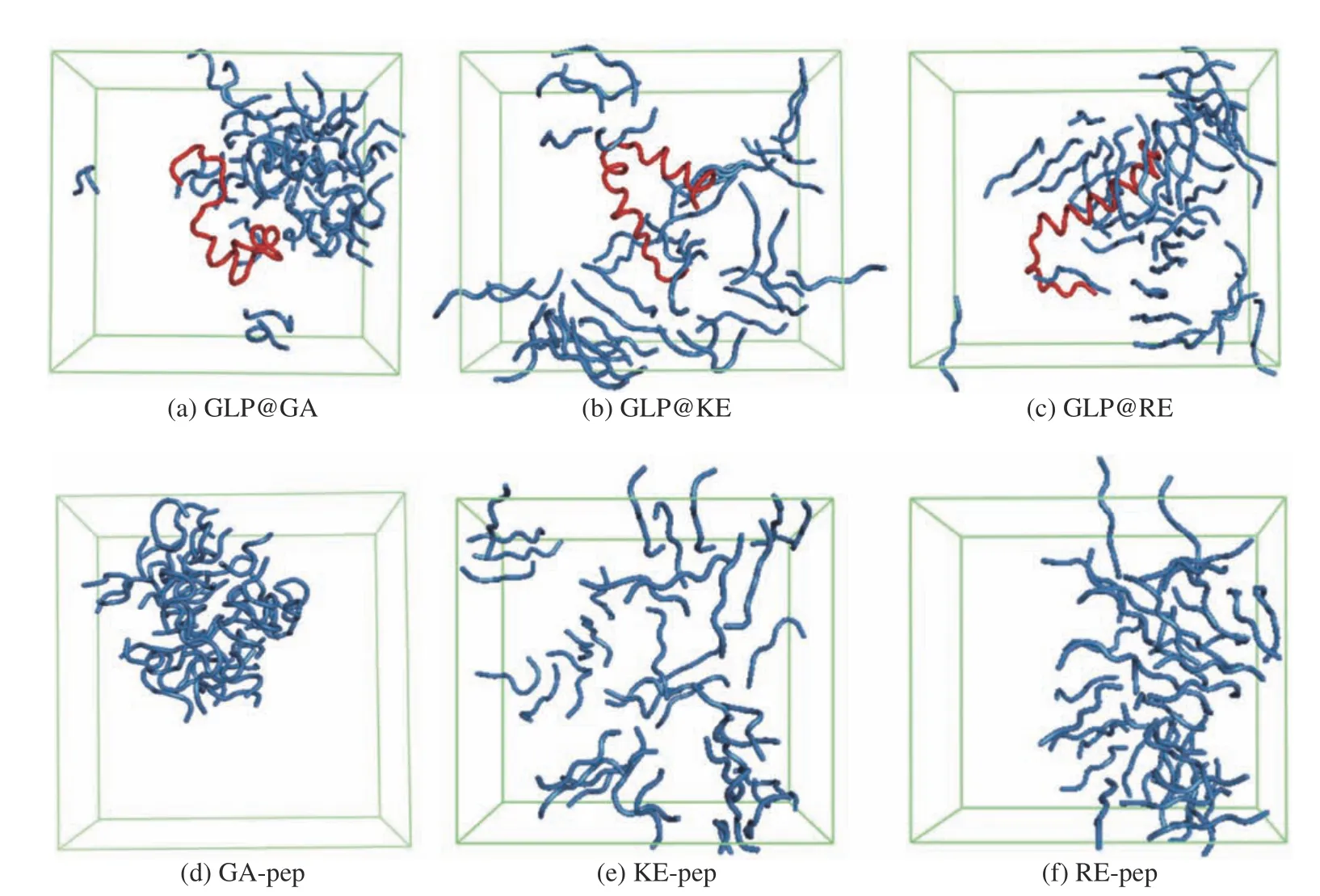
图6 各模拟体系中多肽在GLP-1蛋白周围的典型分布Fig. 6 Typical distribution of pentapeptides around GLP-1 protein in different simulated systems
2.4 五肽包埋GLP-1蛋白的驱动力分析
为继续探究五肽形成聚集体及包覆GLP-1蛋白的驱动力,本文统计了混合体系内的静电相互作用情况。由图7可见,KE-pep与GLP-1蛋白形成了最少的静电作用,同时KE-pep聚集体内部也形成最少的静电作用,这充分说明KE-pep具有最高的亲水性,倾向于均匀分散在水溶液中。RE-pep聚集体内部形成了最多的静电作用,但与GLP-1的静电作用稍微低于GLP@GA体系,这体现了驱动力的差异:RE-pep以静电作用作为形成聚集体的主要驱动力,而GA-pep同时利用静电及疏水作用形成致密聚集体,并以此与GLP-1形成最多的原子接触。相比游离GLP-1蛋白,与五肽混合后,其两个末端被迫分开,内部静电作用稍有减少。
为了探究五肽中各残基对驱动力的贡献,本文进一步统计了各残基与GLP-1的原子接触数。如图8所示,GA-pep中Gly3和Ala4与GLP-1形成了最多的接触,而Val1和Pro2与GLP-1形成了最少的接触,这说明疏水性强的Val1和Pro2相互靠拢,驱动GA-pep形成致密聚集体;其C端朝外,与GLP-1蛋白形成接触。相比KE-pep,RE-pep的Val1和Arg3与GLP-1蛋白形成了最多的接触,且明显高于KE-pep对应的残基;这说明,RE-pep的Arg3不但有利于自身形成聚集体,也促进了其与GLP-1蛋白形成局部包覆。

图7 各模拟体系中静电相互作用情况Fig. 7 The electrostatic interactions among GLP-1 protein and pentapeptides in different simulated systems
相较GA-pep,两性离子多肽KE-pep和RE-pep都显示了亲水性。本文统计了水分子在ZIPP关键残基周围的径向分布函数。如图9所示,Glu4侧基氧原子周围的水分子密度基本相似,但Lys3侧基氮原子周围的水分子密度明显高于Arg3。这表明KEpep喜欢分散在水环境中,而富含精氨酸的RE-pep更喜欢与其他残基形成静电作用。

图8 各模拟体系中五肽各残基与GLP-1蛋白的原子接触数Fig. 8 Atomic contacts with GLP-1 for each residue of pentapeptide
2.5 GLP-1蛋白的动力学性质
本研究使用两个序参量刻画GLP-1蛋白的动力学性质。图10显示,各残基在其位置附近的涨落明显受到了五肽的影响。引入五肽后,GLP-1蛋白序列的中间部分形成了螺旋结构,其位置涨落受到抑制;但其N末端相关残基的位置涨落变动更强烈,尤其是GLP@GA体系,这表明GA-pep聚集体与GLP-1蛋白N端的相互作用稍弱。
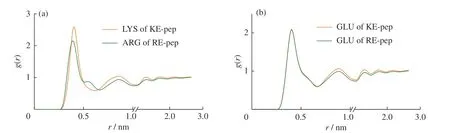
图9 水分子在两性离子多肽特定残基周围的径向分布:(a)赖氨酸及精氨酸侧基N原子周围的水分子分布;(b)谷氨酸侧基O原子周围的水分子分布Fig. 9 Radial distribution of water molecules around some specific residues of zwitterionic pentapeptides: (a) The distribution of water molecules around N atoms of the side groups of LYS and ARG; (b) The distribution of water molecules around the O atom of the side groups of GLU

图10 各模拟体系中GLP-1蛋白的动力学性质:(a)各残基的根均方(RMSF)涨落情况;(b)GLP-1均方位移(MSD)随时间变化情况Fig. 10 Kinetic properties of GLP-1 protein in different simulated systems: (a) The root-mean-squared fluctuation (RMSF) of each residue;(b) The mean-squared displacement (MSD) of GLP-1 as functions time
水溶液中,GLP-1蛋白与五肽混合后,其扩散能力也必然受到影响。图10计算了不同模拟体系中GLP-1蛋白的均方位移。基于爱因斯坦扩散理论,游离GLP-1的扩散系数为0.13 nm2/ns,与GA-pep、KE-pep或REpep混合后,其扩散系数分别降低至0.036 s、0.047 s、0.014 nm2/ns。可见五肽聚集体明显阻碍了GLP-1在溶液中的扩散,尤其是RE-pep,其聚集体密度低于GA-pep,但最强烈地影响了GLP-1的扩散能力;相比而言,由KE-pep组成的松散外壳对GLP-1的扩散阻力最小。
3 结 论
(1)游离GLP-1的两末端相互靠近,形成环状构象,螺旋比例仅为30%;而与五肽混合后,GLP-1两末端倾向于与五肽形成相互作用,中间片段形成较为规整的螺旋结构。
(2)两性离子五肽VPKEG具有较高的亲水性,倾向于均匀分散在水溶液中,在GLP-1周围形成疏松的保护层。两性离子五肽VPREG以静电作用为主,倾向于相互靠拢形成聚集体,也稳定了GLP-1的长螺旋结构。对照组VPGAG具有较高的疏水性,倾向于形成致密的聚集体,虽然与GLP-1形成了最多的原子接触,但未能充分包埋GLP-1并提供足够的保护。
(3)赖氨酸、谷氨酸组合让两性离子五肽VPKEG具备了恰当的亲疏水性和静电作用,既能维持GLP-1螺旋构象,也避免了被免疫蛋白识别,赋予其“隐身”特性。
