硫酸软骨素类可注射水凝胶体系及其凝胶化机制
2021-06-16邱钰智乔韡华董念国杨亚江
王 芹, 邱钰智, 乔韡华, 董念国, 杨亚江
(1. 华中科技大学化学与化工学院,武汉 430074;2. 华中科技大学同济医学院附属协和医院心脏大血管外科,武汉 430022)
可注射水凝胶,也常称为原位形成的水凝胶。这类材料在室温下和注射到体内前为流体、注射入体内后经物理交联或化学交联原位形成亲水性的具有三维网络结构的半固体凝胶。作为一类新型生物材料,该凝胶已被广泛用于药物递送[1-3]、伤口修复[4, 5]和组织工程[6, 7]等医用领域,具有易操作、微创或无创(通过注射进入某些难以经手术到达的部位)、能形成与缺损部位一致的形状、易于包封细胞和药物且载药量高等优点[8,9]。这类材料通常是由合成聚合物[10,11]、天然聚合物[12,13]和两者的杂化材料[14, 15]构成。本课题组发展了多种合成的温敏纳米凝胶类可注射水凝胶,用于肿瘤的介入栓塞治疗[16,17]。天然聚合物类可注射水凝胶与合成聚合物类的相比,具有更好的生物相容性和生物可降解性,而更适宜用于组织工程等医用领域[5]。目前用于构建可注射水凝胶的天然多糖材料有壳聚糖、肝素、胶原蛋白、透明质酸、海藻酸盐、明胶和硫酸软骨素等[5,18-20]。
以上提到的多糖类可注射水凝胶体系中的硫酸软骨素(ChS)是一种硫酸化糖胺聚糖的异聚体,由交替的1,4-连接的N-乙酰-β-D-半乳糖胺(β-D-GalNAc)和1,3-连接的β-D-葡萄糖醛酸(β-D-GlcA)二糖单元组成。根据硫酸根在乙酰GalNAc和GlcA中取代的数目和位置的不同,ChS可分为多种类型,典型的ChS-O、ChS-A、ChS-B、ChS-C、ChS-D和ChS-E的结构式如图1所示[21]。作为人体内最丰富的糖胺聚糖和软骨及细胞外基质的重要组成部分,ChS大量存在于皮肤、软骨、肌腱、心脏瓣膜和中枢神经系统等组织中,在体内发挥着重要的生理作用,如参与软骨和骨的形成、调控生长因子如成纤维细胞生长因子-2和转化生长因子-β[22]、促进伤口愈合[23]、抗炎[24]、抗凝血[25]、抗氧化[26]、抗肿瘤[27]以及增强免疫反应[28]等。正是基于ChS的这些生理活性,其在临床上得到广泛应用,其中之一就是与氨基葡萄糖联用治疗骨关节炎,另外还可用于治疗视疲劳、神经痛、关节痛和抗炎等[29-32]。也正因为ChS的多种生理功能,以及其优良的水溶性和带负电荷、结构中存在易于修饰改性的羧基和羟基,ChS可用于构建多种生物材料,如用于肿瘤的诊断和治疗的纳米药物载体[33,34]以及组织工程支架材料等[35],尤其是基于ChS的可注射水凝胶已成为近年来的研究热点。
除具有前述的多糖类可注射水凝胶的生物安全性好、可降解等优点外,ChS类可注射水凝胶还可同时发挥多种生理功能和药效,比如前述的促进软骨和骨的形成、加快伤口愈合、抗炎和抗凝血等,而在骨关节炎治疗[36-38]、关节软骨修复[39,40]、颅骨修复[41]和髓核变性修复[42,43]等方面具有良好的应用前景。此外也可用于生物黏合剂[44]、药物输送[45]和细胞治疗[46]等领域。然而,目前尚未见基于ChS的可注射水凝胶研究进展的综述性报道。为此,本文对ChS类可注射水凝胶的前体聚合物、凝胶化机理、性能特征及其改性方法等进行了较为全面的综述,为构建新的ChS类可注射水凝胶并拓展其应用奠定基础,为发展更适于临床转化的ChS可注射水凝胶类功能材料提供思路。
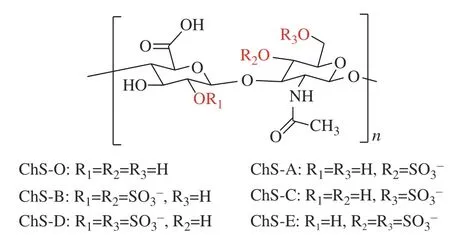
图1 几种典型ChS的化学结构式[20]Fig. 1 Chemical structure of typical ChS[20]
1 硫酸软骨素类可注射水凝胶体系及其凝胶化机制
具有三维网络结构是可注射水凝胶凝胶化后的基本结构特征。这种三维网络结构通常由前体聚合物经物理交联、化学交联和生物交联等形成[8,47,48]。物理交联亦称为非共价交联,一般由氢键、疏水作用、静电作用和主客体识别等弱相互作用形成交联结构;化学交联又称共价交联,是通过化学反应生成新的化学键而形成交联结构。这些反应包括经典的点击化学反应、Diels-Alder(DA)加成反应、迈克尔加成、以及形成席夫碱、二硫键、硼酸酯键和配位键等[7,47,49]。生物交联主要是酶参与的交联反应。硫酸软骨素糖链上存在大量羧基、硫酸根和相邻的羟基,不仅为化学改性提供了丰富的反应位点,也为物理交联和酶交联提供了可能的活性基团。表1列出了ChS类可注射水凝胶的前体聚合物体系、凝胶化机制、凝胶化时间和凝胶的应用。

表1 ChS类可注射水凝胶体系、凝胶化机制、凝胶化时间和凝胶的应用Table 1 Precursor polymers, gelation mechanism, gelation time and applications of ChS-based injectable hydrogels
上述这些ChS类可注射水凝胶的前体聚合物主要有:
(1)含ChS结构的温敏共聚物:将ChS与温敏性单体或温敏聚合物接枝共聚,得到的温敏性共聚物在热诱导下通过增强的链间疏水作用形成三维网络。
(2)氧化的ChS(OChS): ChS通过图2(a)所示的路径,经强氧化剂如NaIO4氧化,得到含醛基的OChS,其生成的醛基与含有二氨或多氨基的聚合物或生物分子形成席夫碱而形成三维网络结构(图2中的路线1)。
(3)羧基活化的ChS:如图2(b)所示,利用1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)/N-羟基琥珀酰亚胺(NHS)反应活化ChS的羧基,得到羧基活化的ChS(ChS-NHS),ChS-NHS可通过多种化学交联途径形成三维网络结构。如:ChS-NHS上活化的羧基与己二酰肼(ADH)的氨基反应,得到己二酰肼修饰的ChS(ChS-ADH),ChS-ADH上的氨基再和其他含醛基的物质发生席夫碱反应生成酰腙键(图2(b)中的路线2);ChS-NHS上活化的羧基与糠胺反应,得到富电子的含有共轭双烯呋喃结构的ChS(ChS-F),与亲双烯体如含马来酰亚胺结构的聚合物通过DA加成反应进行交联(图2(b)中的路线3);直接与含氨基的聚合物反应形成酰胺键交联的水凝胶(图2(b)中的路线4);另外,ChS-NHS还可与酪胺反应,形成酪胺修饰的含酚羟基的ChS(ChS-TA),在辣根过氧化物酶(HRP)和过氧化氢(H2O2)的作用下与其自身或其他酪胺修饰的聚合物反应,在苯酚邻位C–C和邻位C–苯氧之间形成共价交联结构(图2(b)中的路线5)。
(4)甲基丙烯酸酯化的ChS(mChS):如图2(c)所示,ChS与甲基丙烯酸酐(图2(c)左)或甲基丙烯酸缩水甘油酯(图2(c)右)反应得到甲基丙烯酸酯化的ChS(mChS或ChS-GMA),得到的mChS或ChS-GMA本身或与其他单体发生自由基共聚形成交联结构。
(5)丙烯酸修饰的ChS(ChS-acrylate):上述ChS-ADH的氨基与丙烯酸反应,得到含α,β-不饱和羰基的ChS-acrylate(图2(d)),其与亲电试剂发生迈克尔加成反应形成交联结构。
可以看出,虽然氢键、疏水作用、静电作用等物理交联方式均可用来形成水凝胶,但目前报道的ChS类可注射水凝胶的物理交联方式主要是基于温敏型聚合物随温度变化疏水作用的增强而进行的热胶凝,其他物理交联方式形成的水凝胶有待于进一步发展。下面将从热胶凝型、化学反应交联(形成席夫碱、点击化学反应包括DA加成反应、迈克尔加成反应和光化学交联)型,以及生物交联(酶催化)型的ChS类可注射水凝胶3个方面对上述前体聚合物体系的组成及其凝胶化机制进行分述。
1.1 热胶凝的ChS类可注射水凝胶
热胶凝可注射水凝胶的凝胶化仅以温度为促发因素,不需额外添加交联试剂或特别的条件,具有安全、简便、易操作等优点[65]。聚(N-异丙基丙烯酰胺)(PNIPAM)是典型的合成类温敏聚合物,其水溶液具有低临界溶液温度(LCST)特征。较高浓度的PNIPAM水溶液在LCST之上时,因其大分子链的异丙基间疏水作用增强,从而形成由疏水微区交联的三维网络结构,体系发生溶胶-凝胶(sol-gel)转变。因此,热胶凝本质上属于一种物理交联。PNIPAM均聚物的LCST在32 ℃左右,接近人体温度。PNIPAM类共聚物的LCST与共聚单体的亲疏水性和用量有关,与亲水单体共聚升高,与疏水单体共聚则降低[66]。常见的温敏聚合物还有两亲性嵌段聚合物如环氧乙烷/环氧丙烷/环氧乙烷组成的三嵌段共聚物以及一些生物大分子如琼脂糖等。
已见报道的温敏型ChS类可注射水凝胶主要是通过将温敏性聚合物与ChS共聚或共混,来赋予体系温敏特性,从而实现温度诱导的凝胶化[36,46,50]。具体制备方法包括:ChS与温敏PNIPAM通过偶联反应接枝共聚[46]、甲基丙烯酸酯修饰的ChS与NIPAM自由基共聚[50]、与温敏聚合物Pluronic F127共混[36]等。其中,ChS的含量、温敏聚合物的分子量等将影响体系的sol-gel转变温度、凝胶化时间、凝胶的强度和黏附性等。
Liu课题组[46]基于ChS的可降解性,制备了用于细胞治疗的可降解温敏型可注射水凝胶。他们首先采用可逆加成链转移聚合法合成了分子量小于5.0×104(可通过肾脏排除体外)的带羧基的PNIPAM(PNIPAMCOOH);然后在EDC存在下,PNIPAM-COOH上的羧基与图2(b)中路线2得到的ChS-ADH中的肼基发生缩合反应,得到PNIPAM接枝的ChS共聚物(ChS-ADH-g-PNIPAM)(图3)。研究表明该共聚物的LCST、凝胶化时间和降解速率与PNIPAM的分子量有关。PNIPAM的分子量越小,共聚物的LCST越低,在37 ℃下凝胶化时间越长、降解越快。ChS-ADH-g-PNIPAM50、ChS-ADH-g-PNIPAM100、ChS-ADH-g-PNIPAM200的LCST分别为26.3、28.1、31.2 ℃;37 ℃下凝胶化时间分别为89、80、71 s;在透明质酸酶作用28 d后,降解率分别为73.6%、54.7% 和 44.0%。
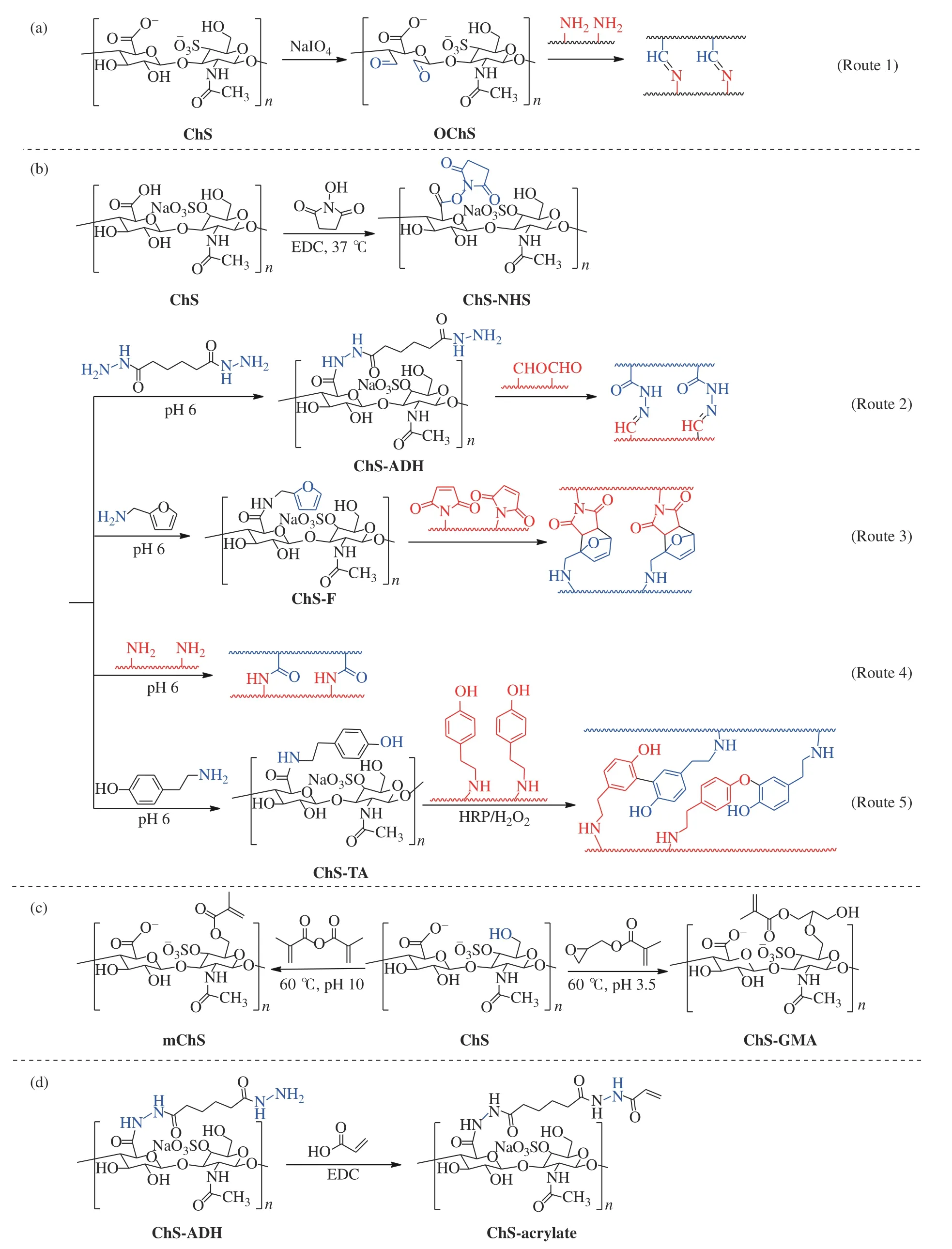
图2 ChS类可注射水凝胶前体材料及相关交联反应:(a)基于氧化硫酸软骨素的形成席夫碱的反应;(b)基于EDC/NHS活化的ChS相关化学交联,包括迈克尔加成反应、DA反应和酶偶联介导的交联;(c)甲基丙烯酸酯化的ChS;(d)丙烯酸改性的ChSFig. 2 Pre-polymers and relative cross-linking reactions involved in ChS-based injectable hydrogels:(a)Schiff′s base formation based on OChS;(b)Relative cross-linking chemistry based on EDC/NHS-activated ChS, including Michael addition reaction, DA reaction, and enzymatic coupling mediated cross-linking;(c)Methacrylate modified ChS;(d)Acrylic modified ChS

图3 制备ChS-ADH-g-PNIPAM的路线图[46]Fig. 3 Scheme of the preparation of ChS-ADH-g-PNIPAM[46]
Wiltsey等[50]基于ChS的黏附性和可降解性,以图2(c)所示路线得到的甲基丙烯酸酯化的ChS(mChS)和NIPAM为共聚单体,采用过硫酸铵/四甲基乙二胺氧化还原体系引发自由基聚合,制备了PNIPAM-g-ChS共聚物,该材料能有效促进髓核再生,抑制椎间盘退变。由于交联密度较低,质量分数5%的共聚物水分散体在室温时为黏性流体,易于推注,在人体生理温度(37 ℃)下形成弹性凝胶。所形成的凝胶兼具PNIPAM的温敏性和力学强度,以及ChS的生物可降解性、黏附性和高保水量。研究表明,水溶性ChS的加入使共聚物的LCST稍有升高;增加ChS在共聚物中的含量,可减少形成的水凝胶在体外的水分损失;ChS的掺入还显著提高水凝胶的黏附强度;在软骨素酶ABC的存在下,ChS含量高的凝胶降解更快。另外,增加mChS中甲基丙烯酸酯取代度会增加凝胶的失水量、压缩硬度和剪切模量。
上述这些基于PNIPAM-g-ChS的共聚物水溶液在较高温度下,主要通过PNIPAM的疏水主链以及侧链上的异丙基之间的疏水相互作用形成物理交联点而凝胶化。但这些水凝胶一般在高温下会收缩脱水,影响凝胶性能。Kim等[51]在上述疏水作用形成的物理交联基础上,引入化学交联,形成生物相容性好、不发生热收缩的可降解温敏型ChS类可注射水凝胶。该凝胶体系由带有环氧基团的PNIPAM热凝大分子单体(TGM)、己二酰肼改性的含有酰肼的ChS(ChS-ADH)和N-羟基丁二酰亚胺活化的ChS(ChS-NHS)大分子组成。当温度从室温升高到37 ℃时,如图4所示,3种大分子的混合溶液形成的水凝胶既具有物理交联(疏水作用)又有化学交联(NHS活化的羧基和TGM上的环氧基团分别与ChS-ADH上的肼基发生反应)。同时还研究了TGM/ChS-ADH/ChS-NHS的组成比例以及ChS-ADH中己二酰肼取代度对凝胶化时间、凝胶溶胀率和力学强度等的影响。结果表明,凝胶化时间随上述因素的改变而改变,但均在10 min以内。通过调控上述因素,可得到较高温度下不收缩脱水、具有不同组合的压缩模量和降解速率的可注射水凝胶。

图4 可注射的TGM/ChS-ADH/ChS-NHS在水凝胶中的化学交联反应[51]Fig. 4 Chemical cross-linking reactions in the injectable TGM/ChS-ADH/ChS-NHS hydrogel[51]
另外,ChS还可作为一种功能材料直接与其他温敏性可注射水凝胶进行物理混合。例如,Pluronic F127(F127)是一种由聚环氧乙烷和聚环氧丙烷组成的嵌段共聚物,是FDA批准可医用的合成聚合物,也具有温敏性的sol-gel相转变特性,可用做局部药物输送载体[67]。其凝胶化温度与F127的分子量和浓度有关。为减少蛋白质类药物在凝胶中的快速释放,Sun课题组[36]基于蛋白质带正电的氨基与带负电的羧基或硫酸根之间的静电相互作用,在F127水溶液中物理共混少量ChS(质量分数0.5%),所得可注射温敏复合水凝胶用以包封骨形态发生蛋白模拟细胞外基质,用于关节内注射修复软骨损伤。研究表明,ChS的加入改善了凝胶中骨形态发生蛋白的早期暴释,实现了持续释放,有助于恢复因骨关节炎引起的软骨损伤。
1.2 化学交联的ChS类可注射水凝胶
尽管上述温敏性可注射水凝胶不需要额外的交联剂,具有操作简单、生物相容性好等优点,但同时也存在物理交联固有的力学强度弱的缺陷。在体内时,在外界力的作用或生理条件下水凝胶可能不稳定,由此限制了其应用。一般来说,通过化学交联和酶交联形成的水凝胶具有较高的力学强度和生理稳定性,而且这种强度可通过凝胶组成和交联密度等进行调节。但化学交联类可注射水凝胶也存在不足:需要特定的反应条件和交联试剂,存在不易操作和潜在毒性风险。因此大多数研究集中于可在较温和条件下发生反应的绿色低毒反应体系,这些反应包括形成席夫碱的化学交联、点击化学交联(经典点击反应、DA反应、迈克尔加成反应)和光交联等,现分述如下。
1.2.1 形成席夫碱的化学交联氨基或酰肼基与醛基之间的形成席夫碱的反应具有反应迅速、反应条件温和、产物无害、无需其他化学交联剂等优点,在制备可注射水凝胶方面应用广泛[68-72]。目前,可以通过两类席夫碱反应得到的ChS类可注射水凝胶:一是用氧化剂如NaIO4将ChS糖环上的邻羟基氧化为二醛,得到含醛基的氧化ChS(OChS),然后醛基与聚合物或生物分子中的氨基发生席夫碱反应生成亚胺交联的凝胶(图2(a)中路线1);二是将羧基活化的ChS与己二酰肼反应,得到含有酰肼的ChS(ChS-ADH),再与其他含醛基的物质生成酰腙键而得到化学键交联的水凝胶(图2(b)中路线2)。
壳聚糖含有丰富的氨基,可与OChS上的醛基形成席夫碱而用于制备ChS类可注射水凝胶。同时该体系中OChS上的醛基还可与体内组织中的氨基反应,增加ChS类水凝胶的组织黏附性,改善支架与宿主组织之间的结合力。由于壳聚糖在中性条件下水溶性较差,为解决这一问题,Liu课题组[52]用丁二酸酐与壳聚糖上的氨基发生缩合反应形成酰胺键,得到水溶性较好的N-琥珀酰化的壳聚糖(SC)。在生理条件下,与用NaIO4氧化得到的含多醛基的OChS混合,两者发生形成席夫碱的反应(图2(a)中路线1),得到的可注射、且有自愈合功能的水凝胶可用于包封细胞。除了醛基和氨基之间形成席夫碱外,该体系还存在物理交联(如氢键和链缠结等)。发生反应生成席夫碱的两种物质的用量比对形成水凝胶的交联密度、凝胶化时间、含水量和力学性能等均有影响。例如当n(OChS)/n(SC)=2/4、3/3、4/2时,相应的凝胶化时间分别为(41±6)s、(29±4)s、(34±3)s。这些结果表明,等量的反应物发生席夫碱反应时凝胶化速率最快,交联密度也最大。另外,经席夫碱反应形成的动态亚胺键以及氢键等可使该水凝胶在2 h内自愈合。该体系在大鼠皮下注射后在体内酶的作用下可降解,是一种理想的细胞载体,可用于组织修复。
Wang课题组[39]在碱性条件下用环氧丁烷与壳聚糖反应,得到水溶性的羟丁基壳聚糖(HBC),基于HBC与OChS间形成席夫碱的反应,采用牺牲模具法的3D生物打印技术制备了多种结构的HBC/OChS水凝胶,包封细胞后用于个性化的软骨修复治疗。该体系凝胶化时间随HBC浓度的增加而缩短,例如当ρ(OChS)=3 mg/mL时,ρ(HBC)=40 mg/mL的体系在1 min内可完成凝胶化;而ρ(HBC)=20 mg/mL的体系则需要5 min完成凝胶化。对材料组成进行优化,可得到孔结构均匀、平均孔径为100 μm的HBC/OChS大孔水凝胶,由其包封的人脂肪源性间充质干细胞具有良好的活力。
另外,Fan等[53]用水溶性的羧甲基壳聚糖(CMC)与OChS混合,得到席夫碱交联的CMC/OChS共价水凝胶,其可用于药物输送和软骨组织工程。为防止药物在水凝胶中暴释,将模型药物牛血清白蛋白包封于壳聚糖微球中,然后嵌合在CMC/OChS体系中,得到复合凝胶支架。结果表明,嵌入的包封药物壳聚糖微球可作为填料,显著提高CMC/OChS水凝胶支架的力学性能和生物活性,并降低凝胶的溶胀比和降解速率,减缓药物释放速率。
相比于图2(a)中形成的单一C=N不饱和席夫碱,以酰肼代替氨基后与醛基形成的酰腙键更为稳定。Li等[54]采用图2(b)中路线2所示交联方式,将含有酰肼键的ChS-ADH与含醛基的氧化普鲁兰(OXPL)混合,在生理条件下得到了酰腙键交联的ChS-ADH/OXPL可注射水凝胶,以其包封细胞可用于软骨修复。该体系凝胶化时间可通过改变两者的质量比和浓度来调控。结果显示,明显过量的氨基或醛基均会产生大量未反应的残留基团,从而减缓凝胶化速率。另外,两者的质量比还会影响凝胶的平衡溶胀率、降解行为、微观形貌和力学性能等。当两者质量比为7/3时形成的水凝胶可为维持软骨细胞表型和增强软骨生成提供最佳的宿主组织模拟微环境。
1.2.2 点击化学反应交联最经典的点击化学(click chemistry)反应是铜盐催化的叠氮-炔基环加成反应,具有反应迅速、立体选择性强、产率高的特点。由于采用Cu+作为催化剂,因有毒重金属的残留,限制了其在生物材料领域的应用,尤其是可注射水凝胶领域。近年来,迈克尔加成反应和DA加成化学反应因无需加入有毒物质也无毒副产物、具有好的生物安全性,而用于制备ChS类可注射医用水凝胶。由于这两种反应具有“点击化学”的特征,即可在温和条件下进行,且具有高选择性和高产率特点,因此,很多文献将它们也归类为“点击化学”范畴[73,74]。由此,本文在论述基于这两种反应的可注射水凝胶形成机理时,也将其归为点击化学反应一类。
迈克尔加成反应是亲核试剂(烯醇阴离子、―OH、―NH2和―SH等)进攻α,β-不饱和羰基化合物的β位碳,最终形成新的C―C、C―O、C―N、C―S或C―X键。如图2(d)所示,Bang等[45]为改善ChS类可注射水凝胶的细胞黏附性,将按图2(b)中路线2制备的ChS-ADH与丙烯酸反应,得到丙烯酸修饰的ChS(ChSacrylate),在ChS中引入α,β-不饱和羰基;并基于明胶(gelatin)在不同组织中较高的细胞黏附性,采用类似方法先后得到gelatin-ADH和三(2-羧乙基)膦功能化的明胶(gelatin-TCEP)。将ChS-acrylate和gelatin-TCEP两者混合后,即发生迈克尔加成反应,可在几分钟内形成ChS-gelatin凝胶(图5)。该凝胶溶胀率与聚合物溶液的浓度有关,具有良好的生物相容性和细胞黏附性,有望用作软骨和骨修复材料。

图5 可注射的ChS-gelatin水凝胶制备示意图[45, 75]Fig. 5 Scheme of the preparation of the injectable ChS-gelatin hydrogel[45, 75]
DA加成反应是发生在富电子二烯和缺电子二烯间的[4+2]环加成反应,可以形成环己烯结构。其反应官能团与体内的化学物质几乎不发生反应,且可在水溶液中自发进行不需要任何催化剂,因此已用于制备可注射医用水凝胶。在ChS类可注射水凝胶制备中,如图2(b)中路线3所示,将羧基活化的ChS与糠胺反应,引入富电子的呋喃结构,得到呋喃接枝的ChS(ChS-F),然后与含有缺电子的双烯化合物,如马来酰亚胺改性的聚合物发生DA加成反应,形成的交联水凝胶可用作骨修复支架[41,55]。
DA反应交联的不足之处是凝胶化所需时间较长(一般约0.5 h)。在注射入体内后的凝胶化过程中,凝胶前体有可能进入体液内,带来危险。为解决这一问题,通常是将另一种能快速凝胶化的体系与DA反应体系联用。这种同时采用多种交联方式形成的水凝胶还有望具有可调节的力学强度、溶胀率和降解行为,而这些特性对于骨修复支架材料的体内修复效果至关重要。
1.2.3 酰胺键交联如图2(b)中路线4所示,经N-羟基琥珀酰亚胺活化的ChS(ChS-NHS),可与含伯胺的聚合物形成酰胺键交联的水凝胶。例如,Strehin等[76]以PEG-(NH2)6为交联剂和力学强度调节剂,与ChS-NHS混合后在37 ℃反应10 min发生凝胶化。改变两者的投料比并不影响体系的凝胶化时间,但PEG-(NH2)6含量增大时可增强水凝胶的力学性能。因ChS-NHS也可以和周边组织中蛋白质上的氨基发生反应,故该水凝胶具有较高的黏附强度(比纤维蛋白胶的黏附强度高约10倍)。
类似于ChS,胶原蛋白也是细胞外基质的主要成分,具有有利于细胞增殖和分化的细胞黏附点,常用于细胞外基质微环境的仿生构建和软骨组织工程。虽然胶原蛋白(I型和II型)可在生理条件下自组装形成短的纳米纤维,但无法形成水凝胶,故研究人员将胶原蛋白与ChS-NHS混合,得到物理和化学双交联的可注射水凝胶,用于输送细胞和组织工程支架[43,58,59]。其中的化学交联即是通过ChS-NHS上的活化羧基和胶原蛋白上的氨基在生理条件下形成酰胺键而实现的。例如,Gao课题组[58]制备了I型胶原蛋白与ChS-NHS组成的水凝胶。由于II型胶原蛋白(Col II)比I型具有更好的维持软骨细胞表型、促进间充质干细胞软骨分化的能力,该课题组又制备了Col II-ChS可注射和自交联的水凝胶[59]。这两个体系中均无需任何催化剂。由于此体系中化学交联的速率比自组装的物理交联快,故凝胶化时间主要由化学交联来决定,其随体系中ChS-NHS用量的增大以及NHS取代度的升高而变短(几分钟内)。凝胶的吸水性也随着ChS-NHS用量的增加而增加。
另外,Zhou等[43]将未经NHS活化的ChS与Col II混合后,以无毒、有抗炎促软骨修复作用的京尼平作为生物交联剂,制备包封脂肪来源干细胞的水凝胶,用于治疗髓核变性。京尼平的羟基和酯基等活性基团可与胶原蛋白上的氨基反应形成酰胺键。该体系在37 ℃下可于6 min内形成凝胶。由于京尼平交联剂的毒性低,所形成的水凝胶具有良好的生物相容性,可促进髓核特异性基因的表达,促进退化髓核的再生。但其不足之处是京尼平交联中会产生深蓝色色素,影响其使用。
1.2.4 其他化学交联方式除上述席夫碱、点击反应和形成酰胺键的化学交联外,还有光化学交联和动态金属配位交联等交联方式。Brown等[61]在由ChS和甲基丙烯酸酐反应得到的硫酸软骨素甲基丙烯酸酯(mChS,见图2(c))中加入光引发剂,在低强度的紫外光(320~390 nm,10 mW/cm2)照射下,体系发生光聚合反应,得到原位水凝胶。当在mChS单体溶液中加入脂肪干细胞和脱细胞脂肪组织时,光聚合的水凝胶可用作脂肪组织工程的支架材料。另外,Ornell等[77]以甲基丙烯酸缩水甘油酯代替上述的甲基丙烯酸酐与ChS反应,得到生物相容性更好的光聚合前体聚合物硫酸软骨素甲基丙烯酸缩水甘油酯(ChS-GMA,见图2(c))。然后在光引发剂存在下用紫外光(365 nm,10 mW/cm2)辐照得到ChS-GMA水凝胶。该水凝胶可通过静电吸附作用负载阳离子型化疗药物如阿霉素和舒尼替尼。通过调控该体系的组成和ChS-GMA中甲基丙烯酸酯取代度,可以很方便地调节药物的负载和释放,有望用于瘤内注射治疗实体瘤。
另外,Dai等[44]制备了一种基于ChS和Fe3+之间的动态金属-配体配位化学的可注射金属水凝胶。该水凝胶同时具有生物黏附性、自愈合性和多重响应性。将含有Fe3+和ChS的溶液在室温下混合后,因Fe3+与ChS链上的―OH、―COOH和―NH―可快速络合,在10 s内即形成凝胶。该水凝胶的组织黏附性优于商用纤维蛋白胶,是一种优良的生物黏合剂。另外,在pH、离子、中性分子络合剂和氧化还原反应等外界刺激下,通过凝胶-溶胶转变,可快速去除生物黏附。
1.3 酶催化交联的ChS类可注射水凝胶
酶催化交联是指线性聚合物或小分子在生物酶催化下发生的交联反应,具有专一、高效、反应条件温和(在生理条件下反应)、反应速率可调和、生物相容性好等优点[48]。已有报道将辣根过氧化物酶(HRP)用于制备ChS类可注射水凝胶[62,63,78]。HRP是一种单链β型血红素蛋白,是过氧化物酶中应用最广泛的一种,可与H2O2一起引发苯酚或苯胺衍生物产生自由基而发生偶联反应。基于这个偶联反应,将羧基活化的ChS与酪胺(TA)的氨基发生酰胺化反应(图2(b)中路线5),其产物ChS-TA可与自身或含酪胺结构的其他聚合物在HRP和H2O2的作用下经共价交联形成水凝胶。其交联机制是:HRP首先被H2O2氧化形成氧化型Fe(IV)卟啉阳离子自由基,该自由基将ChS-TA中的还原态酚羟基氧化为苯氧自由基,然后形成苯氧邻位的C―C键,或邻位的碳与苯氧的氧相连,由此得到三维网络结构[79]。在原位凝胶形成过程中,带活性自由基的ChS-TA也可能与细胞外基质中酪氨酸分子上的酚羟基发生共价结合,从而使凝胶更好地与宿主组织结合在一起。
FDA批准的普兰多糖具有高黏附性和强的力学性能,ChS具有抗炎、促进伤口愈合等生物活性,Yan课题组[62]以HRP为催化剂,以H2O2为氧化剂,在生理条件下将ChS-TA和酪胺化普兰多糖(CMP-TA)交联得到可注射水凝胶,用于软骨组织工程。CMP-TA的制备方法与ChS-TA类似,也是TA的氨基与普兰多糖中活化的羧基反应而制得。CMP-TA和ChS-TA的溶液与HRP和H2O2简单混合即可快速形成水凝胶。通过改变两种聚合物的质量比、浓度以及HRP和H2O2的浓度,可以方便地调节体系的理化性质,如凝胶化时间、凝胶力学性能和降解行为等。例如,在浓度为0.6 U/mL的HRP和1 mmol/L的H2O2作用下,当CMP-TA/ChS-TA的质量比从纯CMP-TA转变为纯ChS-TA时,凝胶化时间从36 s显著增加到287 s。这说明体系的凝胶化时间随ChS-TA含量的增大而增加。这可归因于ChS-TA中含有更多的酸根离子(如和),具有较大的空间位阻,或通过静电作用与酶的活性位点发生相互作用,从而降低了凝胶化速率。这种可注射水凝胶还具有细胞相容性好和组织相容性好等优点。当两者的质量比为3∶1时,水凝胶具有最好的维持软骨细胞表型和增强软骨形成的效果。另外,ChS-TA的加入也明显减弱了CMP-TA水凝胶的炎症反应。
基于透明质酸(HA)良好的弹性和短链ChS的能量耗散性,Zhang等[63]采用类似方法,将酪胺修饰的HA(HA-TA)和ChS-TA在H2O2和HRP作用下,形成可包封骨髓间充质干细胞(BMSCs)的可注射水凝胶,用于骨组织修复和再生(图6)。改变H2O2和HRP的浓度,可以方便地调节体系的凝胶化时间在几分钟到几秒之间,也可调节凝胶的力学性能。例如,当HRP的浓度为1.5 U/mL、H2O2浓度为4 mmol/L时,体系的凝胶化时间为15 s,凝胶孔径为100~300 μm,有利于凝胶内细胞的存活,也便于骨修复操作。

图6 酶催化交联的包封BMSCs的ChS/HA可注射水凝胶的制备路线[63]Fig. 6 Synthesis route of BMSCs-laden ChS/HA injectable hydrogel with enzyme-catalyzed crosslinking[63]
2 ChS类可注射水凝胶的性能调控
ChS类可注射水凝胶已被用于骨及软骨修复、生物黏合剂、药物输送和细胞治疗等医用领域。ChS类可注射水凝胶作为功能材料,不仅需要具有良好的生物相容性,还需有适宜的性能,如合适的凝胶化时间、较高的且可调控的力学强度、可调控的降解行为以及黏附性和自愈合性等。本文在论述以上各种ChS类可注射水凝胶的制备时,虽已提及相关的凝胶性能,但有些具体研究未能归纳其中。现将相关调控凝胶化时间、增强力学性能和黏附性等的研究简介于此。
2.1 调控凝胶化时间
如前所述,采用热交联和酶交联的体系一般具有较短的凝胶化时间,而DA反应交联则需要较长时间(有的长达几十分钟)[80]。为缩短单一DA化学交联体系的凝胶化时间,通常采用物理交联与化学交联相结合的双交联方式[41,55]。例如,Liu课题组[55]报道了一种基于非共价和DA加成双交联、自增强的ChS类可注射水凝胶。该体系在注射入体内后,通过环糊精与金刚烷间的主客体识别的超分子相互作用,以及PNIPAM温敏性的sol-gel转变来实现体系的迅速凝胶化。然后通过呋喃接枝的ChS(ChS-F)和马来酰亚胺封端的聚乙二醇(PEG-AMI)间发生DA加成反应交联(如图2(b)中路线3)。这种物理交联和化学交联的联用,使整个体系的凝胶化时间在90 s以内。这种联用技术不仅克服了单一DA反应交联凝胶化时间长的缺陷,还提高了水凝胶的力学强度(储能模量达到25 MPa)和含水量(>98 %),为开发高性能的可注射水凝胶提供了新途径。该课题组还采用类似方法,以马来酰亚胺封端的温敏聚合物F127(F127-AMI)为亲双烯体交联剂,与前述的呋喃接枝的ChS(ChS-F)发生DA加成反应,在体外合成了温敏性F127@ChS共聚物。然后和前述的PEG-AMI混合,制备了热交联和DA化学交联双重交联的可注射水凝胶F127@ChS-PEG,也用于弥补单一的DA反应交联体系凝胶化时间长的缺陷[41]。低质量浓度(20 g/L)的F127@ChS温敏共聚物可以在生理温度下发生sol-gel转变,作为物理交联部分,使体系快速凝胶化。当F127@ChS的质量浓度从20 g/L增加到60 g/L时,凝胶化时间也随之从140 s减少到40 s。
另外,Liu课题组[64]还通过DA反应和形成动态酰腙键制备了多重化学交联的F127@ChS-PEG-OChS水凝胶。这里,动态酰腙键赋予体系可注射性和自愈合性,缩短了单纯DA反应交联的凝胶化时间。但DA交联可增强水凝胶在体内的稳定性,并调节其在体内的性能。具体做法是,首先将上述经DA反应形成的F127@ChS-F温敏聚合物,通过EDC/NHS反应体系活化羧基,再与己二酰肼反应,得到F127@ChS-F-ADH。然后将一定量的PEG-AMI与F127@ChS-F-ADH均匀混合,并与氧化的ChS分别装入双管注射器中,同时挤压形成F127@ChS-PEG-OChS水凝胶。在此体系中,AMI残基和呋喃基团之间发生DA化学反应,而ADH残基和OChS的醛基间形成动态的酰腙键。通过调节交联密度和聚合物含量,可以很方便地调节体系的凝胶化时间从几分钟减少到几秒钟。
2.2 增强凝胶的力学性能
一般来说,通过调节体系组分组成和交联密度,可以改善凝胶的力学性能[57,63]。而凝胶体系的交联方式不仅影响体系的凝胶化过程,也影响凝胶形成后的力学性能。由此,可采用多种交联方式联用,形成二重甚至三重交联的凝胶体系[41,56],来改善凝胶的力学性能。例如在上述F127@ChS-PEG可注射水凝胶中,残留在F127@ChS上的呋喃基团与PEG-AMI上的马来酰亚胺残基进一步发生DA加成反应形成化学交联,使所形成的水凝胶的剪切存储模量从单纯热交联的F127@ChS水凝胶的100 Pa左右增强到1 kPa以上,且随着PEG-AMI用量的增大而增大[41]。这种可注射水凝胶负载骨修复因子后在大鼠颅骨缺损治疗中表现出良好的修复效果。
Shen等[78]采用基于两种酶的两步交联法来构建高强度的3D打印水凝胶。该水凝胶的前体由甲基丙烯酸甘油酯和酪胺修饰的ChS(GMA-ChS-TA)、辣根过氧化物酶、葡萄糖氧化酶、葡萄糖、丙烯酰胺和水组成。其交联过程包括两步:(1)葡萄糖氧化酶催化葡萄糖氧化生成葡萄糖酸和H2O2,在H2O2和辣根过氧化物酶共同作用下,GMA-ChS-TA中的酪氨被氧化,发生酶介导的交联反应,形成力学强度较弱的水凝胶I;(2)GMAChS-TA中的酪胺继续被辣根过氧化物酶/葡萄糖氧化酶催化氧化,形成α-碳自由基,引发体系中含双键的丙烯酰胺和甲基丙烯酸甘油酯中的双键发生自由基共聚,形成复合水凝胶II。由此两步交联反应得到的凝胶II比凝胶I具有更高的抗压缩性能和杨氏模量。通过调控共聚单体的用量,可调控凝胶II的力学性能。该方法也可用于制备高力学强度的可注射水凝胶。
另外,在ChS可注射水凝胶体系中引入共价交联的氧化石墨烯,也可增强凝胶的力学性能。氧化石墨烯不仅具有优越的电子、光学、界面、化学和力学性能,还可以在水中降解为腐殖酸类的结构;也可被酶降解为细胞相容性产物[81]。据此,Tang等[60]将伯胺共价修饰的氧化石墨烯与前述羧基活化的ChS反应,生成酰胺键交联的复合水凝胶。该体系可在10 min内原位凝胶化。与一般的ChS凝胶相比,复合水凝胶的刚度增加320%,韧性增加70%。
2.3 增强凝胶的组织黏附性
作为软骨和骨修复等组织工程材料时,凝胶与周围组织的黏附性也是一个重要的指标。虽然ChS自身具有一定的组织黏附性,但为进一步增强支架与宿主组织之间的结合,可在凝胶体系中引入另外的黏附性更强的材料,如明胶[45]、胶原蛋白[58,59]和普鲁兰多糖[54]等。
另外,Wiltsey等[50]在其前期工作基础上,基于海藻酸盐中含有大量的羧基,可与组织中蛋白质上带正电的区域经静电作用而相互吸引带来强的生物黏附性,将海藻酸钙颗粒分散在聚(N-异丙基丙烯酰胺)接枝ChS(PNIPAM-g-ChS)的凝胶中,可明显增强凝胶的黏附性[82]。结果表明,50 g/L的PNIPAM-g-ChS分散体中掺入50 mg/mL或75 mg/mL的海藻酸钙颗粒后,形成凝胶的黏附抗拉强度提高了4倍。海藻酸钙微粒的掺入也显著提高了PNIPAM-g-ChS的溶胀能力,有助于在组织缺陷中保持空间填充的形状。此外,该课题组还将此PNIPAM-g-ChS共聚物与含醛基的OChS共混,利用OChS中的醛基与组织中的氨基形成席夫碱而增加其组织黏附性[42]。但多余的活性醛基会损害包封细胞的活力,因此该课题组将明胶包封在脂质体中与共聚物共混,在生理温度下脂质体熔化,释放的明胶再与体系中多余的醛基发生反应,从而减少残余醛基对细胞活力的影响。该方法在增强凝胶组织黏附性的同时,还降低了毒副反应,是一种很好的构建黏附性生物支架的方法。
近年来,仿贻贝水凝胶由于其超强的黏附性能受到广泛关注。其强的黏附性主要来自于邻苯二酚结构,该结构可通过氢键、疏水作用和π-π堆积等非共价键作用,以及形成席夫碱、迈克尔加成和形成硼酸-儿茶酚络合物等共价作用,而对多种物质具有黏附性[83-85]。Han等[86]将仿贻贝的、具有邻苯二酚结构的聚多巴胺引入到ChS类水凝胶中,形成聚多巴胺-ChS-聚丙烯酰胺复合水凝胶,以增加对软骨细胞的黏附性,促进软骨再生。该策略有望用于ChS类可注射黏附性水凝胶的构建中。
3 结论及展望
硫酸软骨素类可注射水凝胶由于其主要组成单元硫酸软骨素本身是细胞基质的主要成分,还具有促进软骨生长、调控生长因子、促进伤口愈合等多种生理功能,因此其用于软骨和骨修复等组织工程材料时,具有其他可注射水凝胶不可比拟的优势。其凝胶化方式主要有物理热诱导的凝胶化、形成席夫碱、点击化学反应、形成酰胺键和光交联等化学交联,也有温和的酶交联等。这些方式各有优缺点。如热诱导的凝胶化体系一般为单组分,具有操作方便、凝胶化快、无毒副产物等优点,但形成的凝胶力学性能较差。化学交联可很好地改善凝胶的力学性能,但一般为双组分,需要双管推注,操作上比单组分热诱导的交联体系繁琐;另外也可能有副产物带来潜在的毒性;有的体系还需要和物理交联等其他交联方法联用以减少反应时间,形成多重网络结构。酶交联具有温和、反应专一等优点,但也具有和化学交联类似的多组分注射问题。因此,发展基于硫酸软骨素的更便于使用、凝胶化时间适宜和良好力学性能的可注射水凝胶是值得深入研究的方向。同时,应扩展凝胶化体系组成,增强其组织黏附性和自愈合性。这些研究结果将有利于硫酸软骨素类可注射水凝胶的临床转化。
另外,对于进一步开发基于硫酸软骨素的可注射水凝胶,有两个问题值得关注。其一是ChS的来源以及其生物效应。不同于具有特定结构的合成高分子,来自于动物组织提取的ChS因来源不同,而具有不同的类型,而不同类型的ChS具有不同的生理活性。例如在胚胎发育过程中表达最多的ChS-C,可促进脑轴突的生长和再生;成年期表达最丰富的ChS-A却使神经系统可塑性下降,对记忆产生不利影响[87]。商业上使用的硫酸软骨素多提取于鸡、牛、猪和鲨鱼等,其中提取于鲨鱼软骨的以ChS-C为主[88],而提取于猪软骨的以ChS-A为主[35]。研究结果证实,外源ChS-E可抑制小鼠骨肉瘤细胞增殖,而CS-A和CS-C则没有此效果[89]。因此,在构建生物医用的基于ChS的可注射水凝胶时,要注意其来源及类型,以及由此带来的生物效应。然而,欲获得纯的单一组成的ChS仍是一个挑战性课题,因此目前ChS原料纯度低以及由此带来的性能上的不确定性,制约了具有独特生物功能的ChS类可注射水凝胶体系的开发。预期随着单一组分ChS可控制备或纯化技术的进步,将会进一步深化ChS类型和分子量等物性参数对可注射水凝胶的凝胶化行为、凝胶的力学强度、黏附性和生物活性等的系统性研究[90]。而这些研究将有助于充分发挥ChS本身的生物功能、深化物质结构和性能的关系、以及发展更好的组织工程材料和其他生物医用材料。其二,尚缺乏多种响应性ChS类水凝胶的构建和研究。众所周知,响应性的水凝胶有利于包载药物或者细胞以及生物分子等的可控释放[91],但目前仅限于基于ChS的温度敏感型水凝胶的研究,而对于氧化还原响应型、酶响应型等体系的研究还有待深入。
目前ChS类可注射水凝胶主要用于细胞治疗以及骨和软骨修复等,基于此类水凝胶的优良特性,可拓展其用途到其他领域,如利用其抗炎抗凝血等特性可用于心脏瓣膜组织工程、利用其抗肿瘤和免疫调节等特性用于构造肿瘤的瘤内注射药物载体和血管介入栓塞材料等。笔者相信,随着越来越多研究者的加入和研究的深化,基于硫酸软骨素类可注射水凝胶必将在生物医用材料方面发挥更大的作用。
