琼脂对Komagataeibacter xylinus自发变异的控制
2021-06-16王志国钟春燕张伟敏
王志国,钟春燕,张伟敏,*
(1.海南大学食品科学与工程学院,海南海口 570228; 2.海南椰国食品有限公司,海南海口 570311)
木驹形杆菌Komagataeibacterxylinus(或称Acetobacterxylinum,Gluconacebacterxylinus)[1-2],产生的纤维素称为细菌纤维素(Bacterial Cellulose,BC),具有纯度、结晶度、持水力、杨氏模量高及生物相容性好等独特性能[3-5],广泛应用于食品、医药等领域[6-9]。我国海南从1996年开始利用椰子水生产细菌纤维素(椰纤果),目前全省该类厂80多家,年产量约18万吨,年产值近3亿元。但椰纤果生产中一个较为突出的技术问题尚未能解决,即K.xylinus种子液制备时易变异,导致BC产量降低,甚至绝收,此外大量发酵废液的排放,既造成一一经济损失又严重污染环境。
Schramm等首次报道了K.xylinus变异现象。在摇瓶培养时,K.xylinus菌体会发生变异,从而形成具有中度缺陷和严重缺陷的突变体,相较野生型菌株,突变体在菌落特征及产BC能力方面都有显著差异,后来陆续有学者就K. sp.变异现象进行了报道[10-12]。前期研究发现,该菌在静态浅层培养中很稳定,在深层静态培养及搅拌培养中易产生变异菌株[13-14]。此外,琼脂对K.xylinus在不同培养方法下BC产量及结晶度具有较大影响。李少慧及Chao等认为,琼脂使K.xylinus静态培养中BC产量降低[15-16];但在摇瓶或搅拌培养中,因为琼脂降低了剪切力[15],增加了游离细胞数量[15-16],降低了BC结晶度,从而提高了产量[17]。
本实验在静态和动态培养中,研究培养基中添加琼脂对K.xylinus自发变异的影响,采用涂布法对变异菌的数量进行测定,称重法对BC的产量测定,同时运用粘度法和傅里叶变换红外光谱法分别对BC的聚合度和结晶度进行分析,采用分光光度法测定发酵液中纤维素酶活力,以期探寻琼脂对K.xylinus自发变异的控制及原因探索。
1 材料与方法
1.1 材料与仪器
木驹形杆菌(Komagataeibacterxylinus) 本室分离保存;SH液体培养基1000 mL:葡萄糖20 g、蛋白胨5 g、酵母膏 5 g、柠檬酸1.15 g、Na2HPO42.7 g,121 ℃,灭菌20 min,其中加入20 g琼脂成为固体培养基[18];种子液制备:固体培养基上(30 ℃,10 d)挑取5个菌落加入50 mL液体培养基中,30 ℃,静态培养3 d;铜乙二胺溶液 中国纸浆造纸研究院。
SW-CJ-1F单人双面净化工作台 苏州净化设备有限公司;YX280A手提式不锈钢蒸汽消毒器 上海三申医疗器械有限公司;SHP-1500生化培养箱 上海精宏实验设备有限公司;SHZ-82气浴恒温振荡器 常州市华普达教学仪器有限公司;UV-3200紫外-可见光分光光度计 上海美谱达仪器有限公司;1-14高速离心机 德国Sigma;T27傅里叶红外光谱仪 德国Bruker。
1.2 实验方法
1.2.1 培养方法 含琼脂培养液:种子液按5%(v/v)接种量接种至250 mL三角瓶中的150 mL液体SH培养液中(不添加或添加琼脂0.05%和0.10%,以w/v计),30 ℃,静态培养4 d或者120 r/min摇瓶培养4 d。
含泡沫塑料颗粒培养液:静态培养中,防止携带BC的菌体下沉,培养液加入泡沫塑料颗粒(3 mm× 3 mm× 3 mm)。在超净工作台上,泡沫颗粒经紫外灯照射30 min后,直接无菌操作投入至已灭菌的液体SH培养液中,培养基的体积和接种方法同上,30 ℃,静态培养4 d。
转接培养:为了考察K.xylinus在添加琼脂的培养液中,静态和动态转接培养中的自发变异,按5%(v/v)接种量接种至相对应的相同培养基组成和体积的培养液中,并按相对应的相同培养条件进行培养。
上述培养中,以静态培养(不添加琼脂)的为对照组,每个实验重复三次。
1.2.2 变异菌计数 将30 ℃静态或摇瓶4 d的发酵液经过无菌水10~104梯度稀释,取0.1 mL稀释液涂布于固体培养基上,30 ℃,培养7 d,变异菌与正常菌的菌落外观差异明显,正常菌的菌落小而凸起,表面干燥,变异菌的菌落大而扁平,表面湿润[13]。
1.2.3 BC量测定 从发酵液中直接收集膜状BC,而絮状或颗粒状BC经4000 r/m,20 min离心获得,再将BC置于80 ℃,0.1 mol/L NaOH溶液中,维持2 h,冷却后用0.1 mol/L HCl中和,自来水充分洗涤,在80 ℃下干燥至恒重后称重。
1.2.4 BC聚合度及结晶度测定 铜乙二胺溶液法测定BC聚合度(Degree of Polymerization,DP):准确称取经除杂冷冻干燥的BC 0.05 g,加入几小块铜片,用20 mL铜乙二胺溶液,在氮气保护下搅拌溶解,使用乌氏粘度计(内径0.5~0.6 mm)测定其流出时间,按下式计算其聚合度[19]。
式中:ηsp:增比粘度;t:试样流出时间,单位s;t0:铜乙二胺溶液流出时间,单位s;[η]:特性粘度;c:纤维素浓度,单位g/mL。
BC结晶度测定:将除杂冷冻干燥的BC,剪刀剪碎,称取2 mg,用300 mg KBr(光谱级,阿拉丁)充分研磨后压片,使用T27型傅里叶变换红外光谱仪测定样品在4000~400 cm-1范围内的吸光度[20],用基线量取法得到1428及897 cm-1的峰高,根据下列公式计算其结晶度[21-22]。
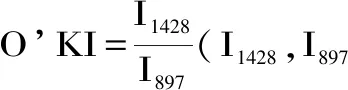
1.2.5 纤维素酶活力测定 发酵液在4000 r/min离心10 min,取上清液20 mL,加入硫酸铵达到60%(w/w),4 ℃,12 h后,4000 r/min离心10 min,收集沉淀,加入0.1 mol/L,pH5.0的乙酸钠缓冲溶液3 mL,转移至透析袋中透析至无铵离子,经PEG-20000浓缩后,加入0.1 mol/L,pH5.0乙酸钠缓冲溶液,使其总体积为1 mL,成为粗酶液,取0.5 mL加入至1 mL乙酸钠缓冲溶液配制的0.2%(w/v)CMC-Na中,37 ℃水浴,60 min,加入DNS试剂3 mL,沸水浴5 min,冷却后再加入8 mL蒸馏水,540 nm波长测定吸光度。

表1 琼脂对K. xylinus静态培养中自发变异及BC产量的影响Table 1 Effects of agar on spontaneous mutation and BC weights of K. xylinus
纤维素酶活力单位为μ mol G/20 mL培养液60 min,其含义:20 mL培养液中的纤维素酶在37 ℃条件下,以CMC-Na为底物,水解60 min,生成的葡萄糖量。
1.3 数据处理
每组实验重复三次。Excel软件中输入数据,进行标准偏差计算、方差分析和Q检验。
2 结果与分析
2.1 琼脂对K. xylinus自发变异及BC产量的影响
静态培养,对照实验中,在气-液界面处,收集到的BC膜不完整(图1A),而添加0.05%琼脂或泡沫塑料小颗粒中则形成完整BC膜(图1B和图1C),添加0.10%琼脂中也形成完整的BC膜。
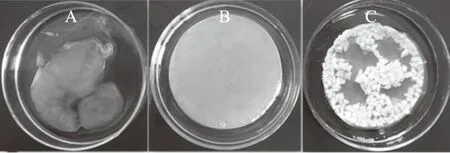
图1 添加琼脂或泡沫塑料颗粒对 K. xylinus静态培养中BC膜形成的影响Fig.1 Effects of agar or foamed plastic particles on BC pellicles in static culture 注:A.对照;B.0.05%琼脂;C.泡沫塑料颗粒。
表1所示:K.xylinus静态培养时,对照实验(未添加琼脂的静态培养)中,变异菌数达4.63×105,占总菌数的38.33%,而添加0.05%和0.10%琼脂的培养液,以及加入泡沫颗粒的培养液中没有出现变异菌。
对照中,BC产量为0.16 g/L,气-液界面是菌体生长繁殖及产BC的活跃层,变异菌在空间及营养物质方面与野生型竞争,导致BC产量最低;当琼脂添加量为0.05%时,由于变异菌没有出现,BC产量增加至0.38 g/L;当琼脂添加量为0.10%时,BC含量反而下降,其原因在于尽管变异没有发生,但琼脂使发酵液粘度过大,营养物质不易渗透至BC膜表面,从而BC产量(0.28 g/L)降低,但仍较对照中的BC产量高。李少慧及Chao等人静态培养时,琼脂使BC产量降低[15-16],可能是因为他们的菌株在静态培养时没有发生变异的缘故。
静态培养是制备K.xylinus种子液的主要方式,但由于培养容器装液量多,液体的深度较大,种子液经过转接后往往发生自发变异,导致其接种至生产培养基中时BC产量大幅下降[13]。本实验发现,静态方式制备种子液时,培养基中添加0.05%的琼脂,即使连续转接9次,种子液中也未曾出现变异菌,且培养液中菌体浓度保持在106CFU/mL以上(见图2)。
K.xylinus动态培养时,变异菌数量高达1.32×107CFU/mL,占总菌数的88.60%,因而BC产量仅为0.09 g/L;0.05%琼脂使变异菌的数量减少,变异菌率下降至66.39%,BC量提高至0.15 g/L;琼脂量增加至0.10%时,变异菌没有出现,此时BC产量达到最高,为0.34 g/L,与静态培养中添加0.05%琼脂的培养液中产量(0.38 g/L)相当。另外,因为琼脂增加了培养液粘度,从而削弱剪切力对菌体产BC的不利影响[15-17]。但尽管培养液中添加0.10%琼脂阻止了变异菌的出现,但如果连续转接至第2次时,变异菌也会产生,往往经3~4次转接后,培养液中几乎都是变异菌(见图2)。
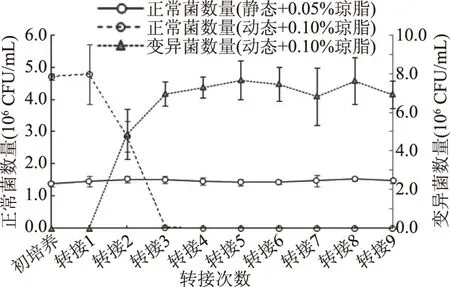
图2 K. xylinus转接培养中的正常菌和变异菌的数量变化Fig.2 Changes in numbers of wild type and mutants during series of transfer passage cultures of K. xylinus
静态和动态培养方式中,添加适量琼脂阻止K.xylinus的自发变异,因而增加了BC产量。静态培养中,0.05%琼脂培养液连续转接9次也没有出现变异菌株。动态培养中,0.05%琼脂培养液转接过程中变异菌株易出现,琼脂的添加量增加至0.10%时,初次培养和转接第一次时,变异菌不会出现,但继续增加转接次数,变异仍会发生。继续提高琼脂的量,培养液粘度过大而无法进行动态培养。
2.2 琼脂对BC的DP及结晶度的影响
图3显示:静态培养中,BC的聚合度(DP)为5.03×103,琼脂添加量为0.05%和0.10%的培养基中则分别为4.83×103和4.96×103,由此可见,静态培养中,琼脂对BC的DP影响不大(减小幅度皆小于4%);动态培养中,BC的DP为3.92×103,0.05%及0.10%琼脂中BC的DP分别为3.61×103和2.95×103。由此可见,培养方式会影响BC的DP,摇瓶生产的BC的DP比静态生产的低,降低22.2%,培养基中添加琼脂,会加剧DP的下降,当琼脂量为0.05%时,比静态的DP下降26.7%,琼脂量为0.10%时,下降幅度达42.2%。
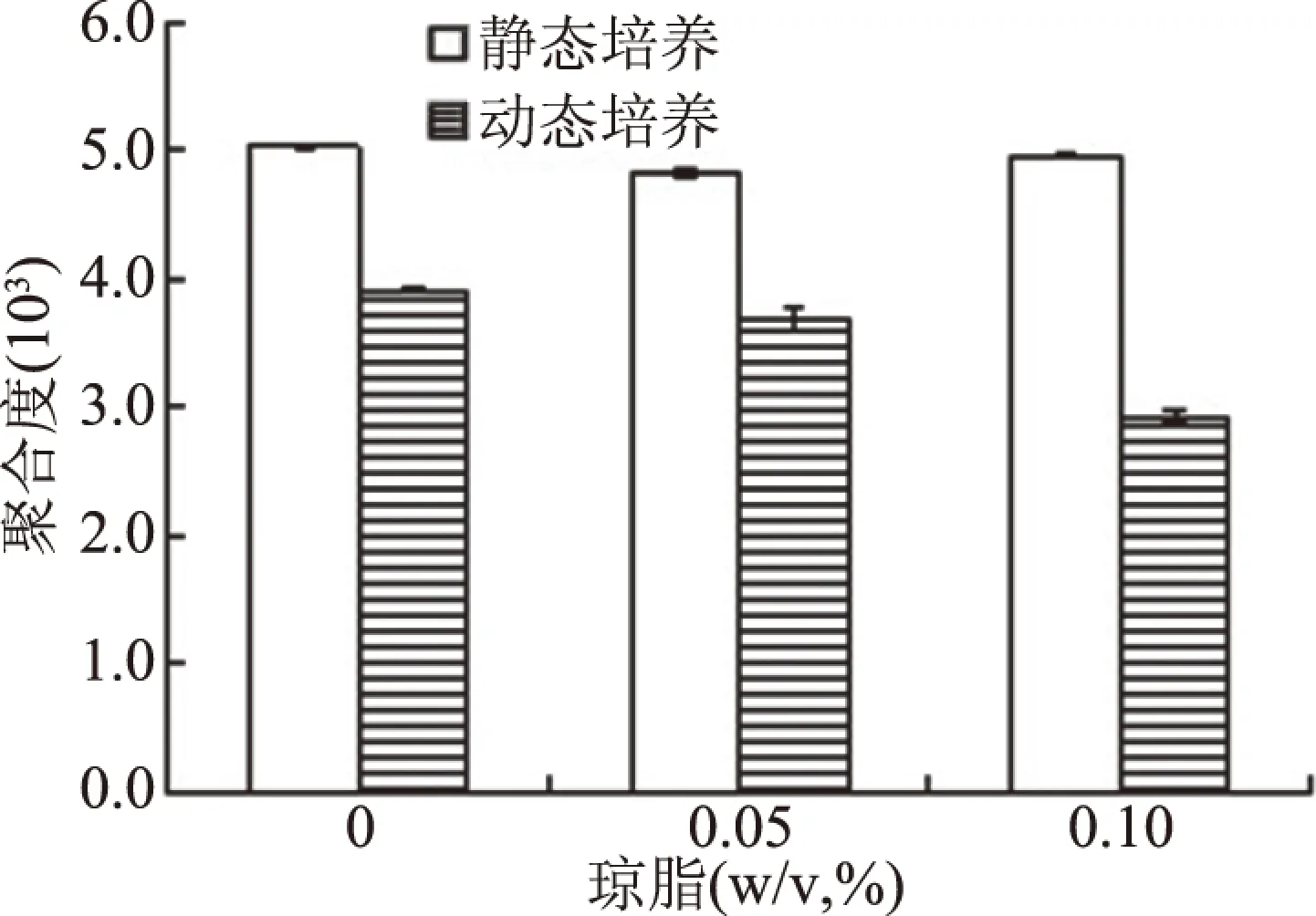
图3 琼脂对BC的DP影响Fig.3 Effects of agar on DP of BC
静态和动态培养中的BC在800~1500 cm-1范围的的FT-IR图谱见图4和图5,用基线量取峰高法测定BC的O’KI结晶指数,结果如表2所示:对照(未添加琼脂的静态培养)中的BC的结晶指数为3.14,这比文献[21,23]报道的4.84要低,可能是菌株差异的缘故。
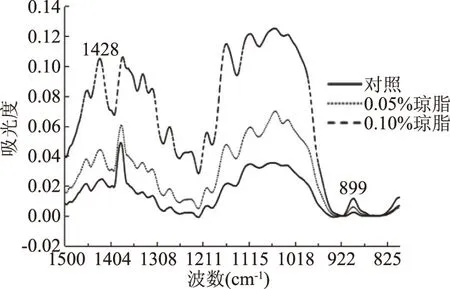
图4 K. xylinus静态培养中产生BC的FTIR谱图Fig.4 FTIR spectrum of BC produced by K. xylinus in static culture

图5 K. xylinus摇瓶培养中产生BC的FTIR谱图Fig.5 FT-IR spectrum of BC produced by K. xylinus in shaken culture

表2 琼脂对K. xylinus产BC的结晶度影响Table 2 Effects of agar on O’KI index of BC produced by K. xylinus
表2可以看出:以未添加琼脂的静态产生BC的结晶指数为基准,静态培养中,添加0.05%琼脂,结晶指数降低至2.73,下降13.1%,当琼脂量增至0.10%时,结晶指数为2.85,下降9.2%,其原因可能是高浓度的琼脂,因粘度过大,不易渗透至气-液界面的BC中,因而对纤维素的结晶过程干扰有限,从而与0.05%的琼脂中的BC的结晶度相较而言,下降幅度略低(前者下降幅度13.1%,后者9.2%)。
动态培养中,未添加琼脂中的结晶指数为2.54,下降19.1%,表明摇瓶培养降低了BC的结晶度。培养液中添加0.05%琼脂,结晶指数下降至2.23,下降28.9%,当琼脂增加为0.10%时,结晶指数为1.53,下降幅度达到最高51.3%。可见,摇瓶培养时,添加琼脂大大降低了BC的结晶指数,其原因可能是摇瓶培养时,琼脂能更好地吸附于BC上从而严重干扰BC的结晶。
琼脂对BC的结构影响与培养方式有关:从对DP影响的角度看:琼脂在静态培养中的影响较小(<4%),但在动态培养中却加剧DP下降;从对结晶度影响的角度看:琼脂在两种培养方式中都导致BC结晶度极显著下降(P<0.01),只是相较静态培养,动态培养中下降的幅度更大。
2.3 琼脂对培养液中K. xylinus的纤维素酶活力影响
静态及摇瓶培养中皆检测到纤维素酶活力(见图6),这与Kenji等[24]的结论一致,两种培养方式中,纤维素酶活力没有差异,而琼脂的添加对纤维素酶活力也没有影响。

图6 K. xylinus培养液中纤维素酶活力Fig.6 Activities of cellulase in K. xylinus culture
3 结论与讨论
K.xylinus静态和动态培养中,培养液中添加琼脂阻止其发生自发变异,从而提高了BC产量,由于琼脂静态培养液连续转接过程很稳定,适合于制备种子液。结构方面来说,琼脂对静态培养产生的BC的DP影响较小,但极显著(P<0.01)下降BC的结晶度;对动态培养中的BC的DP和结晶度都极显著(P<0.01)下降。
Coucheron[25]发现G.xylinusATCC 23769(或K.xylinusATCC 23769)中具有插入序列IS1031,该序列的存在导致K.xylinus易变异,当培养条件改变时,产BC的正常菌(Cellulose+,Cel+)或不产BC的变异菌(Cellulose-,Cel-)具有生长优势:a.静态培养时,BC膜使Cel+漂浮在氧气充足的气-液界面,而Cel-则处于液体中,因缺氧而渐亡[26]。本实验中也发现,静态培养中,气-液界面有完整BC膜(0.05%和0.10%琼脂及泡沫颗粒培养液)的培养液中没有出现变异菌,而无完整BC膜(对照)的培养液中分离到变异菌株,但对于为何对照实验中会产生不完整的BC膜尚无定论;b.动态培养时,充足的氧气使Cel+过度生长,Cel-产生的概率增加,同时Cel+被所形成的BC包裹,而Cel-呈游离状态,转接时吸取的液体中,Cel-占有数量优势,所以多次转接后只剩下Cel-[27]。本实验也发现,动态培养中易出现变异菌株,培养液中变异菌的百分含量随转接次数的增加而增加直至全部为变异菌,但0.10%琼脂加入至培养液中时,尽管琼脂干扰了BC球的形成,使BC呈粉状,按上述观点,转接过程中Cel+和Cel-应共存,但实验结果却显示转接至第四次时,培养液中只有Cel-;Jung等通过透射电镜证明,Cel-比Cel+有更完整的双层膜结构,动态培养时,Cel-能承受剪切力而得以富集[28]。本实验中培养液添加0.10%琼脂在初次培养时只有Cel+,转接一次时,也只有Cel+,且总量与初次培养时相近,说明0.10%琼脂足以消除剪切力对Cel+破坏,但随后的转接过程中Cel+却逐渐消失。
琼脂对K.xylinus自发变异的控制的可能原因在于琼脂消除了BC对细胞的胁迫:静态培养时,一方面,气-液界面层是菌体生长繁殖最活跃层,菌体分泌出BC后,BC仍附着在细胞膜上[1],而BC的密度(3.2 g/L)促使携带BC的细胞沉降,另一方面,K.xylinus是严格好氧菌[6],有向气-液界面上浮的趋势,于是携带BC的菌体处于反复的沉-浮运动状态,BC就成为细胞的负担或胁迫,该胁迫促使相关的维素合成酶的基因序列或表达向着不产BC方向变异。静态培养中,培养液在培养容器中的高度是导致变异发生的关键因素:浅层培养时,BC的产生及膜的形成缩小甚至消除了细胞沉-浮运动的空间,因而消除了BC胁迫;深层培养时,细胞沉-浮运动有足够的空间,长时间的BC胁迫导致变异发生,Cel-一旦产生,便占据气-液界面,与正常菌在营养和空间上竞争,致BC膜不能完整形成。吴谦等[13]的实验也表面静态培养中的变异与培养液在培养容器中的高度紧密相关。琼脂增加液体的粘度而抑制细胞的沉-浮行为,泡沫颗粒使菌体被固定在气-液界面而消除细胞的沉-浮行为,因此静态培养中,培养液中添加琼脂或者泡沫颗粒就能控制K.xylinus自发变异;动态培养时,一方面,0.10%琼脂使BC的结晶度极显著(P<0.01)下降,同时,纤维素酶更易和BC接触,这两个因素使BC极易被纤维素酶水解,从而使BC的聚合度极显著下降。低聚合度意味着低BC胁迫,从而抑制K.xylinus在动态培养中的变异,但转接培养导致低BC胁迫长时间存在,故变异发生。
