双水相分离火龙果皮中色素和果胶
2021-06-16胡金梅吴巧婷谢晶晶
胡金梅,吴巧婷,谢晶晶,周 林
(1.广东环境保护工程职业学院,广东佛山 528216; 2.广东药科大学,广东广州 510006)
火龙果(HylocereusundulatusBritt)又名红龙果、青龙果、仙蜜果等,属仙人掌科量天尺属和蛇鞭柱属植物。火龙果原产于美洲地区,在我国的贵州、云南、福建、两广地区均有种植[1]。目前栽培品种主要有红皮白肉、红皮红肉、黄皮白肉三种。
火龙果皮是火龙果加工的主要副产品,通常被直接丢弃。果皮占整个火龙果质量的25%左右,火龙果果皮含有一般植物少有的甜菜红素(betalanins),其色泽鲜艳,是一种具有抗氧化[2]、降血脂[3]等生物活性的天然水溶性色素。虽然甜菜红素可以从红甜菜中提取,但红甜菜中提取的甜菜红素带有土腥味、还含有吡嗪等有害物质;而火龙果中的甜菜红素更具优越性[4]。除了色素成分,火龙果皮中还含有丰富的果胶多糖。近年来,针对火龙果皮中色素、果胶成分提取的研究日益增多。如采用水和乙醇溶剂浸提、微波辅助提取甜菜红色素[5-7]。采用酸提醇沉法、离子交换法、盐沉淀法提取果胶[8-9]。
上述提取方法可以为火龙果资源开发所借鉴,但是传统的水提法不易将果皮色素完全提取,且后续需要采用浓缩等方式[10],而乙醇溶剂容易破坏色素的性质结构[11],微波辅助等会产生热量,均不利于色素结构的稳定。此外,这些方法主要针对单一色素或果胶成分的提取,原料利用尚不充分,影响到火龙果资源开发的经济性。与上述分离技术相比,双水相萃取技术具有生物相容性好,目标产物活性损失少,操作条件温和,无有机溶剂残留,设备简单,易于放大和连续操作等优点,特别适用于生物物质的分离和提纯[12]。因而探讨双水相体系同时萃取分离火龙果皮中甜菜红素和果胶的工艺对于火龙果皮的开发具有积极意义。已有研究报道,采用聚乙二醇(PEG)/硫酸铵双水相体系,可同时萃取甜菜根中的红色素和多糖,70%~75%红色素被富集到聚合物上相,盐下相可富集80%~90%的多糖[13]。本研究采用双水相体系中常见的PEG/硫酸铵体系,考察成相聚合物PEG的相对分子质量和质量分数、盐的质量分数、体系pH对色素和果胶提取的影响,为火龙果果皮的综合利用提供实验依据。
1 材料与方法
1.1 材料与仪器
广西金都一号红心火龙果 佛山南海农贸市场采购;聚乙二醇(Polyethylene glycol,PEG)1000、2000、4000、6000 化学纯,中国医药集团上海化学试剂公司;硫酸铵、氢氧化钠、浓盐酸、无水乙醇 分析纯,广州化学试剂有限公司。
Bruker Tensor II傅里叶红外光谱 布鲁克仪器有限公司;UV-1800分光光度计 岛津仪器有限公司;KQ-300V型超声波清洗器 昆山市超声仪器有限公司;GZX.9140MBE型数显鼓风干燥箱 上海博迅实业有限公司医疗设备厂;RE.52AA型旋转蒸发器、小型电动粉碎机 上海亚荣生化仪器厂;雷磁PHS-3C酸度计 上海精密科学仪器厂;AnkiTDL离心机 上海安亭科学仪器;DZ-2BC II型真空干燥箱 天津泰斯特仪器有限公司。
1.2 实验方法
1.2.1 原材料的处理 选用新鲜火龙果果皮,除去杂质,避光风干,粉碎机粉碎,过10目筛,得到果皮干粉置于玻璃干燥器内室温、避光保存备用。
1.2.2 PEG/盐双水相体系建立 称取适量PEG,加入一定量水搅拌溶解,加入适量硫酸铵,磁力搅拌器混合,再加入适量火龙果皮干粉,继续搅拌30 min,静置待两相分层。分别收集上相、下相溶液,记录体积V上和V下,计算相比R。
计算公式:
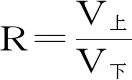
1.2.3 双水相分离条件研究 采用单因素法分别考察PEG相对分子量和浓度、体系pH、硫酸盐质量分数等因素对火龙果皮中色素含量和果胶萃取得率的影响,确定最佳双水相萃取条件。
1.2.3.1 PEG相对分子量的影响 分别称取30 g不同相对分子量PEG(1000、2000、4000、6000),加100 mL水溶解后,加入30 g硫酸铵,再加入1 g火龙果皮干粉搅拌均匀,溶液体系pH约5.0,计算双水相的相比,色素与果胶的得率。
1.2.3.2 双水相体系pH的影响 分别将30 g PEG2000、PEG4000用80 mL水溶解后,加入30 g硫酸铵搅拌,用盐酸将pH分别调至2、3、4、5,加水至100 mL,再加入1 g火龙果皮干粉,搅拌均匀,按照1.2.2方法进行操作,取适量上相红色素提取液,室温静置48 h后,在400~650 nm范围内进行光谱扫描。考察体系pH对萃取红色素的稳定性影响。
1.2.3.3 硫酸铵质量分数的影响 称取30 g PEG4000,加100 mL水溶解后,分别加入不同质量(5、10、15、20、25、30) g的硫酸铵,对应的质量分数分别为4%、7%、10%、13%、16%、19%,用盐酸调至pH4,再加入1 g火龙果皮干粉搅拌均匀,按照1.2.2方法进行操作,计算双水相的相比,色素与果胶的得率。
1.2.3.4 PEG质量分数的影响 分别称取不同质量(5、10、15、20、25、30) g的 PEG4000、PEG6000,对应的质量分数分别为7%、10%、13%、16%、19%,加100 mL水溶解后,加入30 g硫酸铵搅拌溶解,用盐酸调至pH4,再加入1 g火龙果皮干粉搅拌均匀,按照1.2.2方法进行操作,计算双水相的相比,色素与果胶的得率。
1.2.4 色素提取液的测定
1.2.4.1 可见分光光谱扫描测试 火龙果皮经PEG/硫酸铵双水相萃取,上、下相分离后,取适量上相红色素提取液,用去离子水稀释后,在400~650 nm范围内进行光谱扫描。
1.2.4.2 红色素含量和得率的测定 参考文献方法[14],采用摩尔消光系数法计算红色素粗取液中的甜菜红素含量。
甜菜红素含量(g/L)=(OD538×550.11)/61600
式中:OD538为吸光值;550.11为标准甜菜红素摩尔分子量;61600为标准甜菜红素摩尔消光系数。
甜菜红素得率按照下式计算:
甜菜红素得率(%)=[(C×N×V)/M]×100
式中:C为提取液中甜菜红素含量,g/L;N为稀释倍数;V为提取液体积,L;M为火龙果皮干重,g。
1.2.5 果胶的测定
1.2.5.1 果胶的纯化 火龙果皮经PEG/盐双水相萃取,上、下相分离后,将下相提取物过滤,得到滤渣用20 mL水清洗3次去盐,再用80 ℃热水浸提30 min,然后过滤除渣。参考文献[15]方法,滤液加入1.5倍体积的95%乙醇后静置40 min,离心分离,收集离心沉淀,得到的凝胶状液体即果胶,于55 ℃条件下干燥至恒重,称量,并采用红外光谱进行表征分析。
1.2.5.2 红外光谱定性分析 采用红外光谱仪,压片法测定。将干燥的果胶样品与KBr压制成片,在4000~400 cm-1波数范围扫描测定光谱吸收值。
1.2.5.3 果胶得率计算公式

1.3 数据处理
色素和果胶的得率重复测定三次取平均值,采用Sigmaplot 14.0作图。
2 结果与分析
2.1 PEG相对分子量对萃取的影响
考察PEG相对分子量对色素和果胶的影响,实验结果显示,当双水相体系盐质量分数一定时,随着PEG相对分子量(1000、2000、4000、6000)增加,可以观察到上相中红色素的颜色逐渐加深;同时上相体积也逐渐增大,当PEG相对分子量达到4000以上,相比开始趋于平稳(图1a)。上相中红色素和下相中果胶的得率随着PEG相对分子量的增加也呈上升趋势(图1b)。因此,PEG相对分子量增加有利于红色素和果胶的分离。但是随着PEG相对分子量增大,溶液的粘度也逐渐增大。因此,考虑到对于后续分离操作的影响,PEG的相对分子量选择4000和6000较为合适。
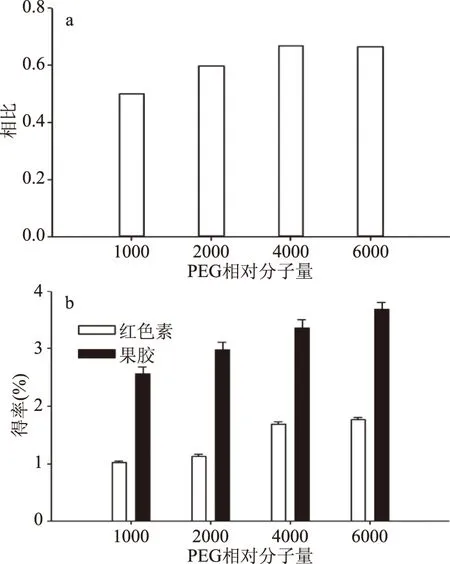
图1 PEG相对分子量对PEG/(NH4)2SO4 双水相系统相比、色素和果胶得率的影响Fig.1 Effect of PEG relative molecular weight on phase volume ratio,yield of pigment and pectin under PEG/(NH4)2SO4 aqueous two-phase system
2.2 双水相体系pH对萃取的影响
火龙果红色素在碱性条件下不稳定,文献中已有相关分析[16],因此实验主要考虑pH<6的酸性条件下双水相体系pH对红色素和果胶的影响。另外,实验过程中发现PEG分子量低时,提取的红色素在室温放置时褪色较为明显。因此,为了更好的分析双水相体系pH对色素的影响,选取了PEG2000和PEG4000与硫酸铵形成双水相体系,分别调节pH至2、3、4、5,考察体系pH对萃取红色素的稳定性影响。
通过肉眼观察结合图2分析表明:采用PEG4000,pH3~5时,红色素的吸收光谱曲线较为稳定,但是当pH2时,红色提取液放置48 h后,褪色严重,大部分降解为橙黄色。采用PEG2000时,红色素提取液的颜色均较相应的PEG4000色素提取液浅,室温放置48 h后,红色素褪色显著。且pH越低,红色素褪色越明显,双水相体系pH2时,红色素完全退色,降解为橙黄色。因而,火龙果中红色素的稳定性受pH影响较大。在 pH4~5范围内,火龙果果皮红色素保持鲜红色,其最大吸收波长在538 nm附近;pH2~3时色素溶液呈紫红色,且很快会褪色。这可能与酸性条件下,甜菜苷C15发生异构化或脱氢反应有关[17]。另外,有研究报道,采用酸提醇沉提取火龙果皮果胶的最佳pH为4[15,18]。结合上述认为采用双水相体系同时提取火龙果红色素和果胶的pH为4。

图2 PEG/(NH4)2SO4 双水相体系的 pH对红色素可见光谱的影响Fig.2 Effect of pH of PEG/(NH4)2SO4 aqueous two-phase system on visible spectrum of red pigment
2.3 硫酸铵质量分数对萃取的影响
由图3可知,硫酸铵质量分数在4%~19%的范围内,随着硫酸铵质量分数的增加,相比逐渐减少,上相中红色素和下相中果胶的得率逐渐增加。当硫酸铵的质量分数低于7%时,双水相体系分相不明显,色素和果胶的得率低。因此硫酸铵的质量分数对提取的影响较大。但是随着硫酸铵质量分数增加,会导致溶液粘度增加,造成下相溶液中果胶后续分离的问题,因而后续实验中硫酸铵质量分数设定为19%。

图3 硫酸铵质量分数对PEG/(NH4)2SO4 双水相相比、色素和果胶得率的影响Fig.3 Effect of ammonium sulfate weight fraction on phase volume ratio,yield of pigment and pectin under PEG/(NH4)2SO4 aqueous two-phase system
2.4 PEG质量分数对萃取的影响
如图4a所示,PEG的质量分数较少时,上相体积小,色素不能完全富集到上相,随着PEG质量分数的增加,双水相体系的相比呈上升趋势,即上相体积随PEG质量分数的增加而增大。当PEG质量分数增加到13%,可观察到红色素全部富集在上相,且上、下相体积接近。随着PEG质量分数增加(图4b与图4c),上相中的红色素和下相中的果胶的得率随之增大。但是随着PEG质量分数的增加,溶液体系的粘度也增大,会导致相间分子转移的阻力增加。当PEG6000质量分数达到13%时,色素和果胶的得率分别为1.64%±0.04%、3.74%±0.15%,当PEG质量分数进一步增加至16%时,色素的得率增加至1.80%±0.04%,果胶的得率减少至3.68%±0.13%;PEG质量分数进一步增加至19%时,色素得率(1.82%±0.04%)略有增加,但是果胶得率有所减少。因而实验条件下,采用PEG6000分离色素的最大提取率(1.82%±0.04%)略高于PEG4000(1.74%±0.04%)。
综上,随着双水相体系PEG和(NH4)2SO4的质量分数增加,火龙果皮中色素和果胶的得率都会增加,当相比接近0.5时,上相红色素和下相果胶得到较好的分离,色素和果胶的得率均达到最大。而当PEG质量分数持续增加,由于上相粘度和溶液疏水等性质的改变,分离时会有少量果胶进入上相,导致下相中果胶减少。如果优先考虑应用价值较大的火龙果皮色素得率最大化,确定双水相分离火龙果皮色素和果胶的优化条件为:采用质量分数16%的PEG6000,硫酸盐质量分数19%,双水相体系pH4.0,上相中红色素和下相中果胶的得率分别为1.82%±0.04%、3.68%±0.13%,所提取的红色素得率略高于乙醇溶剂提取法[11],果胶的得率也较其他采用酸提醇沉法略高[8],因此,双水相同时萃取分离火龙果皮中的色素和果胶,较其他只提取单一物质的工艺具有一定的优势。

图4 PEG分子量和质量分数对PEG/(NH4)2SO4 双水相溶液相比、色素和果胶得率的影响Fig.4 Effect of relative molecular weight and weight fraction of PEG on phase volume ratio,yield of pigment and pectin under PEG/(NH4)2SO4 aqueous two-phase system

图5 火龙果皮经PEG/(NH4)2SO4双水相系统分离后 上相色素提取物的可见吸收光谱Fig.5 Visible absorption spectrum of pigment extract from upper phase of aqueous two-phase system of PEG/(NH4)2SO4 from pitaya peel
2.5 色素提取液的可见吸收光谱
火龙果皮色素提取液经适当倍数稀释后,于紫外-可见分光光度计400~650 nm进行扫描,得到吸收光谱曲线。由图5可见,火龙果皮中红色素的最大吸收波长538 nm,与已有文献报道一致[10-11]。鉴于对火龙果中甜菜苷色素的基本性质及结构已有报道[19-21]。初步推断双水相体系分离出的红色提取液含有甜菜红素。
2.6 提取果胶的红外光谱
火龙果皮采用双水相系统分离得到的下相提取物,经乙醇沉淀后的干燥物采用红外光谱仪扫描(图6)。3100~2800 cm-1间的吸收峰是由C-H吸收引起的,主要包括-CH、-CH2和-CH3的伸缩振动。1760~1730和1630~1600 cm-1间的吸收峰,分别是酯化的羰基和未酯化的羰基红外吸收引起[8-9],此处的吸收峰很弱,说明所得果胶为低酯果胶[22]。此外,1394 cm-1附近还有一个较强的羰基(-COOH)对称吸收峰;1300~800 cm-1间有一些中等强度吸收峰,这些峰是果胶的指纹区,1100~1000 cm-1之间还有R-O-R和C-C的吸收峰,样品在1045 cm-1的特征峰是C-O-C的伸缩振动峰,表明有甲氧基存在。甲氧基是果胶的主要官能团,王雪等[8-9]也发现火龙果皮中果胶属于低酯、低甲氧基果胶。因此,经对比可知所测样品具有果胶的特征吸收峰,火龙果皮中提取的样品为低酯果胶。

图6 火龙果皮经PEG/(NH4)2SO4 双水相系统分离后下相提取物的红外光谱Fig.6 Infrared spectroscopy of extract from lower phase of aqueous two-phase system of PEG/(NH4)2SO4 from pitaya peel
3 结论
采用PEG/(NH4)2SO4双水相体系在室温条件下可以同时分离富集火龙果皮中色素和果胶。通过考察PEG相对分子量、PEG和硫酸盐质量分数和体系pH对PEG/硫酸盐双水相体系分离火龙果皮中红色素和果胶萃取的影响。发现PEG相对分子量、PEG和硫酸盐质量分数的增加,均有利于红色素在上相,果胶在下相富集;但是PEG相对分子量和PEG质量分数的进一步增加,会导致溶液体系的粘度增大,不利于后续的精制过程。研究建立了优化的PEG/硫酸盐双水相体系分离条件,即采用质量分数16%的PEG6000,质量分数19%硫酸铵,pH4.0,在此条件下火龙果皮中色素和果胶的得率分别为1.82%±0.04%、3.68%±0.13%。论文研究工作可以为火龙果皮中红色素和果胶的开发利用提供参考。
