菊苣多糖对免疫抑制小鼠免疫功能的影响
2021-06-16吴雨龙张艺鏻江海涛
吴雨龙,朱 华,张艺鏻,江海涛,华 春
(1.南京晓庄学院食品科学学院,江苏南京 211171; 2.江苏省高校“特殊生物质废弃物资源化利用”重点建设实验室,江苏南京 211171; 3.江苏第二师范学院,江苏南京 210013)
免疫是指机体免疫系统通过免疫应答识别自身和外来物质,消除抗原性异物,以维持机体在生理平衡下的功能[1]。免疫应答调节在预防疾病中起着重要的作用,活性物质诱导的免疫调节和免疫刺激的研究越来越受到重视。近期研究表明,免疫调节剂可以增强机体的防御反应,这是提高抗病能力的有效途径[2]。临床研究表明,增强机体免疫力可以有效地防御病毒、病菌的入侵[3]。因此,有效调节免疫活性已成为研究的热点。
多糖是一种生物大分子,与蛋白质和核酸一样是机体的重要组成部分。研究表明多糖具有多种生物活性,如抗氧化、抗肿瘤、免疫调节以及抗炎活性等[4-6]。大多数活性多糖具有免疫功能,有关多糖的免疫机制已被越来越多的研究者关注[7-9]。作为非特异性免疫和特异性免疫系统的一部分,巨噬细胞和淋巴细胞在机体防御中起着关键作用。据报道,多糖可激活巨噬细胞和淋巴细胞的增殖[10]。
菊苣(CichoriumintybusL.)为菊科菊苣属多年生药食两用草本植物,富含多糖、菊苣酸、多酚类等多种功能活性成分[11-12],其中菊苣多糖(chicory polysaccharide,CP)具有多种生物活性,如保护皮肤、抗氧化、抗疲劳、降脂保肝、延缓衰老等[13-17],但有关菊苣多糖提高免疫活性的研究尚未见报道。本研究利用免疫抑制小鼠模型评价菊苣多糖对免疫活性的调节作用,以期为进一步研究和综合开发利用菊苣资源提供一定的科学依据和参考价值。
1 材料与方法
1.1 材料与仪器
菊苣多糖(白色粉末,相对分子量为8511.4 Da;主要由山梨醇、葡萄糖、果糖和糖醇组成,摩尔比为1.00∶5.58∶13.97∶10.32;属杂多糖,含有α-糖苷键) 南京晓庄学院食品科学学院生物功能分子研究室[15];ICR雄性小鼠 动物合格证号:SCXK(苏)2017-0001,体质量18~22 g,南京市江宁区青龙山动物繁殖场提供;脾氨肽口服液 北京第一生物化学药业有限公司;环磷酰胺 上海宝生物科技有限公司;乙二胺四乙酸(EDTA) 美国Sigma公司;鸡红细胞和绵羊红细胞(SRBC) 北京博尔西科技有限公司;都氏试剂 北京中诺泰安科技有限公司;TNF-α酶联免疫试剂盒(RAB0477-1KT)、IL-2酶联免疫试剂盒(RAB0287-1KT)、IL-6酶联免疫试剂盒(RAB0309-1KT) 德国Merck公司;其它试剂 均为国产分析纯。
JA3003N型电子天平 上海精密科学仪器有限公司;YT-CJ-2D超净工作台 苏州净化公司;XS-500i全自动血细胞分析仪 希森美康医用电子(上海)有限公司;Forma TM 310细胞培养箱 美国Thermo公司;NIKON 50iH600L生物显微镜 日本尼康公司;SYNERGY/HTC全波段酶标仪 美国BioTek公司。
1.2 实验方法
1.2.1 实验设计 雄性ICR小鼠240只,适应性饲养3 d后进行随机分为6组(空白组、模型组、药物组(脾氨肽)、菊苣多糖(chicory polysaccharide,CP)低、中、高剂量组。空白组灌胃等体积(10 mL/kg)纯净水;模型组灌胃等体积纯净水;药物组灌胃脾氨肽口服液(一种较为常见的免疫刺激性药物)83 mg/kg;CP低剂量组灌胃CP 100 mg/kg;CP中剂量灌胃CP 200 mg/kg;CP高剂量组灌胃CP 300 mg/kg;持续35 d。除空白组外,其余各组小鼠从第28~30 d腹腔注射环磷酰胺(60 mg/kg/d)以建立免疫抑制模型。最后一次灌胃给药24 h后,各组小鼠随机取10只称重、采血、处死,取胸腺、脾脏等器官,备用。
1.2.2 免疫抑制小鼠净体质量增率及免疫器官指数测定 根据之前记录的小鼠的体质量、胸腺、脾脏计算小鼠的净体质量增率和免疫器官指数。计算公式如下:
净体质量增率(%)=(最终体质量-初始体质量)/初始体质量×100
式(1)
胸腺指数(%)=胸腺质量(g)/体重(g)×100
式(2)
脾脏指数(%)=脾脏质量(g)/体重(g)×100
式(3)
1.2.3 免疫抑制小鼠全血红细胞和白细胞指标的测定 在小鼠采血完成4 h内,利用全自动血细胞分析仪对小鼠全血中的白细胞和红细胞含量进行检测。
1.2.4 免疫抑制小鼠血清IL-2、IL-6以及TNF-α水平的测定 将1.2.1中所采各组小鼠血,置于2 mL离心管中,3000 r/min离心10 min,得小鼠血清样品,分别用ELISA试剂盒检测各组小鼠血清中IL-2、IL-6以及TNF-α的水平。
1.2.5 免疫抑制小鼠迟发型变态反应检测 经35 d处理后,根据Shimamura等[18]的方法,采用足跖增厚法测定迟发性变态反应。先用2%(v/v)SRBC进行腹腔免疫,每只小鼠注射0.2 mL,使其为致敏小鼠。免疫4 d后,用游标卡尺测量各组小鼠的左后足跖部的厚度,然后在测量部位皮下注射20%(v/v)的SRBC,每只小鼠注射20 μL,注射后24 h内同一时间测量左后足跖的厚度3次,取平均值。
1.2.6 小鼠血清溶血素的检测 经35 d处理后,根据Zou等[19]的方法检测血清溶血素。各组小鼠腹腔注射2%的SRBC悬液0.2 mL。免疫4 d后,进行眼眶取血,分离血清,用无菌的纯净水进行稀释(1∶100)。在5 mL离心管中,按顺序加入1 mL稀释血清溶液,体积分数为10% SRBC 0.5 mL以及1 mL新鲜豚鼠血清混合均匀;空白组血清用纯净水代替。样品在37 ℃恒温水浴中孵育30 min,然后在0 ℃冰浴中停止反应。3000 r/min离心10 min,得上清液。取1 mL上清与3 mL都氏试剂充分混合均匀,同时,取0.25 mL 10% SRBC悬液加都氏试剂至4 mL充分混合均匀,将其作为半数溶血管。静置10 min后,将空白组设置为参照,540 nm波长处测定各个样品管的光密度值(OD),用半数最大溶血素抗体浓度(half-maximal hemolysin antibody concentration,HC50)表示各组小鼠血清溶血素的含量。计算公式如下:
HC50=(样品管OD/半数溶血管OD)×稀释倍数
式(4)
1.2.7 免疫抑制小鼠腹腔巨噬细胞功能测定 根据小鼠腹腔巨噬细胞吞噬鸡红细胞的方法来检测腹腔巨噬细胞的吞噬能力[20]。取1.2.1各组中剩下的10只小鼠,腹腔注射6%淀粉肉汤(含台盼蓝)1 mL,连续注射3 d后,每只小鼠再注射1%鸡红细胞悬液1 mL,轻按小鼠腹部,使悬液分散。30 min后,颈椎脱臼法处死小鼠。将小鼠置于超净工作台内,75%乙醇腹部消毒,剖开腹腔,用吸管吸取腹腔液,滴1滴于干净载玻片上,用细胞培养箱37 ℃孵育30 min,镜检,每片计数100个巨噬细胞,观察记录吞噬鸡红细胞的巨噬细数及被吞噬的鸡红细胞数。吞噬百分率和吞噬指数计算公式如下:
吞噬百分率(%)=(吞噬鸡红细胞的巨噬细胞数/巨噬细胞总数)×100
式(5)
吞噬指数=巨噬细胞吞噬的鸡红细胞总数/吞噬鸡红细胞的巨噬细胞总数
式(6)
1.3 数据处理
2 结果与分析
2.1 CP对免疫抑制小鼠净体质量增率及免疫器官指数的影响
胸腺和脾脏是机体的主要免疫器官,胸腺指数和脾脏指数反映了机体的非特异性免疫情况[21]。因此,药物对胸腺指数和脾脏指数的影响可作为研究动物模型免疫药理学机制的初步指标[22]。环磷酰胺能够抑制淋巴细胞的分化,减少免疫器官中淋巴细胞的数量,导致脾脏、胸腺和身体重量的减少[1]。由图1A可知,与空白组相比,模型组小鼠的净体质量增率极显著下降(P<0.01);而经CP处理后,低、中、高三个剂量组小鼠净体质量增率与模型组相比均上升,且呈一定的剂量依赖性。由图1B可知,与模型组相比,CP中、高剂量组和药物组显著提高了脾脏指数(P<0.05),而CP低剂量组差异不明显。由图1C可知,与模型组相比,CP高剂量处理组和药物组显著提高了胸腺指数(P<0.05),而CP低、中剂量组虽然提高了胸腺指数,但不存在显著差异。 结果表明,CP高剂量组能够改善环磷酰胺引起的小鼠免疫器官的萎缩,对免疫器官有明显的免疫增强作用。
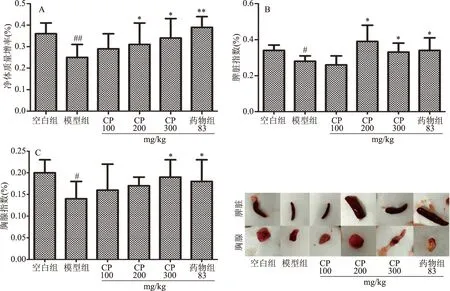
图1 CP对免疫抑制小鼠净体质量增率、脾脏指数和胸腺指数的作用Fig.1 Effect of CP on net mass increase,spleen index and thymus index in immunosuppressed mice注:与模型组相比,*表示差异显著(P<0.05),**表示差异极显著(P<0.01);ns表示与模型组相比差异不显著; 与空白组相比,#表示差异显著(P<0.05);##表示差异极显著(P<0.05)。图2~图6同。
2.2 CP对免疫抑制小鼠全血红细胞和白细胞指标的影响
机体血液中的红细胞具有识别携带抗原,清除循环中免疫复合物,增强T细胞依赖反应,效应细胞样作用,促进吞噬作用以及参与相关的免疫调控过程,是机体免疫系统中的重要组成部分[23]。机体血液中的白细胞包括粒细胞(中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞)、单核细胞和淋巴细胞。白细胞主要功能是防卫作用。当病菌侵入人体体内时,白细胞能通过变形而穿过毛细血管壁,集中到病菌入侵部位,将病菌包围﹑吞噬,白细胞数量的变化能影响机体的免疫力[23]。因此,检测动物外周血红细胞和白细胞数量变化能说明机体的免疫功能。同时,环磷酰胺是临床上常用的细胞毒性化疗药物,对骨髓和免疫力具有抑制作用,可以导致血小板和白细胞的降低。由图2可知,模型组的红细胞显著低于空白组(P<0.05),白细胞水平极显著低于空白组(P<0.05);与模型组相比,CP各剂量组和药物组均能提高机体中红细胞和白细胞的水平,其中CP高剂量组和药物组能显著提高红细胞和白细胞水平(P<0.05)。结果表明,CP高剂量组能够增加经环磷酰胺处理的免疫抑制小鼠中红细胞和白细胞的数量,具有恢复免疫抑制小鼠的免疫活性。
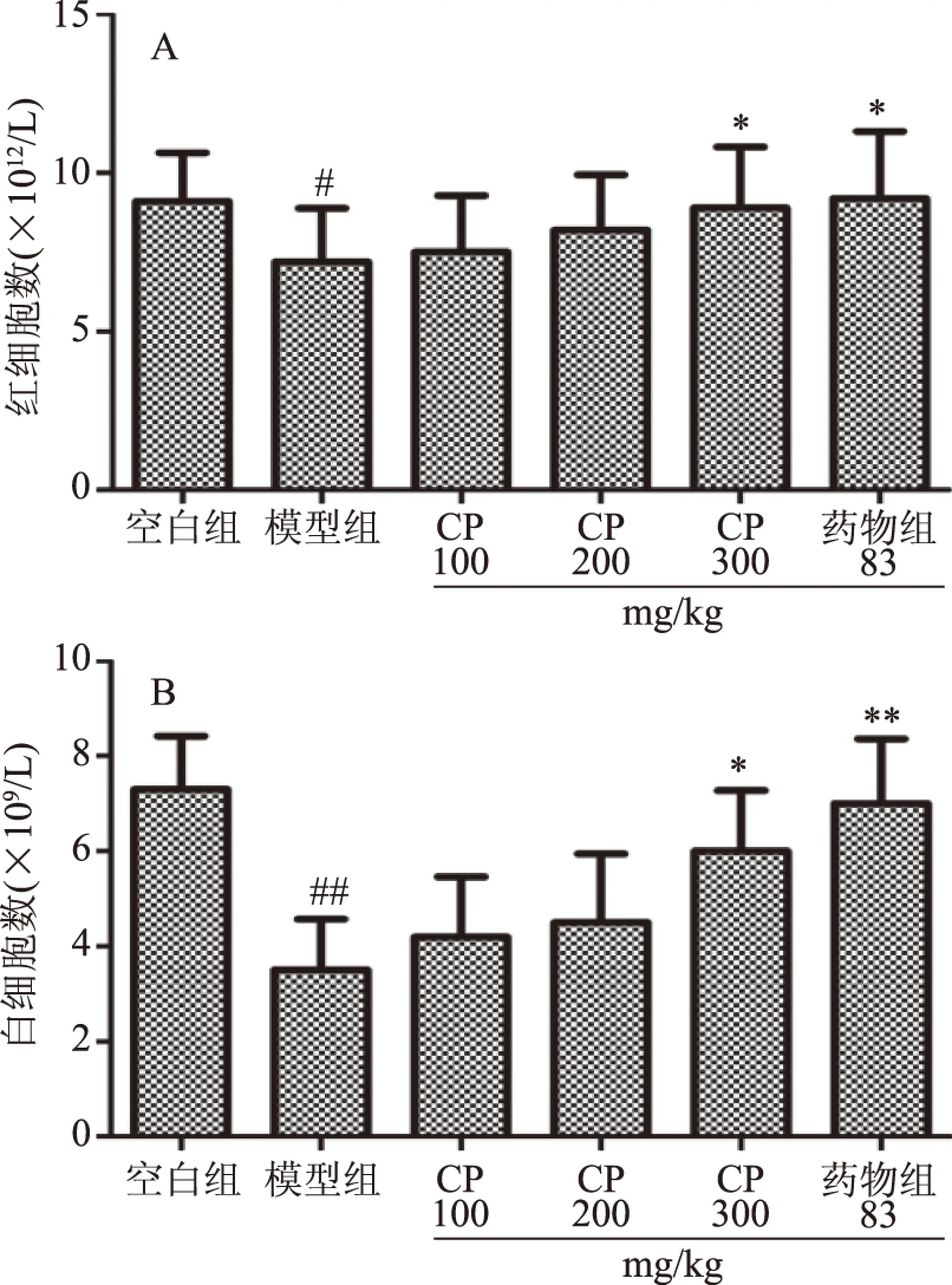
图2 CP对免疫抑制小鼠红细胞和白细胞的影响Fig.2 Effect of CP on red blood cell and white blood cell in immunosuppressed mice
2.3 CP对免疫抑制小鼠血清IL-2、IL-6以及TNF-α水平的影响
在免疫损伤的发生过程中,机体会产生一系列的炎症反应,贯穿着促炎因子和抗炎因子的相互作用[24]。IL-2是体内重要的抗炎因子,而IL-6和TNF-α是体内重要的促炎因子。IL-2又名T细胞生长因子,能够促进T细胞增长、诱导干扰素产生、增加细胞增殖和分化的细胞因子以及参加自身免疫性反应的过程[25]。因此,机体中IL-2水平的高低能从一定程度反映出机体免疫力的强弱,在免疫应答中起着很重要的作用。环磷酰胺等免疫抑制剂能抑制IL-2的活性和生成。促炎症因子IL-6是一种可刺激巨核细胞和巨噬细胞的增殖,可诱导单核细胞趋化蛋白-1的产生及内皮细胞表面粘附分子的表达,从而增强炎症部位细胞的迁移,加剧炎症反应[26]。促炎因子TNF-α是由单核-巨噬细胞或其他多种细胞产生的促炎因子,其有双重的生物学活性,一方面能在机体生理功能、免疫调节以及抗肿瘤等方面有重要作用,另一方面也能参与休克等疾病过程的发生与发展。由图3A可知,模型组小鼠的抗炎因子IL-2水平极显著低于空白组(P<0.01),而促炎因子IL-6和TNF-α含量分别显著(P<0.05)、极显著(P<0.01)高于空白组;另外,与模型组相比,CP各剂量组均能提高IL-2的含量,降低IL-6和TNF-α的含量,其中,CP高剂量组和药物组能显著提高因环磷酰胺导致的抗炎因子IL-2含量的降低,显著降低因环磷酰胺导致的促炎因子IL-6和TNF-α含量的提高(P<0.05)。结果表明,CP高剂量组可以调节小鼠血清中抗炎因子和促炎因子含量,从而发挥免疫调节作用。

图3 CP对免疫抑制小鼠血清IL-2、 IL-6以及TNF-α水平的影响Fig.3 Effect of CP on serum IL-2,IL-6 and TNF-α levels in immunosuppressed mice
2.4 CP对免疫抑制小鼠迟发型变态反应的影响
迟发型超敏反应(DTH)是细胞介导的免疫在T活化和细胞因子释放中的重要表现,可通过小鼠足跖肿胀来测量细胞免疫功能[27]。由图4可知,与空白组相比,模型组的小鼠足跖厚度差显著降低(P<0.05);CP中、高剂量组与模型组相比足跖厚度差显著升高(P<0.05),其中CP中剂量组足跖厚度略高于CP高剂量组,究其原因,可能是个别小鼠对SRBC敏感性不够;CP低剂量组虽升高,但与模型组相比未显示出明显的升高;药物组与模型组相比足跖厚度差极显著升高(P<0.01)。结果表明,CP中、高剂量组明显加重小鼠足跖肿胀的差异,以激活机体T细胞参与的相关免疫反应,进一步促进迟发型超敏反应,提高免疫应答,对动物体特异性的细胞的免疫功能有一定的增强作用,也表明CP的免疫调节活性可能与细胞免疫有关。
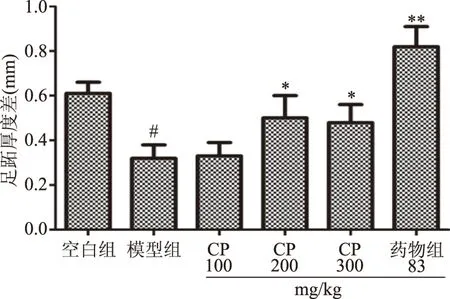
图4 CP对免疫抑制小鼠迟发型变态反应的影响Fig.4 Effect of CP on delayed type hypersensitivity in immunosuppressed mice
2.5 CP对免疫抑制小鼠血清溶血素的影响
血清溶血素是体液免疫中重要的指标之一,由于机体B细胞受到抗原刺激后产生相应抗体,该水平反映了抗体生成量的高低。正常的细胞受到鸡红细胞等致敏免疫之后,能产生抗鸡红细胞抗体(溶血素),实验可检测样品上清液的吸光度OD值,从而间接判断血清抗体生成数量,其中OD值越大,则表明机体产生的抗体数量越多[19]。由图5可知,与空白组相比,模型组血清溶血素水平极显著降低(P<0.01);与模型组相比,药物组和CP高剂量组均能显著提高血清溶血素的水平(P<0.05),CP低、中剂量组虽然能够提高血清溶血素水平,但不具有显著差异。结果表明,CP高剂量组对免疫抑制小鼠的体液免疫功能有一定的增强作用。
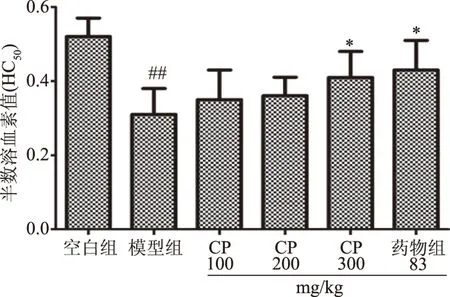
图5 CP对免疫抑制小鼠血清溶血素的影响Fig.5 Effect of CP on serum hemolysin in immunosuppressed mice
2.6 CP对免疫抑制小鼠腹腔巨噬细胞功能的影响
巨噬细胞是一种多功能免疫细胞,在机体非特异性免疫反应中发挥重要作用。活化的巨噬细胞表现出强的吞噬能力并能分泌大量介质,如IL-2、IL-18、TNF、NO等细胞因子及信号分子,从而发挥抗病毒、抗微生物、抗肿瘤等作用。巨噬细胞功能的强弱能反映机体非特异性免疫能力的状态,因而巨噬细胞功能检测被广泛地运用于临床研究和体外评价某些药物对机体的免疫调节作用[28]。由图6可知,与空白组相比,模型组小鼠巨噬细胞吞噬能力明显减弱,吞噬率和吞噬指数显著降低(P<0.05)。与模型组相比,药物组和CP组均能够提高免疫抑制小鼠巨噬细胞的吞噬能力,其中药物组能极显著提高免疫抑制小鼠巨噬细胞的吞噬率和吞噬指数(P<0.01),CP中、高剂量组也可以显著提高免疫抑制小鼠巨噬细胞的吞噬率(P<0.05),CP各剂量组均能显著提高免疫抑制小鼠巨噬细胞的吞噬指数(P>0.05)。结果表明,CP具有激活、增强免疫抑制小鼠巨噬细胞吞噬异物的能力,促进免疫抑制小鼠的非特异性免疫功能。

图6 CP对免疫抑制小鼠腹腔巨噬细胞功能的影响Fig.6 Effect of CP on peritoneal macrophage function in immunosuppressed mice注:白细箭头所指为鸡红细胞;红中箭头所指为巨噬细胞; 黄粗箭头所指为吞噬了鸡红细胞的巨噬细胞。
3 结论
本研究以环磷酰胺诱导的免疫抑制小鼠为模型,探讨菊苣多糖提高免疫活性的功能,得出以下结论:CP中、高剂量组对免疫抑制小鼠的净体重增率、胸腺指数、脾脏指数、吞噬率和吞噬指数均有增强作用,说明CP对免疫抑制小鼠的非特异性免疫功能有保护作用。CP高剂量组能够提高免疫抑制小鼠全血中红细胞和白细胞数量,血清溶血素水平和迟发型超敏反应,说明CP对免疫抑制小鼠的体液免疫和细胞免疫有一定的促进作用。CP高剂量组对免疫抑制小鼠IL-2、IL-6和TNF-α水平有调节作用,使它们趋于正常水平,说明CP对免疫抑制小鼠的细胞免疫功能有一定的提高作用。综上所述,CP对环磷酰胺诱导的免疫抑制小鼠的免疫功能有增强作用。
