响应面法优化微波提取枇杷花槲皮素工艺及其对酒精分解关键酶活性的影响
2021-06-16马智宇李佳美范洪臣
徐 伟,马智宇,李佳美,陈 华,范洪臣,张 光
(1.哈尔滨商业大学食品工程学院,黑龙江哈尔滨 150076; 2.南通市天籁村农业科技发展有限公司,江苏海门 226100)
枇杷起源于中国,18世纪传入欧洲,19世纪传入北美洲,在我国主要分布在浙江、江苏、福建、四川等长江以南各省[1-2]。枇杷(EriobotryajaponicaLindl.)为蔷薇科枇杷属植物,枇杷花包括花及花蕾,花蕾被浅棕色或黄色绒毛,花味淡雅清香,花期长、花量大。枇杷树的 80%~90%枝条都可形成花穗,并且单支花穗上花朵数为70~260左右,其中仅有 5%~20%的花可结成果实,约30%~50% 的花穗因疏花保果而被浪费[3]。根据《本草纲目》记载,枇杷的叶、花等均可以入药[4],枇杷花富含类黄酮、类胡萝卜素、三萜类、挥发油、矿物质元素等营养成分,姜帆等[5]筛选国内外代表性枇杷种质55份,采用分光光度法测定花中黄酮含量,发现不同枇杷种质之间黄酮含有量范围在0.44%~2.28%之间,黄酮含量分布在0.98%~1.23%区间的种质较多。
黄酮类化合物有抗氧化以及对化学性肝损伤的辅助保护功能。天然黄酮类化合物主要分为:黄酮、黄酮醇、二氢黄酮、二氢黄酮醇、异黄酮等,槲皮素(Quercetin)是黄酮醇类化合物的一种,有抗氧化、抗炎、抗病毒、抗血栓等生物活性[6-7],可有效防治肝损伤,主要体现在抗氧化应激、促进抗氧化酶合成等方面[8-9],研究表明槲皮素可通过恢复 frataxin 蛋白表达水平拮抗酒精性肝线粒体损伤[10],以及降低自由基水平和促炎物质的释放水平等[11]。据研究可知,酒精进入人体后90%在肝脏内被代谢[12-15]。当血液中乙醇浓度不高时,乙醇在乙醇脱氢酶(ADH)催化下被氧化为乙醛;当乙醇浓度过高时,ADH代谢系统为乙醇的主要代谢途径,同时借助于过氧化氢酶(CAT)系统等进行代谢形成乙醛[16];乙醛在乙醛脱氢酶(ALDH)的作用下代谢成乙酸,乙酸分解为水和CO2后排出体外[17],故乙醇脱氢酶、乙醛脱氢酶、过氧化氢酶的活性对酒精分解起重要作用。
微波辅助提取法高效、环保[18],近年来在中草药成分提取中被广泛应用。基于单因素和响应面分析法,采用微波辅助优化枇杷花槲皮素提取工艺,并对其在体外酒精分解过程中关键酶的影响进行初步研究。目前市场上解酒护肝产品均以药类为主,本课题利用废弃的枇杷花资源研究开发解酒护肝辅助食品,有广阔的市场空间,为枇杷花的高值化利用提供参考。
1 材料与方法
1.1 材料与仪器
枇杷花 江苏省海门市天籁村古枇杷园;无水乙醇、乙醛 分析纯,天津市津东天正精细化学试剂厂;槲皮素 色谱纯,阿拉丁试剂公司;溴化钾 光谱纯,青岛青药生物工程有限公司;HP20型大孔吸附树脂 山东摩尔化工有限公司;乙醇脱氢酶(ADH)、乙醛脱氢酶(ADH)、氧化型辅酶I(NAD+) 纯度≥98%,美国Sigma公司;过氧化氢酶(CAT) 北京博奥拓达科技有限公司。
HX-MC-1实验室微波合成仪 北京祥鹄科技发展有限公司;723N UV5100型紫外可见分光光度计 上海精密科学仪器有限公司;FT-IRC97951傅立叶变换红外光谱仪 Sartorius公司;VERSA max酶标仪(配有SoftMax Pro标准化数据分析和仪器控制软件) Molecular Devices公司;3590酶标板 美国Corning公司。
1.2 实验方法
1.2.1 微波辅助提取枇杷花槲皮素工艺 枇杷花自然风干至恒重,粉碎过60目筛备用。精确称取2 g枇杷花粉末于三口烧瓶中,将三口烧瓶及冷凝装置安装至微波合成仪中,加入适当浓度的乙醇溶液在一定微波功率下提取,静置冷却,真空抽滤得到含有槲皮素的枇杷花提取液。通过预实验确定溶剂乙醇浓度为60%,设定温度为固定值60 ℃。
1.2.2 单因素实验
1.2.2.1 料液比对槲皮素提取量的影响 称取2 g枇杷花粉末,按照料液比(1∶5、1∶10、1∶15、1∶20、1∶25 (g/mL)),在微波功率600 W,微波时间25 min条件下提取,静置冷却,真空抽滤备用,研究料液比对槲皮素提取量的影响。
1.2.2.2 微波时间对槲皮素提取量的影响 称取2 g枇杷花粉末,按照微波时间(10、15、20、25、30 min),在料液比1∶10 (g/mL),微波功率600 W条件下提取,静置冷却,真空抽滤备用,研究微波时间对槲皮素提取量的影响。
1.2.2.3 微波功率对槲皮素提取量的影响 称取2 g枇杷花粉末,按照微波功率(300、400、500、600、700 W),在料液比1∶10 (g/mL),微波时间25 min条件下提取,静置冷却,真空抽滤备用,研究微波功率对槲皮素提取量的影响。
1.2.3 响应面优化实验 在单因素实验的基础上采用Box-Behnken组合设计,以枇杷花槲皮素提取量为响应值进行提取条件优化,见表1。
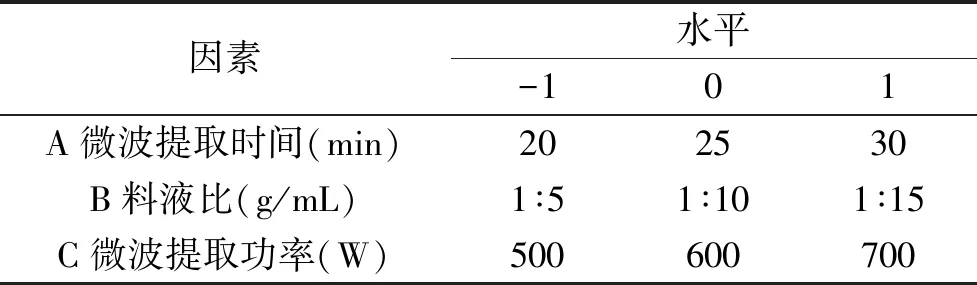
表1 响应面试验因素水平表Table 1 Factors and levelsTable of response surface experiments
1.2.4 枇杷花槲皮素提取量的测定 精确称取槲皮素标准品10 mg,使用60%乙醇定容至50 mL,得到浓度为0.2 mg/mL的槲皮素溶液,分别取2、3、4、5、6、7 mL至100 mL容量瓶中,60%乙醇定容。在波长374 nm处,使用紫外分光光度法测量槲皮素质量浓度(y)与吸光度(x)之间的关系,得到方程y=0.0161x+0.0006(R2=0.9994),槲皮素含量在4~14 μg/mL之间线性关系良好。
将微波提取得到的枇杷花槲皮素提取液,离心取1 mL清液以60%乙醇稀释100倍,以乙醇作为空白对照组进行校正,于波长375 nm下测定吸光度,试验测定3次,对所得结果取平均值。枇杷花槲皮素提取量计算公式如下:
式中:m为根据标准曲线计算得出的槲皮素质量浓度(mg/mL);V为提取液即溶剂的体积(mL);N为稀释倍数;M为枇杷花粉取样量(g)。
1.2.5 枇杷花槲皮素的分离纯化及红外光谱分析 将枇杷花槲皮素提取物经减压浓缩至体积恒定,约为原体积的15%,使用60%乙醇溶液稀释浓度至0.2 mg/mL,取50 mL为上样溶液,调至 pH=8,称取预处理过的HP-20型树脂10 g,湿法装柱,以上样流速为2 mL/min过HP-20型树脂进行富集纯化,使用95%乙醇洗脱,洗脱流速为2 mL/min,收集洗脱液,旋转蒸发至无醇味,进行真空冷冻干燥(真空度-0.8 MPa,温度-80 ℃)后使用研钵研磨成粉末。使用KBr压片法进行红外光谱分析。
1.2.6 枇杷花槲皮素对体外解酒过程中关键酶的活性影响实验
1.2.6.1 ADH激活率的测定 体外测定在瓦勒-霍赫法(Valle & Hoch)[19]基础上稍作改动。在96孔板中分别依次加入75 μL pH为8.8的焦磷酸钠缓冲溶液、50 μL的27 mmol/L氧化型辅酶I溶液(NAD+)、25 μL的12%体积比的乙醇溶液为底物溶液,两个样品组分别添加1.0 mg/mL枇杷花槲皮素溶液和槲皮素标准溶液10 μL。对照组用10 μL蒸馏水代替枇杷花槲皮素溶液;空白组用25 μL蒸馏水代替11.5%的乙醇溶液,10 μL蒸馏水代替枇杷花槲皮素溶液;其他条件相同。混合后密封于25 ℃水浴5 min。然后立即加入0.3 U/mL的ADH溶液5 μL并摇匀,于340 nm处每10 s记录一次吸光度值,连续测定5 min。
ADH酶活的计算公式如下:
式中:E-ADH 酶活力(U/mL),A-吸光度每分钟的增大值,V-反应液的总体积(mL),EW-加入的ADH酶液活性(U/mL),6.22-NADH在340 nm下的摩尔消光系数,Q-ADH的激活率(%),E0-空白组酶活力。
1.2.6.2 ALDH激活率的测定 在96孔板中分别依次加入30 μL的pH为8.0的磷酸钠缓冲液、200 μL的氧化型辅酶I溶液(NAD+)、10 μL底物溶液;两个样品组分别添加1.0 mg/mL枇杷花槲皮素溶液和槲皮素标准溶液2 μL后加入2 μL ALDH酶溶液,25 ℃保温5 min。对照组用2 μL蒸馏水代替枇杷花槲皮素溶液;空白组用10 μL蒸馏水代替底物溶液;2 μL蒸馏水代替枇杷花槲皮素溶液;其他条件相同。混合后密封于25 ℃水浴5 min。然后立即加入0.3 U/mL的ALDH溶液2 μL,摇匀后于340 nm每10 s记录一次吸光度值,连续测定5 min。计算方法同1.2.5.1。
1.2.6.3 CAT激活率的测定 具塞试管中分别依次加入0.4 mL的pH为7.4的钠-钾磷酸盐缓冲液、2 mL的65 μmol/L的H2O2底物溶液,37 ℃温育5 min,0.4 mL的CAT酶溶液[20],37 ℃准确温育60 s后加入枇杷花槲皮素溶液和钼酸铵溶液;其中标准品对照组使用槲皮素标准溶液代替枇杷花槲皮素溶液;空白组用蒸馏水代替枇杷花槲皮素溶液;空白二组用蒸馏水代替底物溶液,室温10 min后测定405 nm下吸光度值。
CAT酶活的计算公式如下:
式中:E-CAT酶活力(U/mL),A-样液吸光度每分钟的增大值,A0-空白组吸光度每分钟的增大值,A2-空白二组吸光度每分钟的增大值,Q-CAT 的激活率(%),E0-空白组酶活力。
1.3 数据处理
采用Excel 2016和SPSS软件进行单因素实验数据处理,Design-Expert 8.0.6软件进行响应面优化试验设计及分析。
2 结果与分析
2.1 单因素实验
2.1.1 料液比对枇杷花槲皮素提取量的影响 料液比对枇杷花槲皮素提取量的影响见图1。由图1可知,枇杷花槲皮素的提取量随提取溶剂比例的增大而增大,当料液比为1∶10 (g/mL)时,枇杷花槲皮素的提取量到达了最高值6.831 mg/g,可能是由于此时提取溶剂与枇杷花细胞已经充分接触[21],槲皮素浸出基本达到最大值;当溶剂的比例继续增大时,枇杷花槲皮素的提取量降低,因此确定料液比为1∶10 (g/mL)。
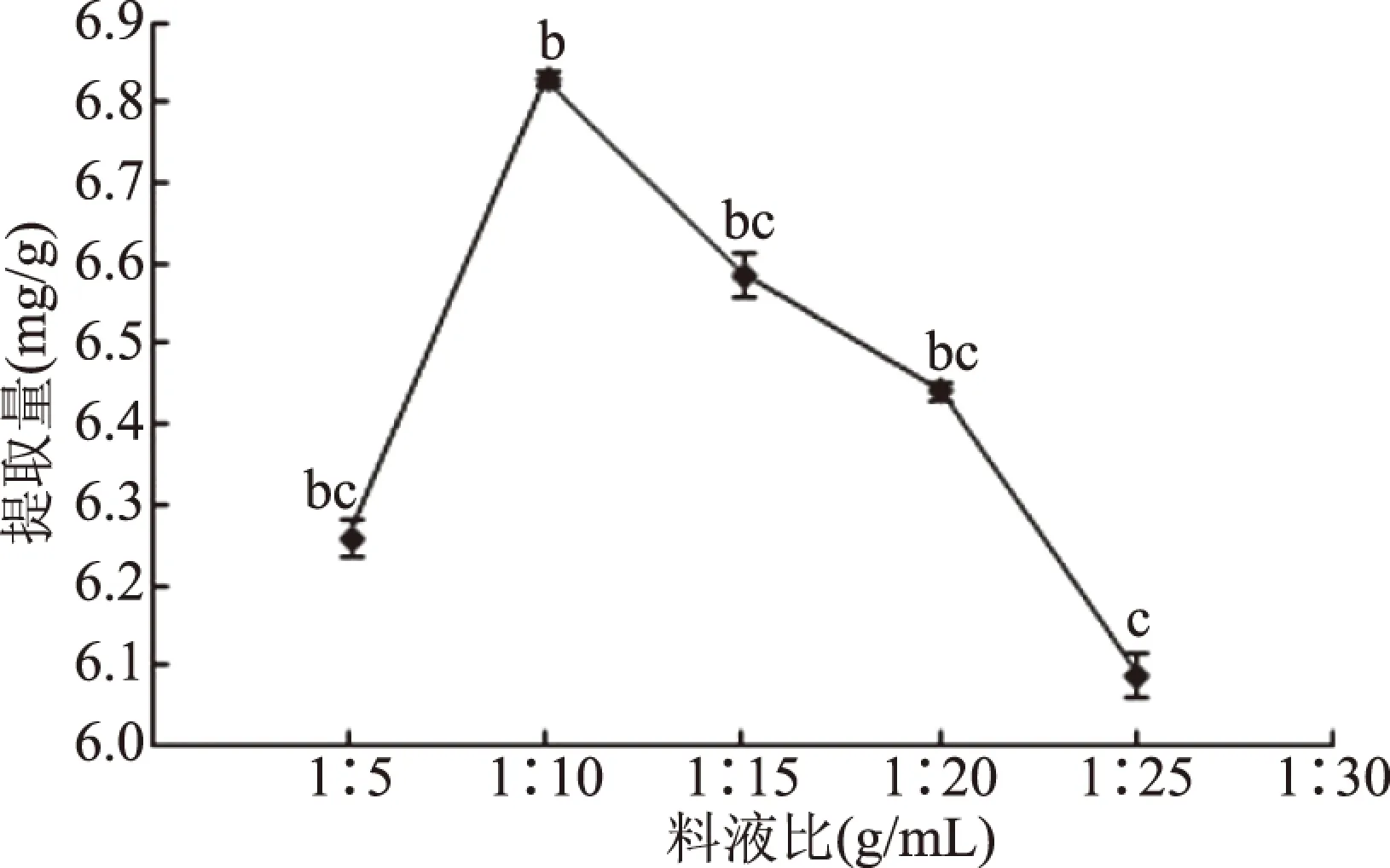
图1 料液比对枇杷花槲皮素提取量的影响Fig.1 Effect of solid-to-liquid ratio on the extraction yield of quercetin注:不同小写字母代表差异显著(P<0.05);图2~图3同。
2.1.2 微波提取时间对枇杷花槲皮素提取量的影响 微波提取时间对枇杷花槲皮素提取量的影响见图2。当提取时间在10~20 min范围内,枇杷花槲皮素提取量逐渐增大,20~25 min时枇杷花槲皮素提取量增加幅度大,提取时间为25 min时枇杷花槲皮素提取量出现最大值;提取时间为25~30 min时枇杷花槲皮素提取量无明显变化,可能是因为槲皮素经长时间的高温浸泡,分子结构遭到破坏,杂质溶出,体系黏度增加[22]。因此,提取量近似时,在节省溶剂的前提下确定25 min为最佳提取时间。
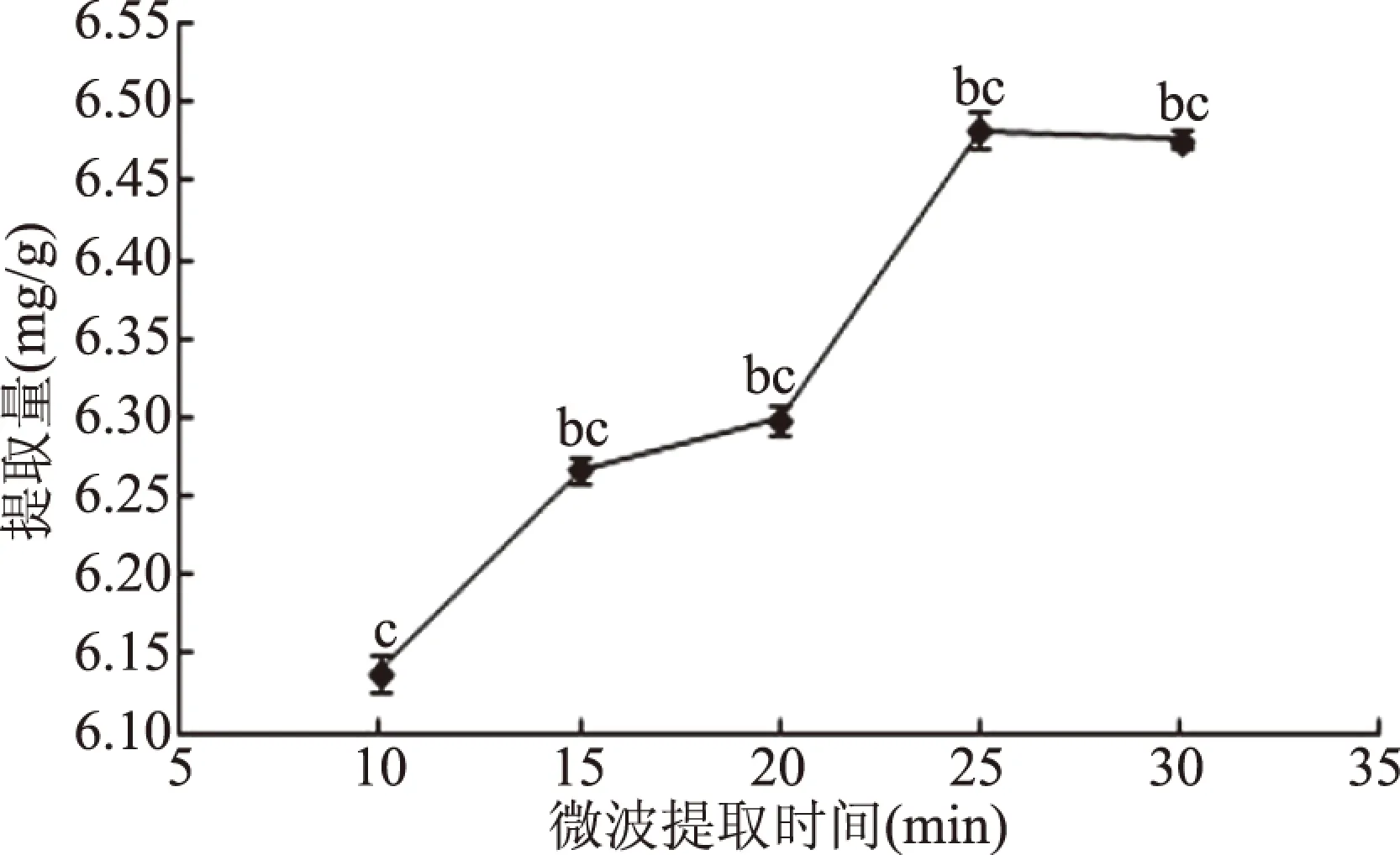
图2 微波提取时间对枇杷花槲皮素提取量的影响Fig.2 Effect of time on the extraction yield of quercetin
2.1.3 微波功率对枇杷花槲皮素提取量的影响 微波功率对枇杷花槲皮素提取量的影响见图3。随着微波功率增加,槲皮素提取量逐渐增加,在微波功率600 W时,槲皮素提取量达到最高值,功率越高,萃取时溶剂扩散速度越快,温度升高,对枇杷花细胞的破坏作用越大,有利于槲皮素溶出,功率与提取量呈线性正相关;随着微波功率增加,提取量略有降低,这
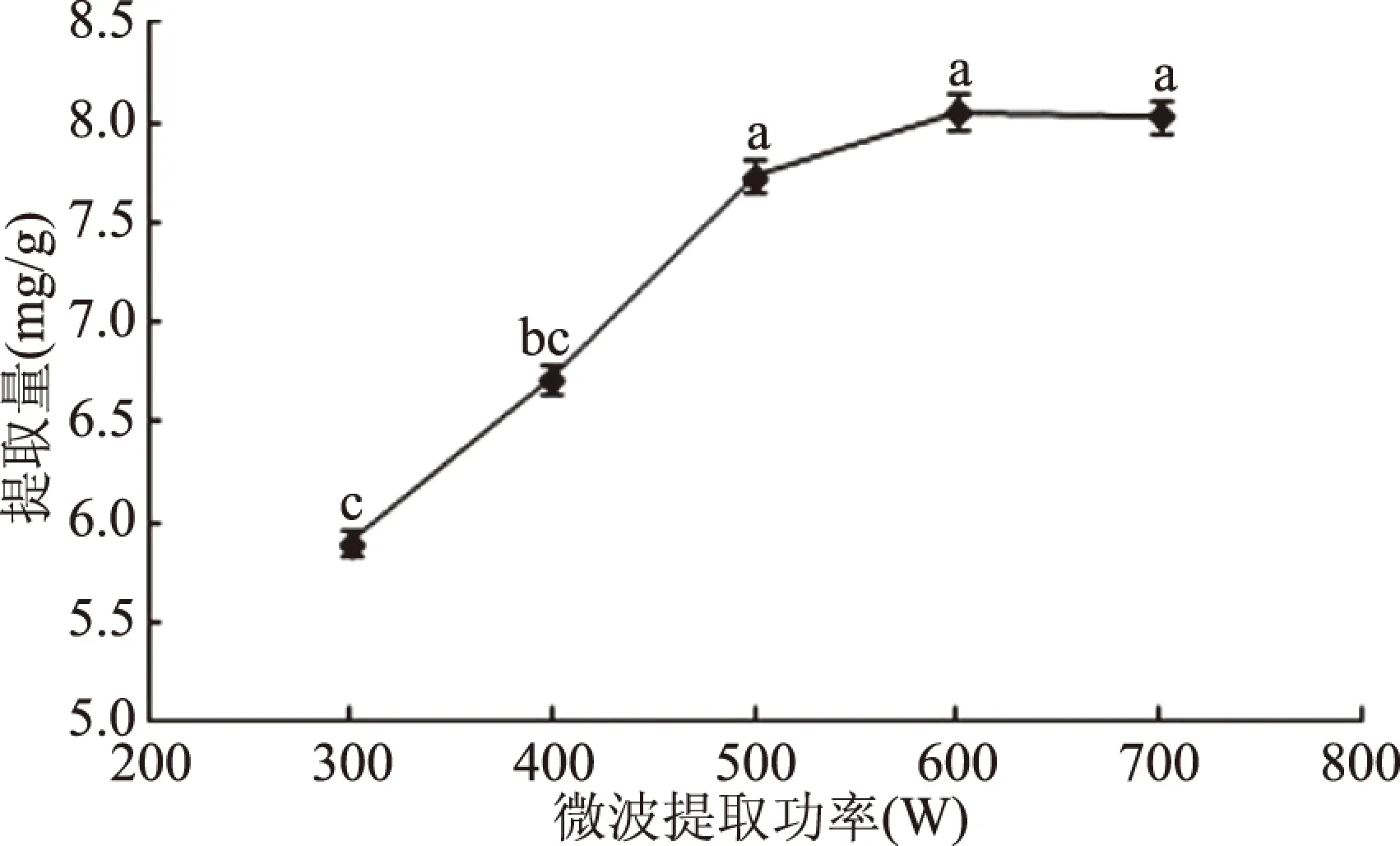
图3 微波功率对枇杷花槲皮素提取量的影响Fig.3 Effect of microwave power on the extraction yield of quercetin
可能是由于此时槲皮素分子的溶出基本达到最大值,溶出与扩散的速率和量已基本达到平衡[23]。从节能和提取效率等因素综合考虑,选择600 W为最佳提取功率。
2.2 响应面优化实验结果与分析
响应面优化实验设计及结果见表2,分析实验结果得回归方程为:Y=8.17-0.42A+0.39B+0.48C-0.22AB+0.16AC+0.45BC-1.27A2-0.12B2-0.62C2。
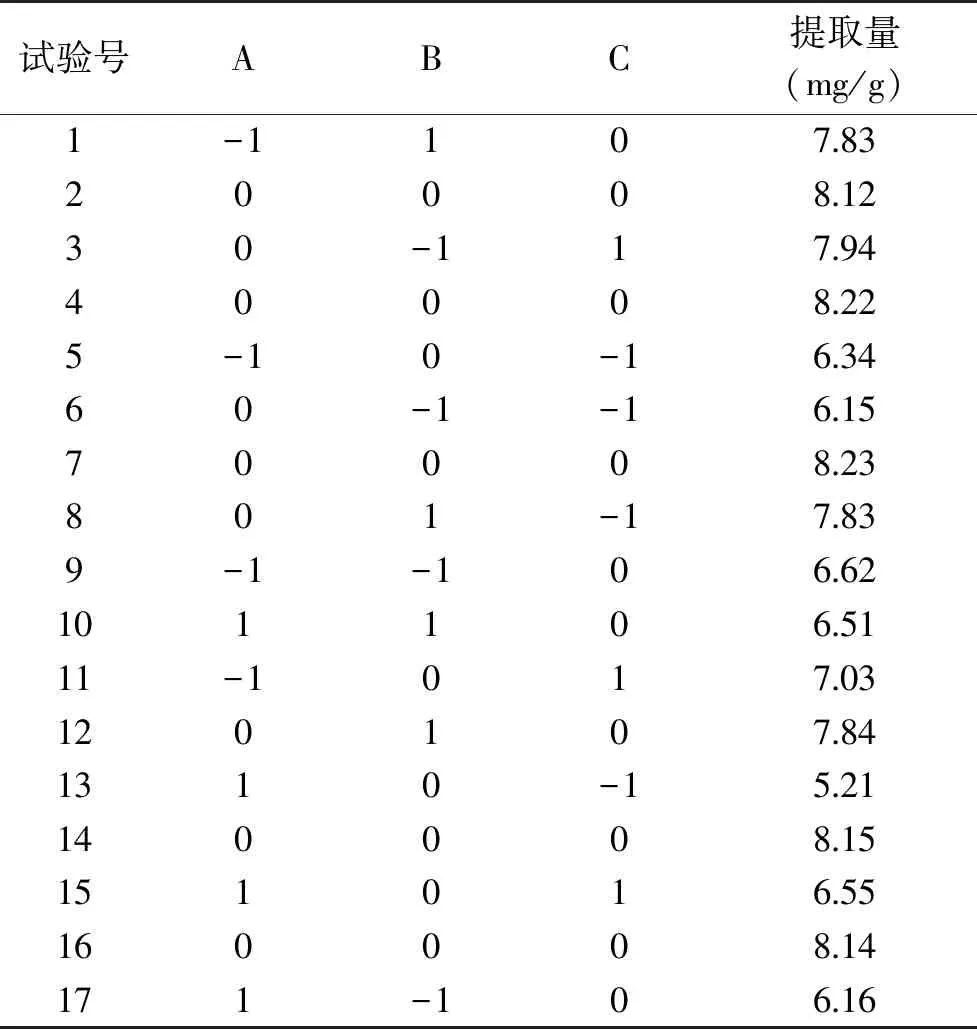
表2 响应面试验设计及结果Table 2 Response surface experiments design and results
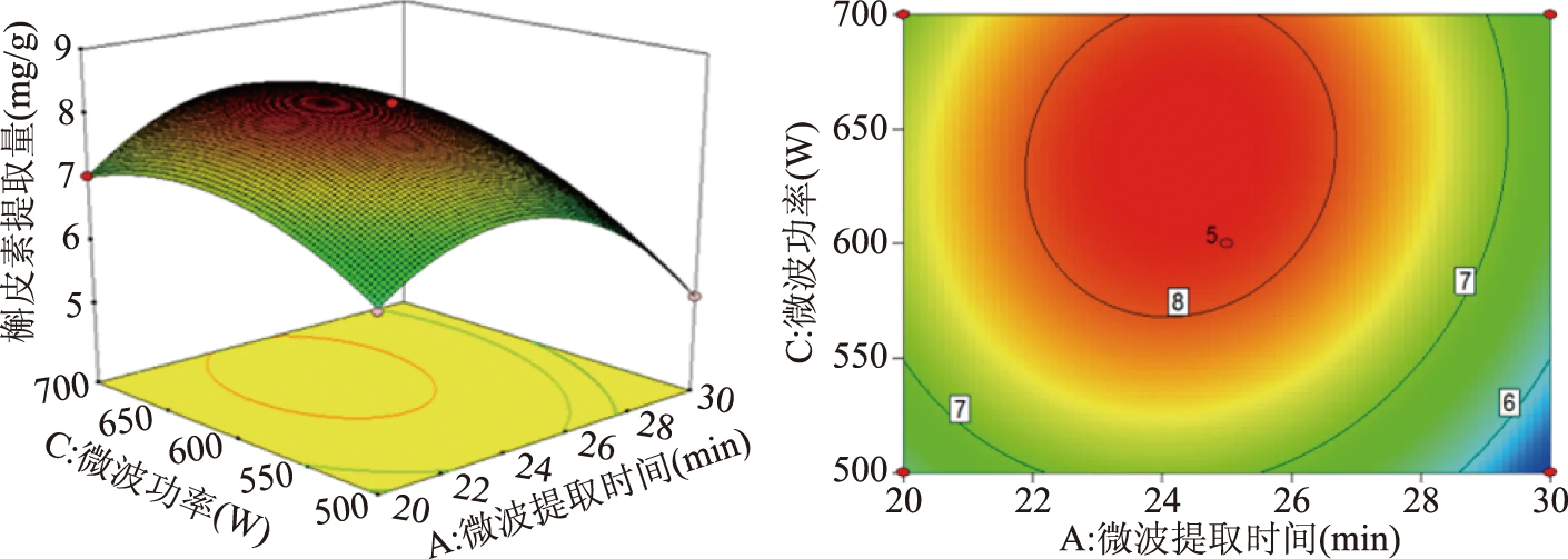
图5 微波提取时间和功率对槲皮素提取量影响的响应面图Fig.5 Plots for the effects of time and microwave power on the yield of quercetin
2.2.1 方差分析及显著性检验 方差分析及显著性检验结果见表 3。可以看出该模型回归极显著,失拟项不显著,决定系数R2=0.9986,说明该模型能解释99.86%的响应值变化,因而该模型拟合程度比较好,可以用此模型对槲皮素提取进行分析和预测,建模成功。各因素对枇杷花槲皮素提取量的影响从大到小依次为:C微波提取功率(W)>A微波提取时间(min)>B料液比(g/mL)。
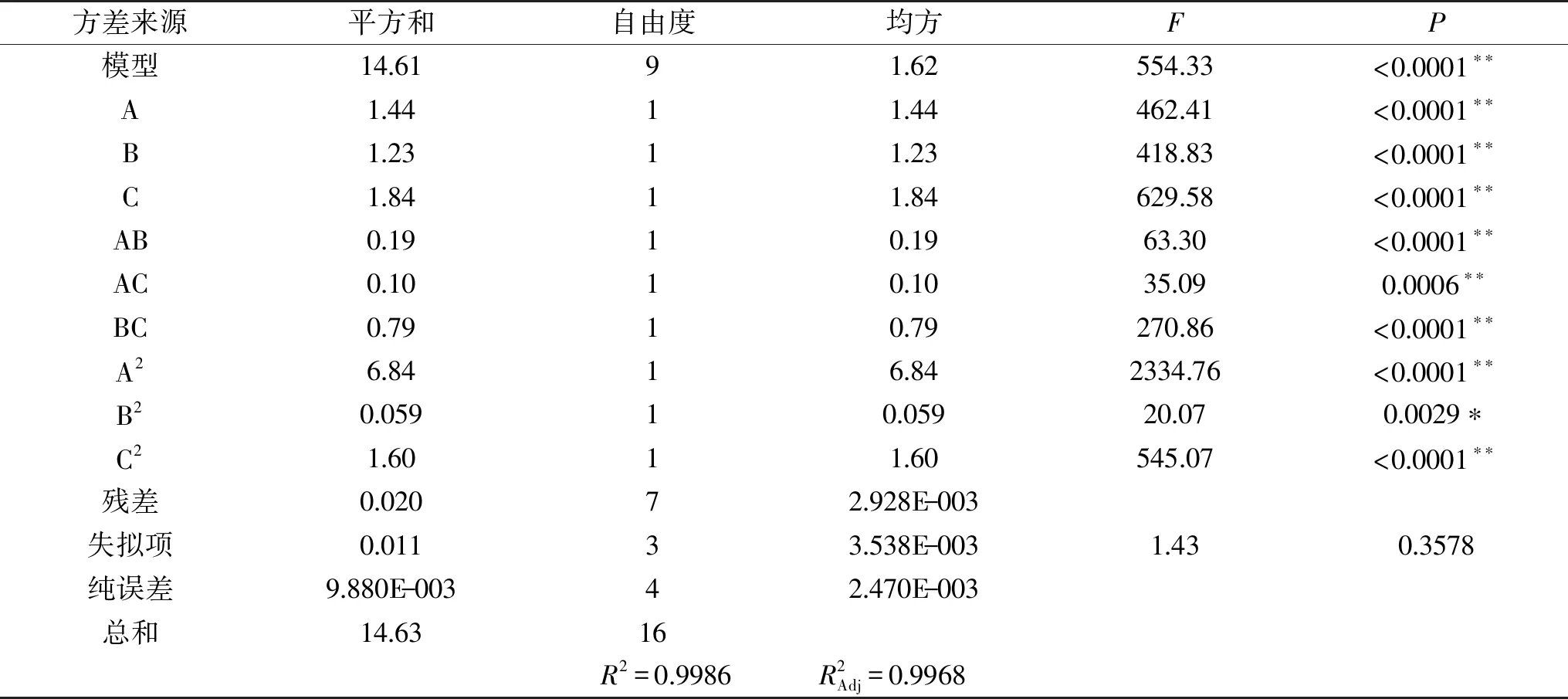
表3 方差分析及显著性检验结果Table 3 Analysis of variance and significance test of the regression model
2.2.2 因素交互作用分析 交互作用对槲皮素提取量的影响见图4~图6。固定微波功率,随着微波提取时间和液固比的增大,槲皮素提取量有先增大后减小的趋势。固定料液比,随着微波提取时间和功率的增大,槲皮素提取量有先增大后减小的趋势。固定提取时间,槲皮素提取量随着功率和液固比的增大呈先升高再降低的趋势;曲面坡度陡峭程度明显。

图4 微波提取时间和液固比对槲皮素提取量的影响Fig.4 Plots for the effects of time and liquid/solid ratio on the yield of quercetin
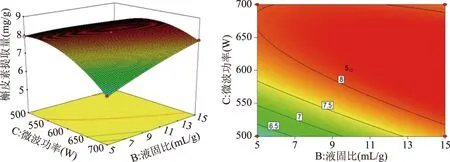
图6 微波功率和液固比对槲皮素提取量影响的响应面图Fig.6 Plots for the effects of microwave power and liquid/solid ratio on the yield of quercetin
响应面优化分析得到的最优条件为:微波提取时间23.49 min、微波提取功率603.93 W、液固比12.64 mL/g,在此条件下模型预测槲皮素提取量为8.29 mg/g;考虑到实际操作,以上条件优化为:微波提取时间25 min、微波提取功率600 W、料液比1∶15 g/mL;在此条件下进行三次平行实验,平均提取量为8.26 mg/g,与预测值接近。
2.3 枇杷花槲皮素提取物的红外光谱分析
经过HP-20型树脂纯化后的枇杷花槲皮素(纯度为64.87%)经过真空冷冻干燥后制成粉末,使用KBr压片法进行红外光谱分析。
红外光谱分析结果见图7。1663 cm-1处出现C=O拉伸振动峰,1611 cm-1处出现苯环骨架C=C伸缩振动吸收峰,1382 cm-1处出现C-OH羟基面内弯曲振动峰,以上均为槲皮素分子官能团的主要吸收峰,可初步推测提取物中含有槲皮素单体[26]。
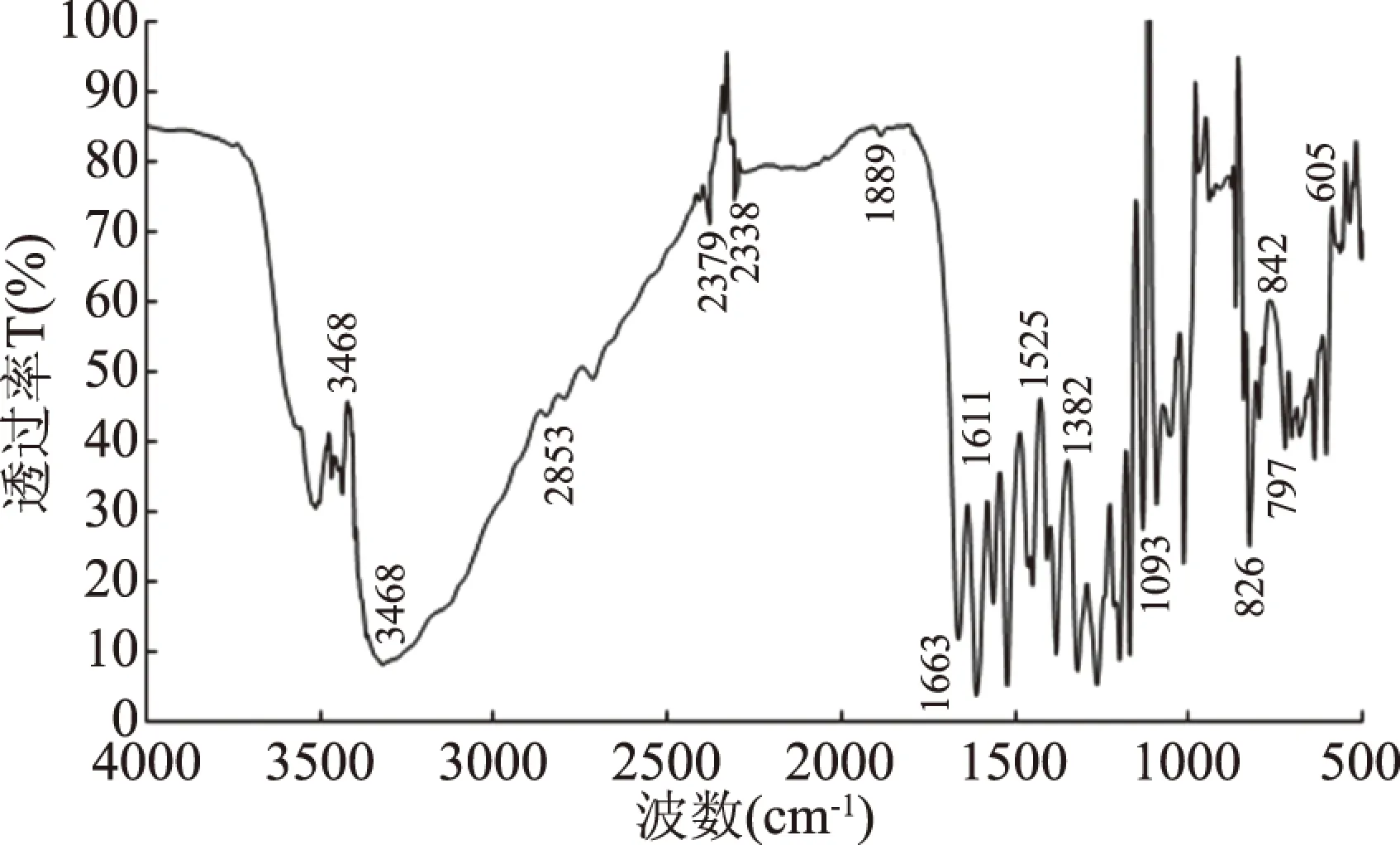
图7 枇杷花槲皮素提取物的红外光谱Fig.7 Infrared spectra of quercetin extract from loquat flower
此外,3336~3468 cm-1出现较宽较强的吸收峰,是羟基的伸缩振动峰,表明存在较大量的酚羟基或糖上的羟基;在2853 cm-1出现-CH2的伸缩振动,吸收峰的强度较小,说明饱和碳上的氢较少;1525 cm-1处有吸收峰,处于红外光谱图的第三、四峰区,表征为苯环的伸缩振动,说明芳环结构的存在;在1093 cm-1左右出现较强吸收峰,是C-O的伸缩振动峰;综上,初步推测枇杷花槲皮素提取物中含有槲皮素等黄酮醇单体存在。
2.4 体外解酒酶活实验结果分析
实验结果见表4。实验重复三次,结果取平均值。采取槲皮素标准品进行对照实验,探究枇杷花槲皮素对酒精分解中关键酶的激活率。实验结果表明,纯化后的枇杷花槲皮素提取物对解酒过程中三种关键酶ADH、ALDH、CAT的活性均有一定提高,激活率分别为:24.83%、29.18%、22.36%。枇杷花槲皮素有助于酒精分解,其降低乙醇浓度的机制之一是通过提高ADH、ALDH、CAT的活性,加速乙醇和乙醛的分解;现有研究表明,葛花人参合煎液对ADH的激活率为21.3%,其中葛花中含有槲皮素及多种化合物[27];非水相中制备的玉米肽在体外试验中对ADH 激活率为27.1%,ALDH 激活率为 50.0%[28];枇杷花槲皮素对ADH的激活率较低,这可能是由于枇杷花槲皮素成分较单一、含有一定杂质以及纯度不够高等原因造成的。
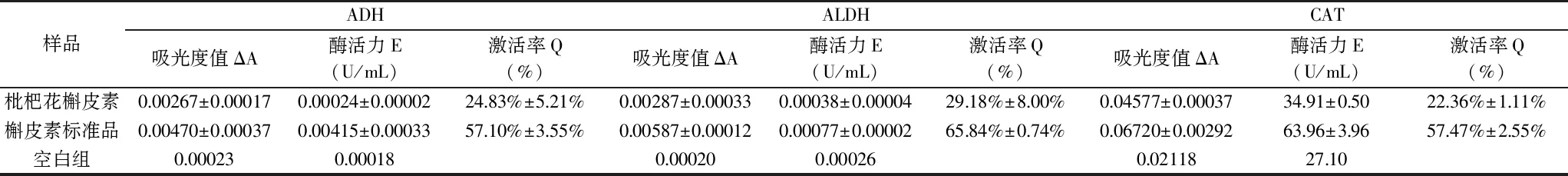
表4 枇杷花槲皮素对ADH、ALDH、CAT激活率的影响Table 4 Effects of quercetin from loquat flower on activation rates of ADH,ALDH and CAT
3 结论
通过单因素实验考察料液比、微波时间、微波功率对枇杷花槲皮素提取量的影响,响应面试验设计优化枇杷花槲皮素的最佳提取工艺,实验拟合性好,得到最佳提取工艺条件为微波提取时间25 min、微波提取功率600 W、料液比1∶15 g/mL;在该条件下枇杷花槲皮素的提取量为8.26 mg/g。HP-20型大孔树脂纯化后的枇杷花槲皮素提取物对解酒过程中三种关键酶ADH、ALDH、CAT的活性均有一定提高;激活率分别为:24.83%、29.18%、22.36%。枇杷花槲皮素的微波辅助提取可为废弃枇杷花资源化、高值化转化提供一定技术参考,同时也为开发解酒护肝辅助食品提供有效的生物活性物质,若能进一步提高枇杷花槲皮素纯度以及与其他产品进行复配等,该类产品将有广阔的应用价值及市场空间。
