番茄自然发酵液中酵母菌的分离鉴定及其特性研究
2021-06-16管庆林周笑犁耿瑞鸿
管庆林,周笑犁,赵 姗,耿瑞鸿
(贵阳学院食品与制药工程学院,贵州贵阳 550005)
番茄色泽鲜美酸甜可口、营养丰富,在我国是广大消费者日常最喜欢的果蔬之一,它可以抑制人体癌细胞的生长,对预防动脉硬化、冠心病和高血压具有极好的作用[1-2]。我国因独特的地理条件,现已成为世界第三大番茄产区,但其果实因含水量较高,易受致病菌的侵染导致腐败,不能长期贮藏,因此在现有番茄酱、番茄汁等产品的基础上亟需拓宽番茄的精深加工产品。果蔬酵素是以水果、蔬菜或其汁为原料,经微生物发酵制得的含有特定生物活性成分食用的酵素产品[3-4]。酵素在发酵中会经过一系列复杂的生物化学反应,不仅能保留原料中原有的营养物质,而且还能产生一些活性物质,具有解酒护肝、润通肠道、抗菌消炎、抗氧化及保健功能[5-7]。实验前期的研究结果表明,番茄经过自然发酵后,其抗氧化物质及其活性显著提高[8],并且对调节血糖关键酶之一的α-淀粉酶具有一定的抑制作用[9]。但目前酵素的生产主要以传统的发酵工艺为主[10],参与发酵菌种多、发酵时间长,导致了发酵过程难以控制[11],使得番茄等果蔬酵素工业化生产难以实现。
近年来,为缩短发酵周期,从果蔬自然发酵液中分离优势菌种成为了热点,如:凌空等[7]分别在6个月和18个月的果蔬酵素(苹果、香蕉、橙子、葡萄、鸭梨、木瓜、菠萝、山竹、李子、樱桃、草莓、西红柿、胡萝卜和柠檬)中分离得到毕赤酵母;刘灏[12]从西红柿酵素中分离得到的优势酵母为季也蒙毕赤酵母(Pichiaguilliermondii)和浅白隐球酵母(Cryptococcusalbidus);韦明明[13]从发酵番茄酸汤中分离出4株乳酸菌和2株酵母菌(东方伊萨酵母菌和毕赤酵母菌),也发现了这些酵母菌产香效果较好,可作为发酵的优良菌种。酵母菌作为果蔬发酵中的优势菌种之一,因缺少分解纤维素、蛋白质的酶系,能最大程度地保留发酵原料本身的色、香、味和口感[13];酵母菌分别在有氧、无氧条件下发酵产生有机酸和各种醇类物质,构成了产品风味的主要物质[13-15]。综上所述,酵母菌对发酵制品的风味形成和产品质量具有重要作用,从番茄自然发酵液中分离优势酵母菌可以在一定程度上促进番茄酵素的开发与应用。
本文以30 d番茄自然发酵液为原料,对其中的酵母菌进行分离、鉴定,并分析其生长特性及耐受特性,可为番茄酵素产品的开发提供菌种支持,同时对丰富酵母菌种类以及果蔬发酵剂的开发具有一定意义。
1 材料和方法
1.1 材料与仪器
新鲜无病害且果实饱满、色泽均匀的番茄 购于沃尔玛超市;酵母膏胨葡萄糖培养基(YPD培养基);10%HCl 分析纯,天津渤化化学试剂有限公司;无水乙醇 分析纯,天津市富宇精细化工有限公司;葡萄糖 分析纯,天津市科密欧化学试剂有限公司;真菌基因组DNA快速抽提试剂盒、Premix Taq酶 生工生物工程(上海)股份有限公司。
YXQ-LS-50SII立式高压灭菌锅 上海博讯实业有限公司医疗设备厂;SW-CJ-1G单人超净工作台 上海力辰邦西仪器科技有限公司;101-2电热鼓风干燥箱 天津市泰斯特仪器有限公司;DH5000BⅡ电热恒温培养箱 天津市泰斯特仪器有限公司;AUW120D电子分析天平 日本岛津公司;UV2700紫外分光光度计 日本岛津仪器有限公司;T100PCR扩增仪 美国BIO-RAD公司;DYY-8C型稳压稳流电泳仪 美国BIO-RAD公司;Bioradchemidoc XRS凝胶成像分析仪 美国BIO-RAD公司;CX21显微镜 上海泽仕光电科技有限公司。
1.2 实验方法
1.2.1 番茄自然发酵液的制备 采用新鲜番茄为试材,按番茄与白砂糖质量比3∶1混匀后置于1000 mL已灭菌的玻璃瓶中,封口,发酵初期每隔1 d通过排气阀排气,发酵10 d后每隔3 d排气,室温发酵30 d后制成发酵液[8-9]。
1.2.2 酵母菌的分离纯化 取番茄发酵液制成10-2的稀释液,取稀释发酵液100 μL涂布于YPD培养基上,于28 ℃培养箱培养2~4 d;挑取不同形态的单个菌落划线接种于新鲜无污染的YPD培养基中,重复分离纯化3次,挑取单个菌落进行镜检,将纯化好的菌株放于4 ℃下保存备用[16-17]。
1.2.3 酵母菌的形态学鉴定 根据《酵母菌的特征与鉴定手册》[17]中酵母菌菌落的大小、颜色、表面光滑度、边缘是否整齐、正面与反面以及边缘与中央部位颜色是否一致进行初步断定,然后再在显微镜下观察其形态结构。
1.2.4 酵母菌的分子生物学鉴定与系统发育树构建 a.分子生物学鉴定:参考岑涛等[18]、武伟伟等[19]实验方法,提取酵母菌DNA,根据真菌基因组DNA快速抽提试剂盒操作步骤提取DNA。PCR反应体系(50 μL),模板DNA 2 μL,26S rDNA引物[NL1(5′-GCATATCAATAAGCGGAGGAAAAG-3′),NL4(5′-GGTCCGTGTTTCAAGACGG-3′)]各1 μL,Premix Taq酶25 μL,然后加双蒸水至50 μL。PCR反应条件,95 ℃预变性5 min,95 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1 min,共35个循环,最终72 ℃延伸5 min,4 ℃保温。PCR扩增完成后,将2 μL扩增产物在1%琼脂糖凝胶检测,观察有无特异性目的条带出现,PCR扩增产物最后送北京诺禾致源科技股份有限公司测序。
b.同源性分析与系统发育树的构建:将测序得到的基因序列登录NCBI进行BLAST同源性比对,并在MEGA7软件中Neighbor-Joining法构建系统发育树,进一步进行种属鉴定(用自展法(bootstrap)检验系统发育树,自展数据集为1000)。
1.2.5 酵母菌的生长特性及耐受性分析
1.2.5.1 酵母菌的生长特性分析 参考贾春凤等[20]、魏立杰等[21]试验方法:a. 温度对酵母菌生长的影响:在YPD培养基中接入10%的酵母菌液,分别置于25、29、33和37 ℃下培养24和48 h后测OD610 nm值。b. pH对酵母菌生长的影响:分别在pH为3.5、4、4.5、5、5.5、6的YPD培养液中,接入10%的酵母菌液,于28 ℃下培养24和48 h后测OD610 nm值。
1.2.5.2 酵母菌的耐受性研究 参考试验方法[21-23]:a.酵母菌对糖的耐受性分析:分别接种10%酵母菌于10%、20%、30%、40%、50%葡萄糖浓度的培养基中,28 ℃下培养48 h后测OD610 nm值。b.酵母菌对酒精的耐受性分析:分别接种10%酵母菌于6%、9%、12%、15%、18%酒精度的培养基中,28 ℃下培养48 h后测OD610 nm值。
1.3 数据统计分析
每组试验重复进行3次,数据用平均值±标准差表示。采用IBM SPSS 22.0数据编辑器Duncan(D)进行统计分析和方差分析,以P<0.05作为差异显著性判断标准,最后用Graph Pad Prism v8.0进行绘图。
2 结果与分析
2.1 酵母菌的形态学特征
从番茄自然发酵液中分离纯化得到3株具有疑似酵母菌菌落形态的菌株,编号分别为TY-1、TY-2和TY-3,其在YPD培养基上的菌落形态见表1,3株菌的菌落均不透明、边缘整齐、正反面和边缘、中央部位的颜色均一,而TY-1、TY-2相对TY-3的菌落较湿润且易挑起。3株菌在YPD培养基上的菌落形态和细胞形态见图1,通过在显微镜下观察,3株菌的细胞形态均为椭圆形,TY-1、TY-2顶端无出芽现象,而TY-3顶端出芽。因此,初步判断为毕赤酵母或酿酒酵母[17,24]。
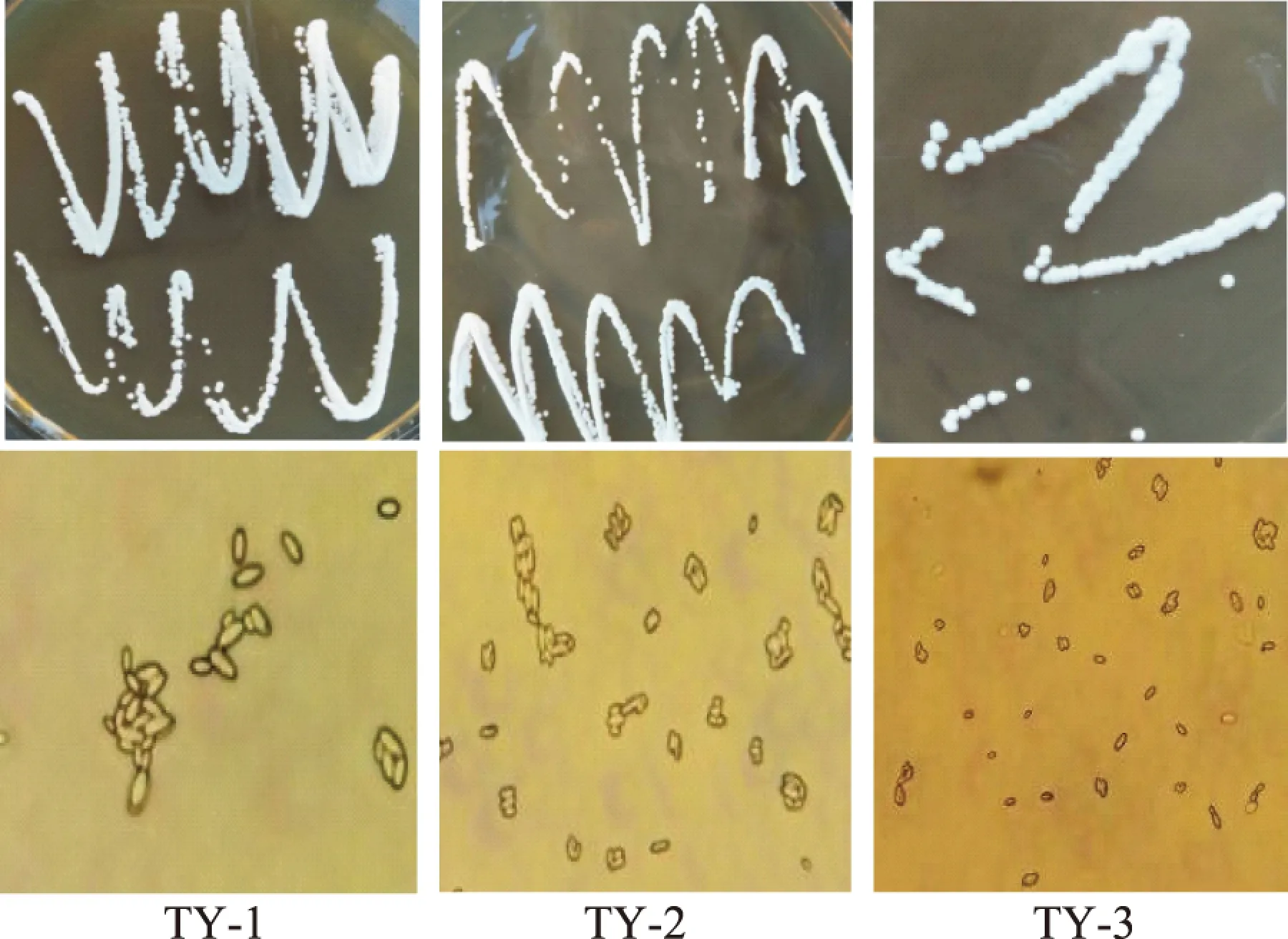
图1 菌落及细胞形态特征Fig.1 Colony and cell morphology
2.2 分子生物学鉴定
对番茄自然发酵液中分离得到的3株菌26S rDNA基因序列进行PCR扩增。如图2所示,3株菌的琼脂糖凝胶电泳条带明亮清晰且无明显拖带现象,分子量均为750 bp左右,符合测序要求。
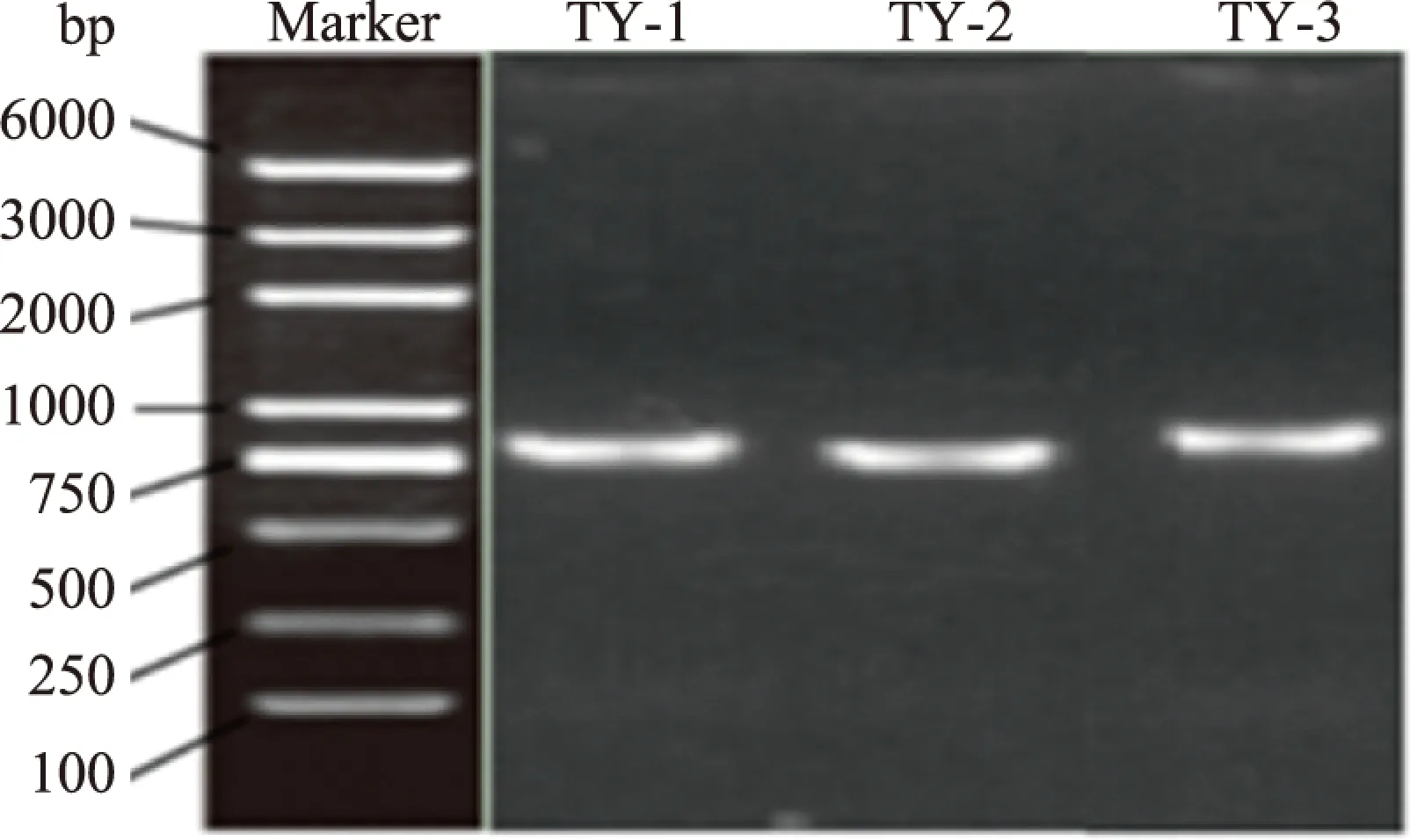
图2 26S rDNA扩增电泳图Fig.2 Amplification of 26S rDNA
将测序结果输入NCBI进行BLAST同源性比对,这些序列与NCBI上提交相应系列的Query coverage值达100%,Percent identity值达887,基于26S rDNA序列构建的系统发育树如图3所示。TY-1、TY-2和TY-3均属于毕赤酵母属(Pichia)中的库德毕赤酵母(P.kudriavzevii),其中TY-1和TY-2均与P.kudriavzeviistrain SLDY-035菌株的同源性为99%,与P.kudriavzeviistrain CBS573的同源性为95%,由于两株菌的亲缘关系较近,故选取一株菌(TY-1)进行后续生长特性及耐受性试验。TY-3与P.kudriavzeviismallsubunitribosomal菌株的同源性为100%,与P.kudriavzeviistrain SSY 02和P.kudriavzeviistrain AMC PK002的同源性为98%。杜晶等[14]从杨梅果酒中筛选出克鲁弗毕赤酵母和库德毕赤酵母;韦明明[13]从发酵番茄酸汤中分离出东方伊萨酵母菌和毕赤酵母菌;魏东东等[24]从红树莓酵素中分离出优势酵母为库德毕赤酵母(Pichiakudriavzevii)2株,盔形毕赤酵母(Pichiamanshurica)1株;两者从果蔬酵素中分离出的优势酵母菌均为毕赤酵母属(Pichia),与本试验结果相似,说明果蔬发酵液中的优势酵母菌为毕赤酵母属,但由于发酵原料、产地的不同导致毕赤酵母属中的种存在一定差异。

图3 基于26S rDNA序列系统发育树Fig.3 Phylogenetic tree based on 26S rDNA sequence
2.3 酵母菌的生长特性及耐受性分析
2.3.1 不同温度对酵母生长的影响 温度是影响酵母菌生长的重要因素,可以影响酶活性和酵母菌对营养物质的吸收利用,而不同的酵母菌最适生长温度也有所差异[17,25]。如图4所示,TY-1和TY-3分别培养24和48 h后,其OD值随着温度的增加呈现出先增加后降低的趋势;其中,TY-1和TY-3在29 ℃时菌体密度达到最大值;随着温度继续上升,两株菌的菌体密度迅速降低(P<0.05),可能是温度的升高抑制了酵母菌的生长。可见,29 ℃为TY-1和TY-3最适生长温度,和温洪宇等[26]从发酵醋醅分离得到的季也蒙毕赤酵母的最佳生长温度为30 ℃相似。
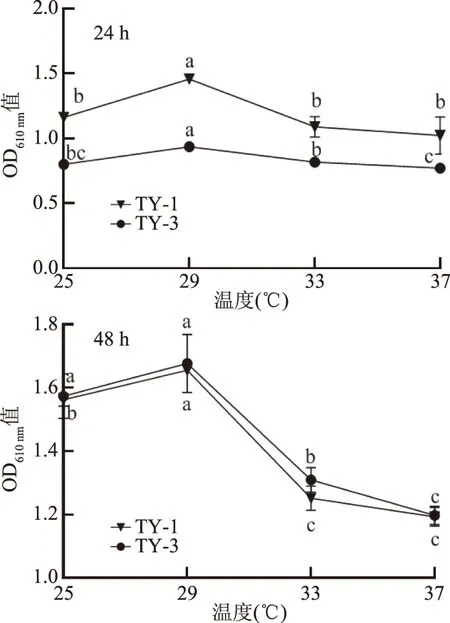
图4 温度对TY-1和TY-3生长的影响Fig.4 Effects of temperature on the growth of TY-1 and TY-3注:图中各组的不同字母表示 显著差异,P<0.05;图5~图7同。
2.3.2 不同pH对酵母菌生长的影响 pH对酵母菌的生长代谢有较大影响,能影响细胞间的代谢传递及酶活性,在较低或者较高的pH下可使酵母菌死亡[27]。如图5所示,菌株培养24、48 h后,两株菌在不同pH下的变化趋势相近,当pH为3.5~6,菌体密度呈先增加后降低的趋势,其中在培养24 h后,pH为5.5时菌体密度达到最大,但与pH为5.0时的OD值差异不显著(P>0.05);而培养48 h后,pH为5.5时菌体密度达到最大(P<0.05);随着pH继续上升,两株菌体的菌体密度迅速降低(P<0.05),可能是较高pH抑制了酵母菌细胞间物质交换或酶活性。因此,pH5.5为番茄发酵液中酵母菌生长的最适pH。陶森等[28]研究表明季也蒙毕赤酵母菌最佳pH在5~6之间,这与本试验结果相似;而韦元琪等[29]从酒曲中分离得到1株库德毕赤酵母的最适pH为6.0,这可能是发酵底物不同,使得库德毕赤酵母的最适pH有所差异。
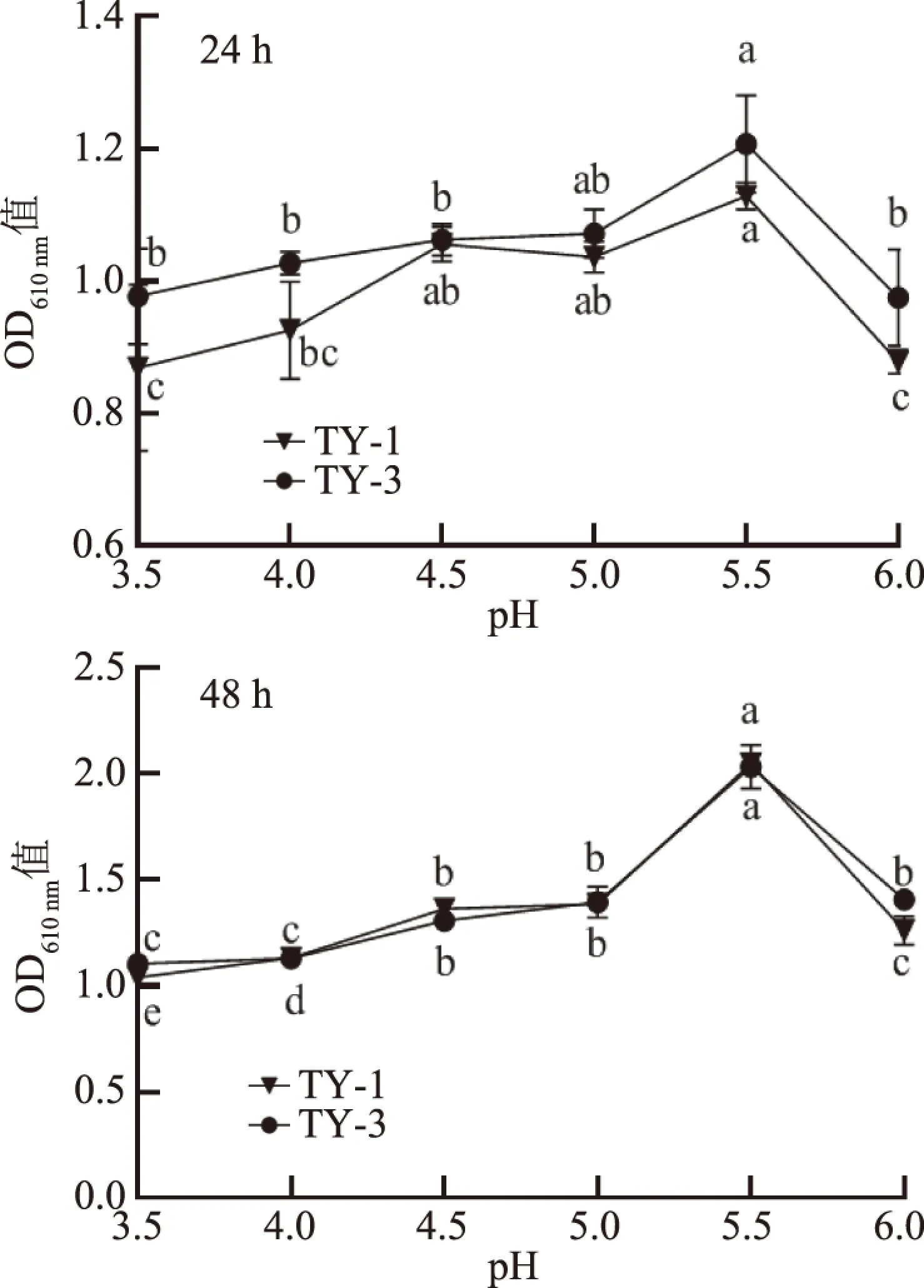
图5 pH对TY-1和TY-3生长的影响Fig.5 Effects of pH on the growth of TY-1 and TY-3
2.3.3 酵母菌对葡萄糖的耐受性分析 添加一定糖浓度可以为酵母菌的生长提供必需的碳源,但在较高浓度下会改变酵母菌细胞膜的渗透压从而抑制其生长[26]。如图6所示,两株菌在不同糖浓度下变化趋势基本相近,菌体密度吸光度值随着糖浓度的增加呈现不断降低的趋势。当糖浓度为10%时菌体密度显著高于其他各组(P<0.05),而浓度高于30%后,两株菌几乎不生长,可能是较高糖浓度抑制了TY-1和TY-3的生长,但在糖浓度为40%~50%时TY-1的耐受性略强于TY-3(P<0.05)。伍强等[30]从猕猴桃果肉中分离出的库德毕赤酵母在25%糖浓度下能良好的生长,但糖浓度达到35%时,该菌几乎不能生长;杜晶等[14]从杨梅果酒中分离的毕赤酵母在糖含量超过30%时其生长开始受到抑制,而酿酒酵母则在糖含量为50%时仍能很好地进行发酵。本试验番茄自然发酵液中分离得到的菌株耐糖能力略低于猕猴桃中分离的毕赤酵母和杨梅果酒中的克鲁弗毕赤酵母、库德里阿兹威氏毕赤酵母,这为该菌作为果蔬发酵剂的使用提供理论依据。
2.3.4 酵母菌对酒精的耐受性分析 酵母菌对酒精的耐受能力是影响酵母菌发酵的重要因素,如果酵母菌对酒精的耐受性差则使发酵难以继续[31]。从图7中可以看出,两株菌的生长变化趋势基本相同,随着酒精浓度的增加,菌体密度逐渐降低。TY-3菌在酒精浓度为6%时吸光度值最大(P<0.05),随着酒精浓度的增加其OD值显著降低(P<0.05);而TY-1菌在酒精浓度为6%~9%时生长差异不显著(P>0.05),当酒精浓度高于9%后,生长受到显著抑制(P<0.05);但均低于TY-3的OD值。由此可见,番茄发酵液中分离得到的TY-1较TY-3具有较宽的酒精耐受性范围。伍强等[30]从猕猴桃果肉中分离出的野生酵母菌克鲁维毕赤酵母或库德毕赤酵母,在12%的酒精浓度下发酵能力显著降低;郝瑶等[32]分离的库德里阿兹威氏毕赤酵母(Pichiakudriavzevii)在酒精度≥12%时,菌株基本不生长;以上研究与本文结果一致。
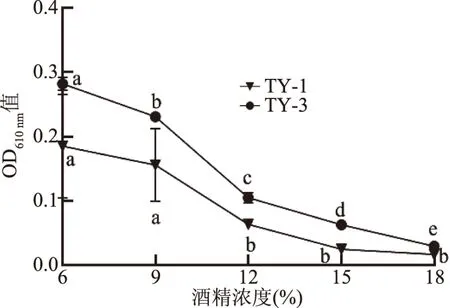
图7 不同浓度的酒精对TY-1和TY-3生长影响Fig.7 Effects of different concentrations of alcohol on the growth of TY-1 and TY-3
3 结论
本研究从30 d番茄自然发酵液中分离得到3株菌,采用26S rDNA特异性引物对其进行PCR扩增测序,将其扩增序列与NCBI中的核酸数据库进行比对分析得到3株菌均为毕赤酵母属(Pichia)中的库德毕赤酵母种(P.kudriavzevii),其中TY-1和TY-2亲缘关系较近,与P.kudriavzeviistrain SLDY-035菌株的同源性为99%;TY-3与P.kudriavzeviismallsubunitribosomal菌株的同源性为100%。TY-1、TY-3菌的最适生长温度为29 ℃、最适pH为5.5,对酒精和葡萄糖具有一定的耐受能力。这为番茄酵素高效发酵剂的制备奠定菌种基础,如再经过进一步驯化,各菌株将会更好地适应果蔬发酵环境,从而表现出更好的发酵性能,这对研究开发功能性微生物酵素产品及实现工业化生产具有一定意义。
