中国多发性硬化临床特点及诊断难点分析
2021-06-16刘翕然王维治王丽华张美妮李春阳董会卿李国忠刘洪波管阳太0檀国军张星虎
刘翕然 徐 雁 王维治 王丽华 张美妮 李春阳 董会卿 李国忠 刘洪波 付 锦 金 涛 管阳太0 檀国军 郭 力* 张星虎*
(1.首都医科大学附属北京天坛医院神经病学中心神经感染与免疫病区,北京100070; 2.北京协和医院神经内科,北京 100140; 3. 哈尔滨医科大学附属第二医院神经内科,哈尔滨 150001; 4. 山西医科大学第一医院神经内科,太原 030001; 5. 内蒙古医科大学附属医院神经内科,呼和浩特 010030; 6.首都医科大学宣武医院神经内科,北京 100053; 7. 哈尔滨医科大学附属第一医院神经内科,哈尔滨 150007; 8. 郑州大学第一附属医院神经内科,郑州 150007; 9.吉林大学白求恩第一医院神经内科,长春 130031; 10.上海交通大学医学院附属仁济医院神经内科, 上海 200001; 11.河北医科大学第二医院神经内科, 石家庄 050061)
多发性硬化(multiple sclerosis,MS)是一种进展性的中枢神经系统炎性疾病。其发病年龄为15~40岁,是导致青壮年人群发生神经功能缺损的主要病因之一[1]。其临床症状谱较为广泛,取决于受累部位,可表现为肢体无力、感觉症状、视力下降、括约肌功能障碍等,其他非特异性症状还包括疼痛、疲劳等。
高加索人群中MS的流行病学特点、临床特点及诊疗情况目前已有相对全面、翔实的报道[1]。如日本、韩国等亚洲国家也进行了相关的临床研究,总结该地区的发病特点等情况。亚洲多发性硬化的临床特点与西方国家有着显著的差异,除患病率较低外,亚洲多发性硬化有更多视神经和脊髓受累,大脑病灶较少,女性比例更高,发病年龄较大,残疾程度进展快但发展为进展型病程的患者的比例较小[2]。早期识别及准确诊断对于多发性硬化患者至关重要,及时且适宜的治疗可减少残疾的发生,减缓疾病的进展,促进患者预后[3]。在过去30年中,多发性硬化患者从发病到诊断时间显著缩短[4],这可能得益于不断修订完善的诊断标准[5]以及磁共振成像技术的普及。然而,仍有一定数量的患者因各种原因延误了诊断的时间。国外文献[6]显示,约40%新诊断多发性硬化的患者从发病至明确诊断的时间大于2年。以上认识均来源于国外文献[1-2],目前国内多发性硬化的临床特点及诊断情况尚无全面、大样本的记录。本研究基于中国多发性硬化患者调研项目结果,总结中国多发性硬化患者的临床特点、诊断情况,分析国内多发性硬化诊断的难点。
1 对象与方法
1.1 研究对象
本研究基于中国多发性硬化患者调研项目,该项目由中华医学会神经病学分会和中国医疗保健国际交流促进会发起,是一项全国范围内多中心的网络登记研究,全国49家医院参与研究,患者分布于全国31个省、直辖市和自治区。调研时间为2018年5月至2018年10月,调研内容涉及临床症状、诊断、治疗以及生活习惯等。调研由分中心医师和患者共同完成。患者完成人口学信息以及病史、就医过程等信息,临床评估由分中心神经内科专业医师完成。
1.2 诊断标准
多发性硬化诊断类型基于2010 McDonald标准[7],将诊断分为临床孤立综合征(clinical isolated syndrome,CIS)、复发缓解型多发性硬化(relapsing-remitting MS, RRMS)、继发进展型多发性硬化(secondary progressive MS,SPMS)、原发进展型多发性硬化(primary progressive MS,PPMS)。扩展残疾程度量表(Kurtzke Expanded Disability Status Scale,EDSS)分数用于评估神经系统功能缺损严重程度。
1.3 资料收集
所有患者收集人口学信息、发病时间、发病年龄、临床症状、诊断类型、就医诊断过程(包括发病到首次就诊时间、首次就诊到诊断时间)。
1.4 统计学方法
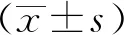
2 结果
2.1 人口学信息
研究共纳入557名患者(表1)。其中女性377名,男性180名(女性与男性比例为2.09∶1)。平均年龄为(39.9±12.5)岁,平均发病年龄为(34.9±11.2)岁,30~39岁为发病高峰,52%患者首次症状发生于40岁之前。平均病程长度为(66.8±61.5)个月。
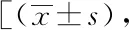
表1 人口学资料及临床特征(基于性别分类)

续表1
2.2 临床表现
诊断方面,22.6%患者诊断为CIS,69.3%患者诊断为RRMS,只有6.1%和2.0%患者分别诊断为SPMS和PPMS。最常见的临床表现为运动症状(62.1%)、感觉症状(51.3%)、小脑症状(39.7%)、视力下降(37.0%)。神经系统功能缺损的严重程度方面,EDSS评分中位数2.5分,范围为0~8.5分,主要分布在0~3分区间(59.1%)和3.5~6分区间(38.2%)。发病频率集中在每年发作1次(23.9%)和每2~4年发作1次(21.9%),过去一年平均发作次数为1次。
性别差异方面,男性、女性患者在年龄、学历、发病年龄、病程、诊断、大部分临床症状、神经系统功能缺损程度、发病频率等方面差异均无统计学意义。女性患者出现感觉症状的比例较高(55.2%vs43.3%,P=0.011),同时女性患者近一年发作次数高于男性患者(1.0vs0.9,P=0.031)。
与RRMS相比,进展型MS的病程长度、感觉症状、括约肌障碍比例、EDSS显著增加(表2)。两组性别、年龄、发病年龄、其他症状比例、发作频率等差异均无统计学意义。与CIS相比,临床诊断的MS(包括RRMS、SPMS、PPMS)年龄、发病年龄、除脑干症状、疼痛以外症状比例、EDSS评分显著增加,性别和发病频率差异无统计学意义。

表2 人口学资料及临床特征(基于诊断分类)

续表2
2.3 就诊及诊断过程
疾病知晓率和诊断方面,仅有很少部分患者(5.6%)发病前曾听说过多发性硬化这种疾病。83.9%患者在发病后立即就诊,未立即就医的主要原因有“期初症状轻微,没有在意”(62.2%)、“症状间歇出现,会自行消失”(13.4%)、“就医困难”(8.5%)、“工作繁忙”(3.7%)。发病到就诊的平均时间为(0.28±1.11)年,其中不大于3个月的比例为90.2%。94.4%的患者最终选择三级医院就诊,82.1%的患者住院检查及治疗。55.1%的患者首次就诊即确诊,未确诊的主要原因包括“误诊为其他疾病”(9.0%)、“初步检查未得出结论”(14.2%)、“等待第二次发作”(11.1%)。首诊到确诊的平均时长为(0.91±2.36)年,其中不大于6个月的比例为72.4%。
3 讨论
本研究基于中国多发性硬化患者调研项目结果,首次全面描述中国人群MS的临床特点并分析诊断过程中的难点。对比既往文献[8-11]报道,发现中国人群MS的部分临床特点与高加索人种相似,如发病年龄、性别、症状构成及比例,同时中国人群MS也具有自己的特征,如较低的RRMS比例、较低的疾病严重程度。对于多发性硬化这种疾病的知晓率低、发病后未及时就诊、首次发作不能确诊是诊断的主要困难。
既往研究[12-14]显示,亚洲MS患者对于西方国家患者特点十分显著,如女性比例更高(1.5~9.6),更高的发病年龄[(29~39)岁]。然而本研究中的女性与男性比例(2.0)和平均发病年龄[(35±11.2)岁]与高加索人群十分相似[15]。
本研究中RRMS患者所占比例最大(69.3%),但略低于西方国家报道的RRMS的比例(约85%),同时也低于亚洲国家报道[9-10]。以往认为亚洲MS中进展型MS的比例较西方国家低,约12%左右[13]。本研究中,进展型MS的比例为8.1%,符合亚洲MS的特点[8],但这一结果可能存在偏倚,RRMS患者相对于进展型MS患者会更加频繁地前往医院就诊或复诊,更易参加本次调研项目。若将观察时间延长可增加进展型MS患者的比例。
本研究中,患者最常见的临床症状是运动症状(69.3%)、感觉症状(51.3%)、小脑症状(39.7%),与西方国家及亚洲国家报道[6,9]大致相同。EDSS评分是评价MS患者残疾程度的重要方法,以往报道[14]显示,亚洲患者残疾程度高于西方国家患者。西方国家患者中RRMS患者的EDSS评分多不大于4分,而进展型MS的EDSS评分多大于6分[13]。本研究中各类型MS的EDSS评分均低于既往报道[8,9]的西方国家患者,但进展型MS评分仍显著高于RRMS。这些发现强调了对RRMS患者早期诊断和干预的重要性,以减缓或预防与频繁复发或进展性疾病相关的身体残疾的累积。
从首次出现临床症状到首次就诊之间的时间是评价诊断时间延迟的重要指标。本研究中83.9%患者发病后即选择去医院就诊,从发病到首诊的平均时间是(0.28±1.11)年,大部分患者(90.2%)在3个月以内去就诊,该结果短于西班牙报道[14]的1.6年以及克罗地亚报道[15]的0.35年,同时3个月内就诊的比例大于瑞士报道[6]的80%,这样的差异可能与各国医疗体系不同有关。本研究中首发症状后患者未立即就诊的首要原因是症状轻微,患者未在意,另外因为症状间歇出现,会自行消失,这与国外文献[6]类似。另一个评价诊断延迟的指标是首次就诊到确诊的时间,本研究的结果是(0.91±2.36)年,这一时间不大于6个月的比例为72.4%。文献[15]显示,克罗地亚人群该时间为12.8(0.4~198.7)周,西班牙人群为1.8月[14],瑞士首诊到确诊时间不大于6个月的比例是79.9%[6]。Barin等[6]的研究显示,首诊到确诊时间与发病的年代、诊断的类型、首发症状、首诊的医疗机构类型相关。2010年以后诊断所需时间较短,这与2010年新版McDonald诊断标准的发布有关,能够较快地诊断多发性硬化,与过去的标准相比,其敏感性及特异性相同,但诊断过程简化,要求磁共振检查次数减少(取消了磁共振检查时间间隔的限制),对磁共振时间及空间多发性的标准也进行了修改[16-17],另外可能与医疗条件的进步以及磁共振成像技术的普及有关,本研究中显示2010年后诊断多发性硬化的患者比例较大,也从侧面印证了该观点。PPMS较 RRMS诊断所需的时间更长,这可能与McDonald诊断标准[7]要求确定进展型病程需要1年时间有关,另外与RRMS发病急、临床症状明显,相比之下PPMS的症状具有更少的破坏性和急迫性。本研究中44.9%的患者在首诊时未能确诊,主要原因有“诊断为其他疾病”(20%)、“初步检查未得出结论”(31.6%)、“等待下一次发作”(24.8%)。多发性硬化症的误诊率可能高达10%,在一项针对美国MS专业神经科医师的调查[18]中,95%的参加调查的医生在前一年见过1个或多个被误诊为MS的患者,其中许多人正在接受疾病修正治疗,不恰当的治疗增加患者经济负担且负担不必要的药物不良反应及风险。
MS最重要的鉴别诊断是视神经脊髓炎谱系疾病(neuromyelitis optica spectrum disorders, NMOSD)。NMOSD是另一种常见的中枢神经系统炎性脱髓鞘病[19],其临床特点、影像表现有很大一部分与MS重叠。NMOSD好发于青壮年,同样多见于女性[20]。视神经炎和横贯性脊髓炎是NMOSD的核心症状[19],但同样可以出现于MS,这导致NMOSD的首次发作不易与CIS相鉴别。在欧洲和北美人群中,NMOSD的发病率小于多发性硬化症的1/100,但在MS发病率较低的亚洲和非洲人群中,其发病率相对较高[20]。尽管二者均为中枢神经系统炎性脱髓鞘病,但二者需严格鉴别,二者有完全不同的治疗及预后,部分用于MS的疾病修正治疗可能会加重NMOSD的病情[21]。水通道蛋白-4抗体的发现揭示了NMOSD的发病机制并可作为其诊断依据[19, 22],尽管AQP4-IgG对NMOSD具有高度特异性,但使用ELISA法检测的MS患者中有高达0.5%的假阳性[23],这可能导致误诊。本研究基于中国首个全国范围多中心多发性硬化调研项目,比较全面、详实地描述总结了中国MS患者的临床特点以及分析诊断过程中的难点,研究结果具有一定代表性。但调研以医院为中心且为回顾性的设计类型是本研究主要的不足之处,这导致了研究结果可能低估了进展型MS患者的比例。建立全国范围的队列研究可能是解决这一问题的主要途径。
本研究显示中国人群MS的临床特点与高加索人种部分相似,如发病年龄、性别、症状构成及比例,同时中国人群MS也具有自己的特征,如较低的RRMS比例、较低的疾病严重程度。对于多发性硬化这种疾病的知晓率低、发病后未及时就诊、首次发作不能确诊是诊断的难点,确诊时间仍与部分西方国家有一点差距,因此今后需要通过提高普通人群和基层医生对MS的认识来缩短诊断时间。
致谢:(按姓氏笔画顺序排列)
卜碧涛(华中科技大学同济医学院附属同济医院神经内科)、马莎(云南省人民医院神经内科)、王哲(大连医科大学附属第一医院神经内科)、王满侠(兰州大学第二医院神经内科)、刘广志(首都医科大学附属北京安贞医院神经内科)、刘卫彬(中山大学附属第一医院神经内科)、安中平(天津市环湖医院神经内科)、孙庆利(北京大学第三医院神经内科)、李文玉(浙江大学医学院附属邵逸夫医院神经内科)、李柱一(空军军医大学唐都医院神经内科)、李海峰(原山东大学齐鲁医院神经内科,现首都医科大学宣武医院神经内科)、李静(中南大学湘雅医院神经内科)、李磊(哈尔滨医科大学附属第二医院神经内科)、杨欢(中南大学湘雅医院神经内科)、杨春生(天津医科大学总医院神经内科)、吴帅(复旦大学附属中山医院神经内科)、邱伟(中山大学附属第三医院神经内科)、沈帆霞(上海交通大学医学院附属瑞金医院神经内科)、张华(北京医院神经内科神经内科)、张旭(温州医科大学附属第一医院神经内科)、张旻(华中科技大学同济医学院附属同济医院神经内科)、陈道文(南京脑科医院神经内科)、周文斌(中南大学湘雅医院神经内科)、周红雨(四川大学华西医院神经内科)、郑维红(厦门大学附属中山医院神经内科)、赵玉武(上海交通大学附属第六人民医院神经内科)、秦新月(重庆医科大学附属第一医院神经内科)、徐竹(贵阳医学院附属医院神经内科)、徐芳(中国人民解放军火箭军总医院神经内科)、徐忠信(吉林大学中日联谊医院神经内科)、高枫(北京大学第一医院神经内科)、郭守刚(山东省立医院神经内科)、唐玉兰(广西医科大学第一附属医院神经内科)、戚晓昆(中国人民解放军海军总医院第六医学中心)、梁辉(浙江大学医学院附属第一医院神经内科)、管玉青(南方医科大学南方医院神经内科)、薛群(苏州大学第一附属医院神经内科)
