沉默FASN 基因对肝母细胞瘤HepG2 细胞的脂质代谢及增殖、迁移和凋亡的影响
2021-06-16黄慧敏王靳琎冉凤英陈琴华
黄慧敏,魏 英,王靳琎,冉凤英,陈琴华
湖北医药学院附属东风医院实验中心,湖北 十堰442008
肝母细胞瘤(HB)是儿童期最常见的肝脏恶性肿瘤,90%发生于5岁以内,具有恶性程度高、瘤体生长迅速、预后差的特点[1-2]。肝母细胞瘤作为一种恶性胚胎性肿瘤,其病因及发生发展机制仍不明确。肝母细胞瘤早期多无症状,病情进展迅速,约20%的患儿在诊断时已发生远处转移[3]。手术联合化疗是目前肝母细胞瘤治疗的主要手段。5-氟尿嘧啶、长春新碱、顺铂、环磷酰胺等是肝母细胞瘤治疗常用的化疗药物[4],但以上药物在杀死肿瘤细胞的同时也带来了严重的毒副作用,如肝脏毒性[5]、神经毒性[6]、肾脏毒性[7]及听力损伤[8]等,严重降低了患者的生存质量。因此,寻求高效低度的化疗药物和治疗靶点仍然是肝母细胞瘤等癌症研究的重要内容。
研究表明肿瘤的发生发展与脂肪代谢异常密切相关,脂肪酸合成酶(FASN)是一个重要的癌基因,在多种肿瘤细胞及肿瘤病变前组织中表达水平显著升高,且FASN的过度表达与肿瘤细胞的增殖、转移、抗凋亡等密切相关[9-10]。然而,作为与肿瘤细胞脂质合成密切相关的癌基因,尚未有关于FASN基因对肝母细胞瘤脂质代谢及生物学行为影响的研究报道。因而本研究通过RNAi技术,阻断肝母细胞瘤HepG2细胞中FASN的表达,通过油红O染色、CCK-8增殖实验、细胞划痕实验等,观察FASN基因沉默对HepG2细胞脂质代谢及生物学行为的影响,以期为深入研究FASN基因在肝母细胞瘤发生发展中的作用提供理论基础。
1 材料和方法
1.1 细胞与主要试剂
人肝母细胞瘤HepG2细胞(中国科学院细胞库),DMEM 培养基及胎牛血清(Gibico),Lipofectamine 2000(Invitrogen),反转录试剂盒(Fermentas),PCR 试剂盒(Takara);RIPA裂解液、BCA蛋白浓度检测试剂盒(上海碧云天生物技术有限公司),PVDF膜(Millipore);FASN抗体(Abcam),荧光二抗(优宁维),甘油三酯试剂盒(北京普利莱基因技术有限公司),油红O(Sigma),CCK-8(南京凯基生物有限公司),AnnexinV-FITC/PI凋亡试剂盒(杭州联科生物技术股份有限公司),Transwell小室(Corning)。FASN特异性siRNA干扰序列(FASN-siRNA)和siRNA阴性对照序列(NC-siRNA)以及Fam 荧光标记的siRNA 阴性对照序列(NCsiRNA-Fam)由上海吉玛制药技术有限公司合成,siRNA寡核苷酸序列(表1)。

表1 SiRNA寡核苷酸序列Tab.1 Sequences of small interfering RNA(siRNA)
1.2 方法
1.2.1 细胞培养与处理 HepG2细胞培养于含10%胎牛血清的DMEM培养基中,置于37 ℃、5%CO2的培养箱中,取对数生长期的HepG2细胞用于实验。转染前观察细胞生长状态,密度达到60%时,按照Lipofectamine 2000说明书及siRNA说明书进行细胞转染,过程如下:实验分为Control组、NC-siRNA组和FASN-siRNA组,FASN-siRNA组转染75 nmol/L的FASN-siRNA片段,NC-siRNA组转染等剂量的NC-siRNA片段,Control组只加入等体积的转染试剂,转染24 h后更换培养基,继续培养24 h后检测各个指标。
1.2.2 实时荧光定量PCR实验 按照1.2.1的方法转染HepG2细胞,48 h后加TRIzol提取细胞内总RNA,按照试剂盒说明书逆转录成cDNA,通过实时荧光定量PCR法测FASN mRNA的表达水平,GAPDH为内参。PCR引物由上海吉玛制药技术有限公司合成,FASN的上游引物序列为5'-ACAGCGGGGAATGGG-3',下游引物序列为5'-GACTGGTACAACGAG-3';GAPDH的上游引物序列为5'-CTTTGACGCTGGGGCTGGCA-3',下游引物序列为5'-TGGCAGGGACTCCCCAGCAG-3'。反应程序为:95 ℃,3 min;95 ℃,12 s;62 ℃,40 s,40个循环,以2-△△Ct计算mRNA相对表达水平。实验重复3次。
1.2.3 Western blot实验 按照1.2.1的方法转染HepG2细胞,48 h后弃培养基,用预冷的PBS洗细胞3次,加RIPA裂解液于冰上裂解30 min,4 ℃下12 000g离心10 min,收集上清,通过BCA法检测蛋白浓度,GAPDH作为内参蛋白。取30 μg总蛋白进行电泳分离,分离后的蛋白转移至PVDF膜上,5%的脱脂奶粉封闭PVDF膜1 h,TBST 洗PVDF 膜3 次,加入1∶1000 稀释的FASN 和GAPDH 抗体,4 ℃过夜,TBST 洗PVDF 膜3次,加入1∶10000稀释的二抗,室温孵育1 h,ECL显色液孵育PVDF 膜条,在凝胶成像系统上显影拍照,使用Image J 软件进行灰度分析。实验重复3次。
1.2.4 油红O 染色 按照1.2.1 细胞转染的方法转染HepG2细胞,并于48 h后进行细胞染色:弃培养基,PBS清洗3 遍后每孔加入4%多聚甲醛200 μL,室温固定20 min,再次用PBS清洗细胞,60%异丙醇200 μL清洗细胞10 s,弃异丙醇,每孔加油红O工作液200 μL,室温下染色30 min,弃染色液,60%异丙醇洗细胞2次,PBS洗细胞3次,显微镜下观察细胞内红色脂质,拍照比较各组间油红O染色变化。拍照后每孔加入60%的异丙醇500 μL,室温放置15 min,溶解细胞上附着的油红O染液,酶标仪485 nm处测定各组A485nm。实验重复3次。
1.2.5 细胞内甘油三酯的检测 按照1.2.1的方法转染HepG2细胞,48 h后收集细胞,细胞沉淀用PBS洗涤3遍,提取细胞总蛋白,BCA法测总蛋白浓度。细胞内甘油三酯水平检测参照试剂盒操作说明书,以总蛋白浓度进行校正,在酶标仪550 nm波长下测样本的吸光度A550nm。实验重复3次。
1.2.6 CCK-8检测细胞增殖活性 细胞接种于96孔板,接种细胞约5×103/孔,每组设5个复孔,按照1.2.1的方法转染HepG2细胞,37 ℃、5%CO2条件下培养。转染24、48、72、96 h后每孔加入10 μL的CCK-8工作液,继续孵育2 h,在酶标仪450 nm波长下测A450nm。实验重复3次。
1.2.7 AnnexinV-FITC/PI 染色检测细胞凋亡 按照1.2.1的方法转染HepG2细胞,48 h后弃培养基,PBS洗细胞3 次,每孔加500 μL 1×Binding Buffer 工作液和5 μL的Annexin V-FITC,3 min后加入10 μL的PI,室温避光孵育10 min,每管加PBS 300 μL,混匀后通过流式细胞仪进行检测。
1.2.8 细胞划痕实验 采用体外细胞划痕实验,检测沉默FASN基因对HepG2细胞迁移能力的影响。细胞接种于6孔板中,按照1.2.1的方法转染HepG2细胞,24 h后用200 μL灭菌一次性吸头做直线划痕,用PBS洗涤3次以去除划落的细胞,加入含1%胎牛血清的DMEM培养液,于细胞划痕后的0、24 h观察并照相,通过Image J软件进行愈合率的计算,划痕愈合率=(初始划痕面积-现存划痕面积)/初始划痕面积×100%。
1.2.9 Transwell实验 按照1.2.1的方法转染HepG2细胞,24 h后胰酶消化并用含0.1%BSA的无血清培养基重悬细胞,计数并调节细胞浓度至1×105/mL。Transwell小室放入24孔板中,上室加入200 μL的细胞悬液,下室加入600 μL含10%胎牛血清的培养基,于37 ℃,5%CO2条件下培养24 h。弃培养基,小室于4%多聚甲醛中固定20 min,加入0.1%结晶紫染液染色15 min,PBS 清洗3次,棉签轻轻擦净小室上层未迁移过去的细胞。显微镜下随机选取5个视野进行拍照并计数迁移到下室的细胞。
1.3 统计学分析
分析采用GraphPad Prism 8软件。计量资料以均数±标准差表示,组间数据采用单因素方差分析进行比较,当P<0.05时为组间差异具有统计学意义。
2 结果
2.1 siRNA转染效率的测定
预实验考察了0、25、50、75 nmol/L 浓度下siRNAFAM对HepG2细胞的转染情况。当siRNA-FAM浓度为0 nmol/L 时,倒置荧光显微镜下无绿色荧光,当siRNA-FAM浓度为25 nmol/L时,少量HepG2细胞发绿色荧光,随着siRNA-FAM浓度的增加,荧光强度逐渐增强。当siRNA-FAM浓度为75 nmol/L时,HepG2细胞的荧光强度最强(图1),转染效率在60%以上,故后续实验中所用siRNA浓度为75 nmol/L。
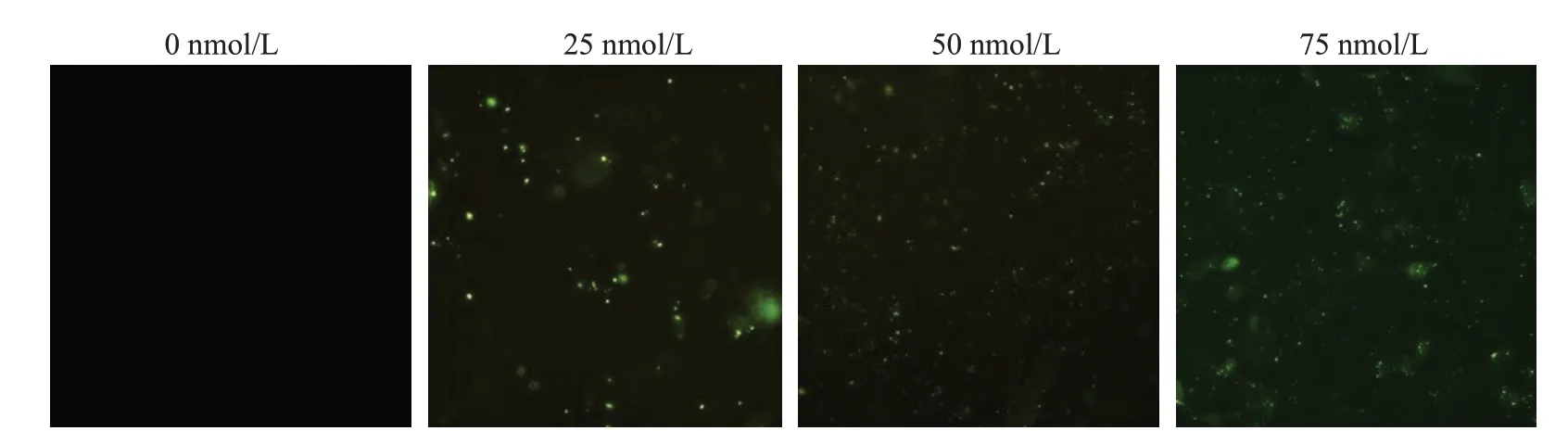
图1 荧光显微镜下观察NC-siRNA-Fam转染效率Fig.1 Transfection efficiency of NC-siRNA-Fam observed by fluorescence microscope.
2.2 Real-time PCR 法检测siRNA 沉默FASN 基因的效率
Control 组、NC-siRNA 组 和FASN-siRNA 组 的FASN基因的表达水平分别为1.00±0.035、0.987±0.076和0.160±0.042。Control组FASN 基因的表达水平和NC-siRNA 组相比无统计学差异(P>0.05),FASNsiRNA组的FASN基因表达水平和NC-siRNA组相比显著降低(P<0.001,图2)。

图2 FASN-siRNA 转染抑制HepG2 细胞中FASN mRNA的表达Fig.2 FASN-siRNA decreases the expression of FASN mRNAin HepG2 cells.***P<0.001 vs NC-siRNA.
2.3 Western blot法检测FASN基因沉默对FASN蛋白表达的影响
NC-siRNA组中FASN蛋白表达量和Control组相比略有下降,但两组差异无统计学意义(P>0.05),FASN-siRNA组中FASN蛋白表达低于NC-siRNA组(P<0.001,图3)。
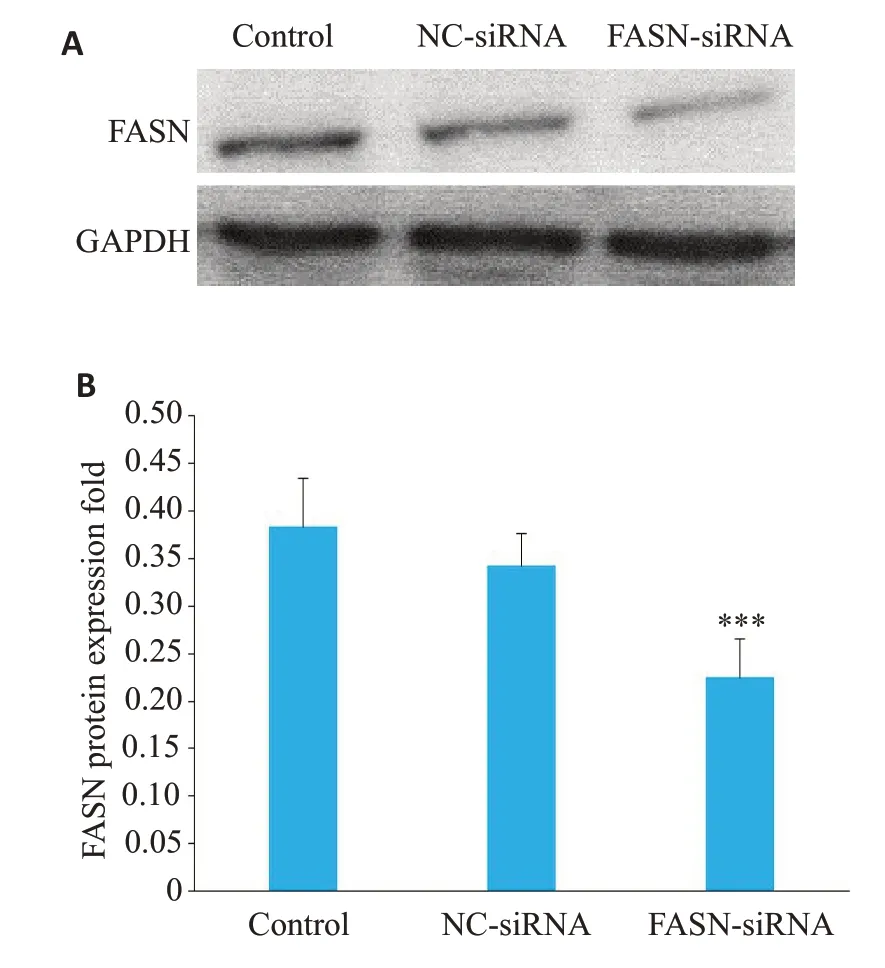
图3 FASN-siRNA转染降低HepG2细胞中FASN蛋白的表达Fig.3 FASN-siRNA decreases the expression of FASN protein in HepG2 cells.A:Western blotting results of FASN protein.B:Relative expression quantities of FASN protein.***P<0.001 vs NC-siRNA.
2.4 油红O染色检测FASN基因沉默对HepG2细胞脂质含量的影响
光学显微镜下观察油红O 染色,结果显示,NCsiRNA组与Control组HepG2细胞中均有少量红色小脂滴出现,FASN-siRNA组细胞内脂滴较NC-siRNA组减少(图4A)。进一步脂质含量测定结果显示,NC-siRNA组和Control组相比脂质含量有所下降,但两者差异无统计学意义(P>0.05);FASN-siRNA 组脂质含量低于NC-siRNA组,差异有统计学意义(P<0.001,图4B)。
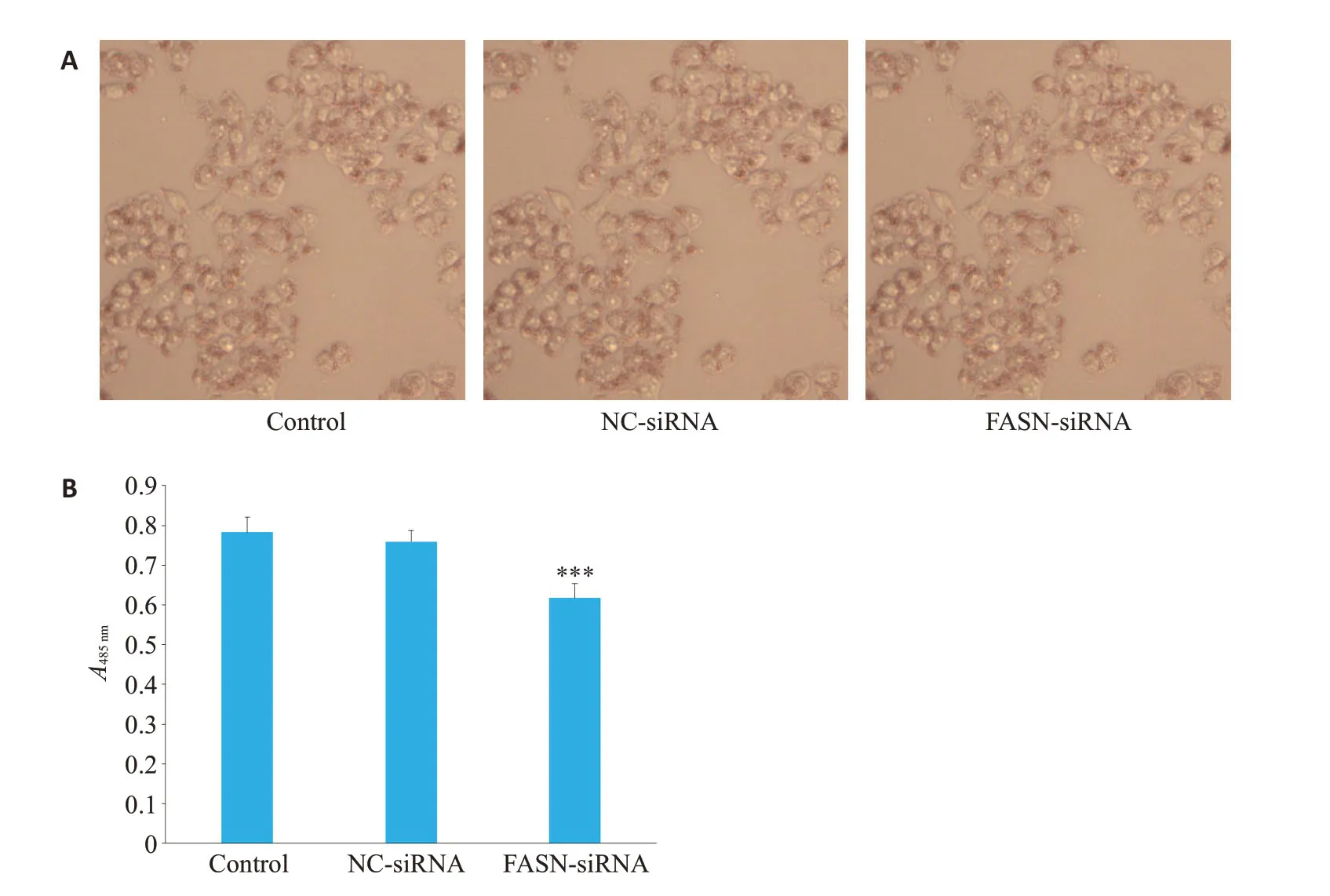
图4 油红O染色观察FASN基因沉默对HepG2细胞脂质含量的影响Fig.4 Effect of FASN gene silencing on lipid content in HepG2 cells.A:Lipid droplets in HepG2 cells (Oil red O staining).B:Quantitative results of lipid droplets in the cells.***P<0.001 vs NC-siRNA.
2.5 FASN基因沉默对HepG2细胞甘油三酯代谢的影响
Control组、NC-siRNA组、FASN-siRNA组细胞内甘油三酯水平分别为:798.3±114.4、772.5±141.6、501.3±70.4 μmol/g。NC-siRNA组与Control组的甘油三酯水平差异无统计学意义(P>0.05);FASN-siRNA组甘油三酯水平较NC-siRNA组降低,差异有统计学意义(P<0.01,图5)。

图5 FASN 基因沉默对HepG2细胞甘油三酯含量的影响Fig.5 Effect of FASN gene silencing on triglyceride content in HepG2 cells.**P<0.01 vs NC-siRNA.
2.6 CCK-8实验检测FASN基因沉默对HepG2细胞增殖的影响
转染24 h后,FASN-siRNA组HepG2细胞增殖活性和NC-siRNA组相比略有降低,但差异无统计学意义(P>0.05);转染48、72、96 h后,FASN-siRNA组HepG2细胞增殖被显著抑制,和NC-siRNA组相比差异均有统计学意义(P<0.01,图6)。

图6 FASN基因沉默对HepG2细胞增殖的影响Fig.6 Effect of FASN gene silencing on proliferation of HepG2 cells.**P<0.01,***P<0.001 vs NC-siRNA.
2.7 FASN基因沉默对HepG2细胞凋亡的影响
流式细胞仪结果显示,Control组、NC-siRNA组和FASN-siRNA组的细胞总凋亡率分别为(5.88±0.67)%、(7.34±0.49)%和(36.16±3.64)%。NC-siRNA组细胞总凋亡率与Control组相比有所增加,但差异没有统计学意义(P>0.05),FASN-siRNA 组细胞总凋亡率与NCsiRNA组相比显著增加,差异有统计学意义(P<0.001,图7)。
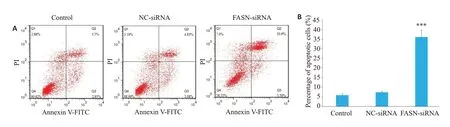
图7 FASN基因沉默对HepG2细胞凋亡的影响Fig.7 Effect of FASN gene silencing on apoptosis of HepG2 cells.A:Annexin V-PI flow cytometry for cell apoptosis.B:Statistical analysis of cell apoptosis detected byAnnexin V-PI flow cytometry.***P<0.001 vs NC-siRNA.
2.8 划痕实验检测FASN基因沉默对HepG2细胞迁移能力的影响
光学显微镜下观察Control 组、NC-siRNA 组和FASN-siRNA组细胞划痕24 h后的愈合程度,结果显示,NC-siRNA组与Control组相比划痕愈合率无统计学差异(P>0.05),但FASN-siRNA组的HepG2细胞划痕愈合率低于NC-siRNA 组,差异有统计学意义(P<0.001,图8)。
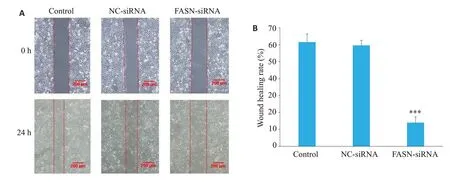
图8 划痕实验检测FASN基因沉默对HepG2细胞迁移能力的影响Fig.8 Effect of FASN gene silencing on migration ability of HepG2 cells by wound healing assay.A:Wound healing assay;B:Wound healing rate.***P<0.001 vs NC-siRNA.
2.9 Transwell 实验检测FASN基因沉默对HepG2细胞迁移能力的影响
Control组、NC-siRNA组和FASN-siRNA组细胞迁移数量分别为59.00±5.40、53.33±4.32和26.67±5.05;NC-siRNA组与Control组相比细胞迁移情况差异无统计学意义(P>0.05),但FASN-siRNA 组发生迁移的HepG2细胞数量低于NC-siRNA组,差异有统计学意义(P<0.001,图9)。
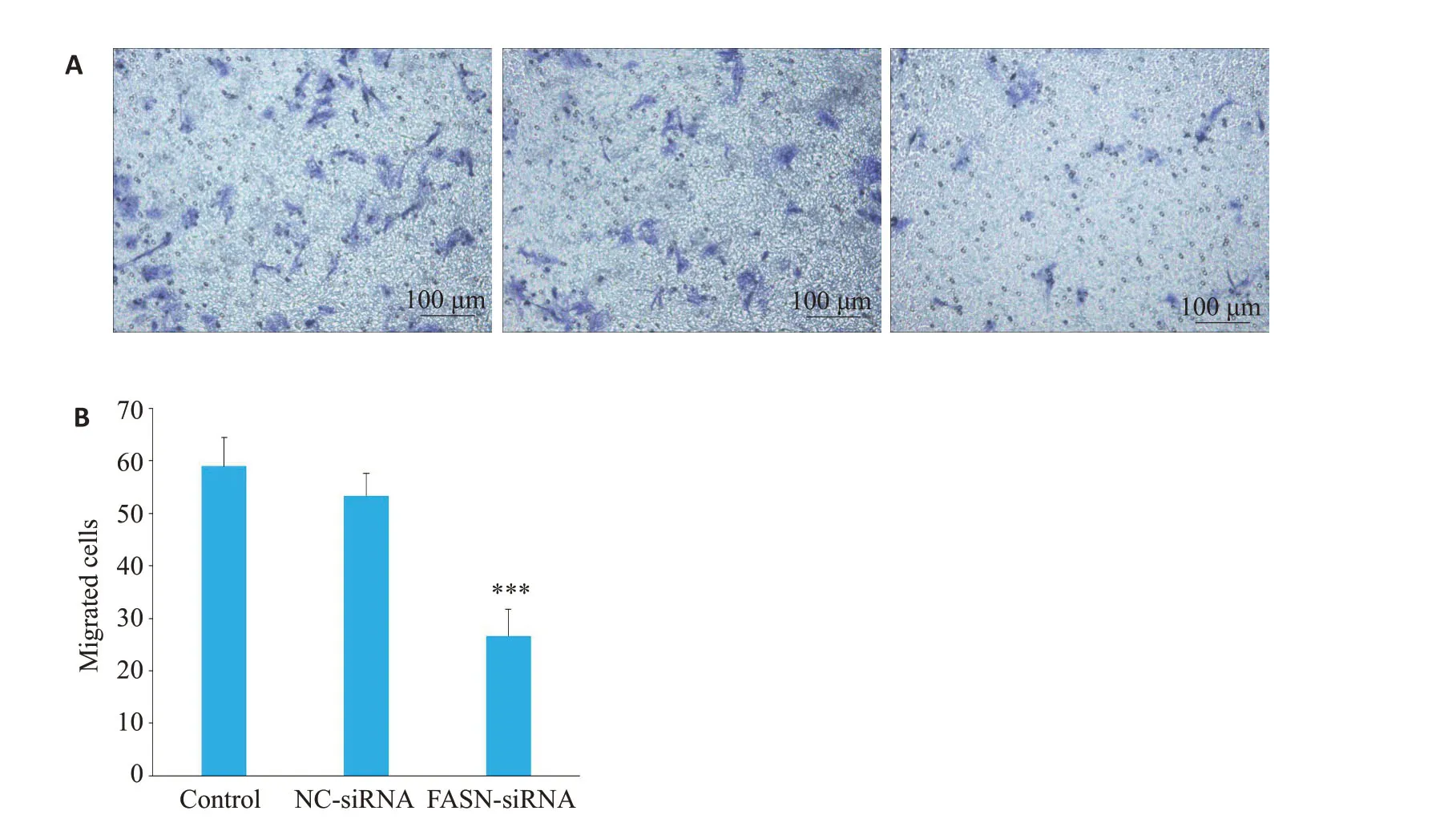
图9 Transwell 实验检测FASN基因沉默对HepG2细胞迁移能力的影响Fig.9 Effect of FASN gene silencing on migration ability of HepG2 cells by Transwell assay.A:Transwell assay.B:Migrated cells.***P<0.001 vs NC-siRNA.
3 讨论
研究显示肿瘤细胞生长所需要的脂肪酸约90%以上来自于从头合成途径[11]。FASN在正常细胞或组织中不表达或表达水平很低,主要用于合成能量储存的甘油三酯[12-13];但在多种恶性肿瘤中FASN呈现高表达[14-15],目前尚未有关于FASN基因对肝母细胞瘤脂质代谢及生物学行为影响的研究报道。本研究以肝母细胞瘤HepG2细胞为研究对象,通过RNAi技术干扰FASN基因的表达后,观察HepG2细胞脂质代谢及生物学行为的变化。前期预实验阶段,课题组设计了3种siRNA片段干扰FASN的表达,通过RT-PCR和Western blot实验检测FASN 基因和蛋白的表达水平,筛选出了FASN mRNA沉默效率最高的siRNA片段并用于后续实验。
FASN被高度激活后可大量合成脂肪酸,用于细胞膜装配、细胞内信号传导、蛋白质酰化等,以上脂质代谢异常在肿瘤发生发展过程中具有重要作用[16]。本研究通过siRNA干扰FASN基因的表达后发现,HepG2细胞中脂滴数和甘油三酯水平均显著降低,提示FASN基因的表达可促进HepG2细胞脂质合成,与Gu等[17]研究结果相一致。本研究进一步证实了FASN作为重要的癌基因在肿瘤脂质代谢过程中发挥着重要的作用。
脂质的代谢紊乱与肿瘤的恶性生物学行为密切相关,研究表明癌细胞通过脂肪酸提供的能量可促进肿瘤的发生发展和转移[18-19]。增殖异常是恶性肿瘤的基本生物学特征,本研究通过CCK-8实验发现,转染FASNsiRNA片段可以显著抑制HepG2细胞增殖。除了细胞增殖异常外,细胞凋亡失衡也是肿瘤发生的重要原因,因此本研究进一步通过流式细胞术观察了沉默FASN基因对HepG2细胞凋亡的影响,结果显示抑制FASN基因的表达可促进HepG2细胞凋亡。有研究发现,敲除内源性FASN基因可抑制胰腺癌细胞HPAC和AsPC-1的增殖并促进其凋亡[20]。有研究发现,轻度抑制FASN的活性可降低乳腺癌细胞MCF-7和MDA-MB-231的克隆形成能力,重度抑制FASN的活性可诱导乳腺癌细胞MCF-7和MDA-MB-231的凋亡[21]。这与本研究结果相一致,同时表明在不同类型的肿瘤细胞中,抑制FASN的表达均可抑制癌细胞的异常增殖并促进其凋亡,这可能与FASN基因被抑制后细胞内脂质合成降低有关。
侵袭、迁移是恶性肿瘤的另一个重要生物学特征。研究发现,敲除结直肠癌细胞系SW480和HT29中的FASN基因,可以下调Wnt5a、Wnt5b、Fzd2基因的表达,从而抑制SW480和HT29细胞的迁移和侵袭[22]。敲除HepG2细胞中的FASN基因可下调P-STAT3、MMP-2和MMP-9蛋白的表达,从而抑制肝癌细胞的迁移和侵袭[23]。本研究通过划痕实验及transwell实验也发现,与NC-siRNA组相比,FASN-siRNA组的HepG2细胞划痕愈合率及细胞迁移数量均显著降低,说明抑制FASN基因的表达降低了HepG2细胞的迁移能力。以上结果表明,FASN基因的表达与多种肿瘤细胞的恶性生物学行为密切相关,同时也表明FASN可能是癌症治疗的潜在有效靶点。
综上所述,本研究通过RNAi技术干扰FASN基因的表达,观察FASN基因沉默对HepG2细胞脂质代谢及恶性生物学行为的影响。结果显示FASN基因和蛋白表达下调后可显著降低HepG2细胞中脂质及甘油三脂的合成,并影响HepG2细胞的增殖、凋亡及迁移等恶性生物学行为。但FASN基因沉默后影响HepG2细胞恶性生物学行为的机制有待进一步研究,这是接下来研究的重点。本课题的开展有助于了解FASN基因在肝母细胞瘤发生发展中的作用,为肝母细胞瘤的靶向治疗提供实验基础。
