多酚的功能性质及与蛋白质、多糖相互作用研究进展
2021-06-15孙冰玉吕铭守刘琳琳朱秀清
曲 敏,陈 强,孙冰玉,吕铭守,刘琳琳,朱秀清
(哈尔滨商业大学食品工程学院,黑龙江省普通高校食品科学与工程重点实验室,黑龙江哈尔滨 150076)
多酚(Polyphenols)是存在于许多高等植物叶片和果实中的一大类重要的次生代谢产物的总称,是具有多种化学结构的多相分子群。在化学结构上具有苯环和多个酚羟基,主要通过莽草酸和丙二酸途径合成[1]。多酚参与了植物体自然抵抗生物和非生物胁迫的机制,使植物可以吸收过多的太阳辐射、清除植物体内自由基、有利于植物受精等多种生理功能[2]。多酚是人类饮食中较为丰富的植物化学物质,多酚的摄入可以提高人体的抗菌作用,同时可以预防抑郁症、糖尿病等慢性疾病[3]。这种作用部分归因于多酚在生物系统中作为抗氧化剂和信号抑制剂的能力,然而自然界存在的多酚多以游离态或者结合态的形式存在,因含有多个酚羟基基团使得它们在光、高温和碱性条件下的化学稳定性差,生物利用度低,所以多酚目前在功能性食品中作为生物活性成分的应用受到了限制[4]。多酚能够与食品中的主要营养物质,如多糖、蛋白质形成共价或非共价化合物,这种结合将增加其物理稳定性,抗氧化活性和生物利用度,进而增加了多酚在功能食品中的应用范围。近年来关于蛋白质-多糖、蛋白质-多酚、多糖-多酚的研究有了进一步的深入,但对于蛋白质-多糖-多酚三者相互作用的研究刚刚起步,本文对多酚的结构与功能之间的关系,多酚与蛋白质、多糖三者相互作用的机理,多酚对二者功能性质的影响及对改善乳化液性质的影响,进行了综述,以期为充分发挥多酚在食品中的活性作用提供理论参考。
1 多酚的结构与功能
1.1 多酚的结构
多酚化学结构上具有一个芳香环以及一个或多个羟基,其结构单位是(C6H6O)(图1)。多酚化合物的羟基数目和位置决定了多酚的类型[5]。根据多酚单位的羟基数量和结合结构,可分为酚酸类、黄酮类、单宁类、木质素类、二苯乙烯类等。目前,被广泛研究的多酚主要为黄酮类和酚酸类[6]。大多数黄酮类多酚通过芳香环A和B通过杂环C连接,根据C环与B环的连接位置和C环的不饱和程度,被分为黄酮、黄酮醇、黄烷酮、黄烷醇、花色苷、二氢黄酮醇,若黄酮类化合物中B环与C-2位置上连接,则该化合物被称为异黄酮[7−8]。酚酸是一类重要的非黄酮类多酚,是一类含有酚醛环和至少一种羧酸功能的物质。天然酚酸分为两个主要基团:羟基苯甲酸(C6-C1)和从苯甲酸中衍生的羟基肉桂酸(C6-C3)[9]。根据羟甲基苯甲酸和羟基肉桂酸芳香环上羟基的位置分类,主要的羟甲基苯甲酸有:水杨酸、没食子酸、奎宁酸;主要的羟基肉桂酸有:苹果酸、阿魏酸和咖啡酸。除了以上的黄酮类和酚酸类多酚物质外,还有一些非黄酮、非酚酸类多酚类物质,如姜黄素、白藜芦醇、辣椒素、黄连素及番茄红素等。

图1 黄酮类多酚的结构Fig.1 The structure of flavonoid polyphenols
1.2 多酚的抗氧化性质
自由基对生物分子造成氧化损伤,导致各种疾病,包括动脉粥样硬化、衰老和癌症等。多酚是一种重要的抗氧化剂,它们能够从酚羟基中贡献电子或羟基,来中和人体中的自由基[10],从而抑制或延缓各类疾病。多酚抗氧化能力与酚类的氧化还原特性呈正相关,而多酚氧化还原特性取决于多酚的空间结构和羟基化程度[11]。
1.2.1 多酚的抗氧化机理 多酚是天然的抗氧化剂,通过两种机制提供氢原子和转移自身的电子将烷氧自由基(ROO·)转化为稳定的物质(ROOH)来体现自身的抗氧化能力[12]。自由基是运动过程中细胞呼吸和正常代谢产生的高度活跃的分子,主要包括超氧阴离子自由基(O2·)、羟基自由基(OH·)等,因为自由基有一个不成对的电子,需要得到一个电子达到稳定,所以呈现强氧化性[13−14]。如图2(a)所示多酚在与自由基反应时可以提供氢原子,氢原子的电子与自由基所带的电子组成一对,生成稳定的物质和基团(PHe-O-),然后基团(PHe-O-)与自由基反应生成稳定物质。如图2(b)所示多酚在给自由基提供电子时,可能会发生自由基重组进行二次还原,具体表现为多酚为自由基提供电子生成基团(ROO-)和(H3O+),然后两个基团反应生成稳定物质和水[15]。两种机制可以同时发生,将体内的自由基还原为稳定的物质,而体现多酚的抗氧化能力。
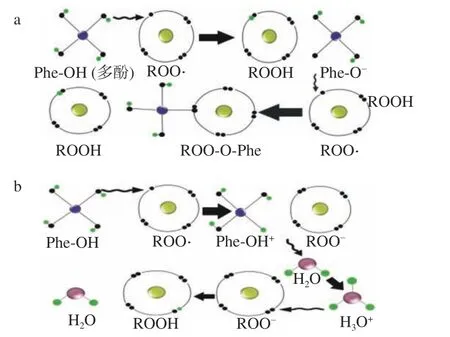
图2 多酚还原自由基提供氢原子机制(a)、多酚还原自由基提供电子机制(b)Fig.2 The mechanism of polyphenols reducing radical to provide hydrogen mechanism (a) and providing electron (b)
1.2.2 羟基化程度与抗氧化性 酚类的抗氧化能力取决羟基的数目。多酚中羟基的数目量与其抗氧化活性呈正相关,多酚作为自由基清除剂,能够通过有效阻止自由基链式反应,消除自由基得电子的能力,避免新的自由基形成[16]。Zhao等[13]在研究绿茶多酚还原生育酚自由基时,发现儿茶素作为自由基清除剂有效性为:表没食子儿茶素没食子酸酯(EGCG)>没食子酸盐(ECG)>表没食子儿茶素(EGC)>表儿茶素(EC),从儿茶素的结构式中(图3)可以看出EGCG有8个羟基、ECG有7个羟基、EGC有6个羟基、EC有5个羟基,证明多酚的羟基数目与还原自由基能力成正相关。范金波等[17]通过钼酸铵法测定芦丁、根皮素、根皮苷的抗氧化活性时发现,芦丁的VC当量为0.684±0.018 mg VCeq/mg,根皮苷的Vc当量0.414±0.037 mg VCeq/mg,根皮素的VC当量0.199±0.012 mg VCeq/mg,且三种多酚的羟基数目大小依次为芦丁>根皮苷>根皮素,与三种多酚总抗氧化能力一致,可见多酚的羟基数目与多酚的抗氧化能力有一定的关系。

图3 儿茶素结构示意图Fig.3 Catechin structure diagram
1.2.3 多酚空间结构与抗氧化性 通过量子化学计算法,将多酚的各个能级换算成具体参数,使多酚的抗氧化性与其空间结构建立起定量构效关系,因此可以从多酚的空间结构分析多酚的抗氧化性。前沿分子轨道能极差△E(△E=EHOMO-ELUMO)是多酚活性的重要理论参数,EHOMO为最高占据轨道能,表现为贡献电子的能力,ELUMO为最低占据轨道能,表现为多酚吸收电子的能力,△E越小,则多酚的电子越容易发生跃迁,反应活性越强,多酚的还原性越高。刘科海等[18]在分析多酚的量子化学参数与自由基清除能力时发现,柚皮素△E=4.6216 eV,柚皮苷△E=4.8659 eV,橙皮素△E=4.6251 eV,橙皮苷△E=4.6872 eV,四种多酚的活性顺序为柚皮素>橙皮素>橙皮苷>柚皮苷,DPPH自由基清除率的顺序为柚皮素(39.94%±0.02%)>橙皮素(35.99%±0.03%)>橙皮苷(28.20%±0.02%)>柚皮苷(19.84%±0.01%)。由此可见,多酚的空间结构决定多酚的抗氧化能力。籍宝霞[19]通过总抗氧化能力法(TECA)、铁还原能力法(FRAP)、HOCl清除能力法、脱氧核糖分析法(·OH清除能力)检测不同多酚的抗氧化能力,根据高斯理论计算程序计算出不同多酚的量子化学计算参数,在分析量子化学参数与抗氧化能力时发现多酚的总电子焓(H)、总熵(S)、能量间隙(△E)与HOCl的清除能力成正相关,多酚的总熵(S)、最高占有轨道能量(EHOMO)与还原TEAC、FRAR能力、·OH清除能力成正相关。表1为多酚的量子化学计算参数与抗氧化能力的相关系数表。由此可以看出多酚的空间结构与多酚抗氧化能力存在着定量构效关系。

表1 多酚的量子化学计算参数与抗氧化能力的相关系数Table 1 The correlation coefficient between the quantum chemical calculation parameters of polyphenols and their antioxidant capacity
1.3 多酚的其他功能性质
自由基是人体代谢过程中产生的活性高分子,由于其具有强氧化性,大量积累会导致癌症、神经衰退等疾病的产生。当机体产生和清除自由基的能力不能达到平衡时而产生的氧化应激反应更是诱发此类疾病的主要原因。多酚可以通过信号通路传递氧化信号直接还原自由基,影响细胞的增殖分化和凋亡,阻断自由基所引发的很多裙带慢性疾病[20]。
1.3.1 癌症预防 多酚在预防和治疗癌症上,主要是通过防止氧化应激反应造成的能量失调、增加抑制细胞生长因子与癌细胞结合、抑制癌细胞的转移和肿瘤血管的形成等[21−22]。常用于抗癌的多酚有白藜芦醇、黄连素、辣椒素等,通过提高癌细胞中的活性氧(ROS)水平和一些ROS相关信号,刺激线粒体释放凋亡诱导因子,进入细胞核促使染色质凝结和核染色体DNA断裂;促进脂肪氧合酶(FAS)的信号转录因子受体附着在配体上,激活半胱天冬酶;通过上调P53因子促进细胞周期激素酶抑制剂(Cip1/P21)的生成,抑制癌细胞复制的G1期,完成癌细胞的ROS依赖性凋亡、FAS依赖性凋亡和P53因子依赖性凋亡[23]。Tairine等[24]以黄连素作为光敏剂治疗肾癌,发现肾癌细胞的活力下降至16.26%,细胞内ROS增加了180.03%,细胞自噬率增加至173.2%,对肾癌细胞有显著的抑制作用。
1.3.2 抗菌性 多酚的抗菌作用机制可能是由于部分疏水性质,使其在与细菌细胞膜的脂质双分子层和脂多糖界面进行相互作用,膜蛋白与磷脂比例发生改变,导致膜结构重组,降低了细菌在易感宿主内引起疾病的能力[25]。且在相互作用的过程中,多酚的羟基又被认为是一价阳离子的穿膜载体,将H+带入细胞质并将K+运出,K+在外流过程中消耗能量,影响了细胞膜的物质运输及细胞膜的通透性和稳定性,造成细胞内物质外泄和微生物死亡[26]。Jatinder等[27]在研究海南蒲桃中多酚的抗菌能力时,分别向金黄色葡萄球菌、大肠杆菌、肺炎克雷伯菌、白念珠菌等培养基中添加0.1 mL浓度为10 mg/mL的多酚溶液,金黄色葡萄球菌、大肠杆菌、肺炎克雷伯菌和白念球菌的抑菌圈直径分为为23、16、15.3和14.3 mm;并指出不同抑菌效果的原因为由于不同细菌细胞壁结构的复杂性,多酚对不同细菌细胞的通透性和稳定性产生了不同的影响。
2 多酚与蛋白质、多糖的相互作用
2.1 多酚-蛋白质的相互作用
多酚与蛋白质的络合被认为是一种高效、安全方便的改进乳化液性能的方法。二者在结合的过程中可以通过共价和非共价两种形式相互作用,结合的形式不同,表现的作用力也不一样,共价结合作用力相对较强,形成化合物不易分解,非共价结合作用力相对较弱,在一定条件下共轭物可以分解为蛋白质和多酚,体现了共轭物的可逆性。蛋白质与多酚无论以哪种形式结合都可以在一定程度上提高各自的理化性质和功能性质[28−29]。
2.1.1 共价结合 多酚与蛋白质的共价结合基于多酚的双酚基很容易被氧化成醌,无论是在植物组织酶促氧化,还是通过分子氧氧化,都可以与多肽的氨基或巯基侧链反应形成共价化合物[30]。常用的结合方法主要包括:自由基接枝法、碱处理法、酶催化法等。
2.1.1.1 自由基接枝法 由基接枝法,也称为自由基聚合反应,是一种提高天然以及合成聚合物性能的方法。该法采用氧化还原引发剂体系(过氧化氢/抗坏血酸),在温室条件下合成多酚与蛋白质的共价复合物,不产生有毒物质,并且可以防止多酚的氧化[31−32]。如图4所示机理,该方法主要以过氧化氢和抗坏血酸氧化还原对作为引发剂,抗坏血酸可以与过氧化氢反应生成抗坏血酸盐和羟基,然后羟基攻击蛋白质侧链上的氢原子,形成一个蛋白质大分子基团,蛋白质侧链上的杂原子中心可以优先与酚环上邻位和对位的羟基进行反应形成多酚蛋白质共轭物(蛋白质-X-多酚)[33]。Lu等[34]采用自由基聚合法制备儿茶素蛋清蛋白聚合物时,发现相比于酶法,过氧化氢-抗坏血酸引发剂体系可以在温室下产生能引发偶联的羟基。该研究中,分别采用1 mg/mL自由基接枝法制备的儿茶素-乳清蛋白共轭物对DPPH自由基的清除率为78.87%±0.93%和0.5 mg/mL儿茶素-乳清蛋白共轭物对ABTS+·的清除率为97.31%±0.16%,而其混合物对DPPH自由基和ABTS+·的清除率则分别为32.08%±0.88%和31.57%±0.85%。可见,自由基接枝法法形成的共轭物具有很强的抗氧化性。
2.1.1.2 碱处理法 蛋白质与多酚之间发生共价化合,酚类可以改变蛋白质的结构、功能和营养特性。在碱性条件下,多酚被氧化形成醌类化合物,缺电子的醌类是一种高度反应的亚基[35],可以通过共价键与蛋白质侧链巯基和氨基发生不可逆的相互作用,蛋白质的乳化性和抗氧化性得到提高[36]。碱处理法是研究多酚与蛋白质共价结合的最常用的方法,图5为多酚与蛋白质反应机理示意图,多酚在碱性条件下氧化为醌类化合物,与蛋白质侧链巯基和氨基反应形成共轭物[37]。Chen等[38]在用单宁酸和绿原酸改性血浆蛋白时,发现采用碱性条件的方法,在pH8.2时,将绿原酸氧化为醌类化合物,然后与血浆蛋白共轭;分别添加浓度为0.5%、1%、1.5%的绿原酸,血浆蛋白共轭物的乳化稳定指数分别为81.39%±0.81%、82.53%±0.84%、85.10%±0.72%,而血浆蛋白本身的乳化稳定指数为69.10%±1.43%,由此可以看出绿原酸的添加可以提高蛋白质共轭物的稳定性。

图4 自由基接枝法机理示意图Fig.4 Schematic diagram of radical grafting mechanism

图5 绿原酸与蛋白质碱处理法反应机理Fig.5 Mechanism of reaction between chlorogenic acid and protein base treatment
2.1.1.3 酶催化法 多酚氧化酶将多酚氧化生成醌类化合物,然后与蛋白质发生反应。多酚氧化酶主要包括邻苯二酚氧化酶和漆酶,在氧气存在的情况下,多酚氧化酶可诱导单酚生成邻二酚,进而用邻二酚酶将其转化为邻醌[39]。生成醌可以容易地与蛋白质链中的亲核氨基酸残基相互作用以形成蛋白质多酚共轭物[40]。贾潇等[41]通过酶催化法交联阿魏酸与大米蛋白,发现大米蛋白的α-螺旋减少了4.32%,β-转角减少了0.93%,无规卷曲增加了1.77%,而β-折叠则呈无规律变化。无规则卷曲的增加表明漆酶催化阿魏酸和大米蛋白交联可以使蛋白质的结构更为灵活和延伸。
2.1.2 非共价结合 蛋白质与多酚之间的非共价相互作用通常是可逆的,作用力也弱于共价相互作用。一般来说,蛋白质-多酚共轭物形成所需的作用力主要为氢键和疏水相互作用。多酚被称为优良的氢供体,它可以与蛋白质的C=O形成氢键。此外,氢键也是通过多酚的OH基团与蛋白质的羟基(-OH)和氨基(-NH2)基团相互作用而形成[42]。Fang等[43]在用紫外分光(UV)光谱法研究槲皮素与牛血清白蛋白二者相互作用时,发现槲皮素在365 nm处有最大吸收峰,加入牛血清白蛋白后,最大吸收峰发生微小的红移,其原因为槲皮素的显色集团与蛋白质的显色基团如OH、NH2、SH之间生成了氢键,导致了减少ππ跃迁能量的增色。Mehdi等[44]在制备乳清蛋白和姜黄素络合物时,发现乳清蛋白可以提高姜黄素的可溶性,当pH为2时,姜黄素与乳清蛋白络合可使其水溶性提高180倍。由此可以看出蛋白质与多酚之间的非共价化合可以改善部分多酚的功能性质。
影响蛋白质和多酚二者非共价结合的因素有温度、pH、蛋白质的结构及其浓度、多酚的类型及结构等。Cheryl等[45]利用乳清分离蛋白络合提高模型饮料中花青素色的稳定性,在研究中发现蛋白质分子与花青素之间的结合位点随着温度的升高而减少,表明温度越高,乳清分离蛋白与花青素之间氢键作用作用力越弱。Wang等[46]在研究蛋白质-多酚共轭物,在较低pH(pH<7)时,蛋白质发生解离,导致蛋白质与多酚相互作用的结合位点暴露,二者之间通过静电相互作用共轭。然而当pH>7时,蛋白质和多酚之间发生非酶氧化,多酚容易被氧化成反应自由基和醌类化合物。
影响蛋白质和多酚非共价结合的因素还有多酚的分子大小,分子较大的多酚结合能力较强。Chanphai等[47]在研究不同多酚对乳蛋白负载效率的影响时,发现乳蛋白对单分子的多酚负载率较高,且负载率因分子大小而不同。其中,表没食子儿茶素没食子酸酯(50%)>表儿茶素没食子酸酯(45%)>表儿茶素(40%)>儿茶素(35%)。此外,多酚与蛋白质的结合能力还受到蛋白质表面性质的影响,未折叠的蛋白质对多酚的亲和力强于球状蛋白质。Tugba等[30]发现牛血清蛋白和人血清白蛋白于多酚的结合能力高于β-乳球蛋白和溶菌酶,主要原因为牛血清蛋白和人血清白蛋中含有未折叠的蛋白质氨基酸残基,它们与多酚相互作用的可能性较高,高于β-乳球蛋白和溶菌酶中高度折叠的球状蛋白质。因此在制备多酚和蛋白质非共价共轭物时,蛋白质和多酚的结构和类型、结合温度和pH是影响结合力的主要因素。
2.2 多酚-多糖的相互作用
多酚和多糖之间的相互作用,既可以保持多酚原有的活性,还可以在多糖-多酚共轭物中引入有益的特性。多糖在结合多酚后,可以增加多糖的溶解速率和降低多糖溶液的黏度。多糖和多酚之间的相互作用可以分为共价结合和非共价结合两种形式。
2.2.1 非共价结合 非共价结合的形式包括氢键、范德华力和疏水相互作用。多酚、多糖具有许多羟基,为它们之间氢键的形成提供了可能,由于多酚和多糖具有能产生极化分子的官能团,如果先建立氢键,多酚和多糖分子间的距离就会变短,则有形成范德华力的可能[48−49]。Zhang等[50]采用添加乙醇的方法测定乙醇对阿拉伯果胶吸附阿魏酸的影响时发现,随着乙醇浓度的增加,阿拉伯果胶对阿魏酸的吸附量下降约350 μg/mg,而对照组中随着NaCl浓度的添加其吸附量下降仅为19 μg/mg。证明阿拉伯果胶与阿魏酸之间形成氢键,而乙醇的羟基具有很强的争夺氢键的能力。Watrelot等[51]在分析苹果果胶与花青素的热力贡献时表明,与放热有关的焓贡献为△H=−5.4 kJ·mol−1熵驱动为−T△S=−11.9 kJ·mol−1,因为氢键为焓驱动,疏水作用为熵驱动,可确定苹果果胶与花青素之间存在氢键和疏水作用两种作用力。
2.2.2 共价结合 自由基接枝是形成多糖-多酚共轭物最常用的方法之一。这种方法快速且环保,无需有机溶剂或有毒的自由基引发剂,由氧化还原对(抗坏血酸/过氧化氢)相互作用产生的羟基自由基攻击多糖分子中的敏感基团,形成多糖大分子自由基可以与多酚发生氧化还原反应,促进多糖-多酚共价键的形成[30]。天然多糖具有很多良好的理化性质,如生物相容性、生物降解性、抗菌性等,而部分不易溶解的多糖使其在食品中的应用受到了限制,接枝亲水官能团是提高这类多糖溶解性最常用的方法。多酚具有良好的水溶性是合成水溶性多糖的理想材料。Curcio等[31]采用自由基接枝法将没食子酸接枝到壳聚糖上赋予中性不溶的壳聚糖溶解性。多糖-多酚共轭物也可以通过碳二亚胺介导法制备,其原理为含氨基的分子与含羧基的分子之间形成酰胺键,且得到的复合物具有良好的水溶性、抗氧化能力[52]。多酚与多糖二者共价键也可以通过多酚氧化酶激活与多糖发生聚合反应形成[53]。其原理是在有氧的情况下通过酶将酚类氧化成醌类,然后与多糖发生聚合。常用的酶类有脂肪酶、漆酶、转谷氨酰胺酶。
2.3 多酚-蛋白质-多糖的相互作用
由于多酚易氧化成醌类化合物,它们可以与亲核分子发生共价反应,使得多酚具有高反应活性,能够与各种化合物相互作用[54]。多酚类的多极性官能团与蛋白质和多糖暴露的羟基或氨基相互作用,生成氢键或者共价键,从而改变这些大分子生物活性[55]。图6为蛋白质-多酚-多糖复合物制备方法的示意图,在制备多酚多糖蛋白质共轭物时,通常先制备蛋白质多酚共轭物作用力为氢键或者共价键,然后再与多糖共轭。Liu等[56]在研究新型乳化剂时,将乳铁蛋白、果胶、绿原酸共价结合在一起时,发现乳铁蛋白变性温度为97.3±0.03 ℃,乳铁蛋白和绿原酸共轭物变性温度101.42±0.05 ℃,乳铁蛋白、绿原酸和果胶共轭物的变性温度为110.31±0.01 ℃,三者混合物的变性温度为105.81±0.07 ℃,证明三元共轭物比单一的乳铁蛋白具有更好的热稳定性。自然界中植物可以通过蛋白质、多酚、多糖复合抑菌来提高生存能力。Sabrine等[57]在研究突尼斯海藻中的抗氧化及抗菌活性时,发现突尼斯海藻中蛋白质-多酚-多糖复合物有明显的抑菌作用,在革兰氏阴性菌中,只有肺炎克雷伯菌对复合物敏感,且抑菌区直径为8 mm,最低抑菌浓度为40 mg/mL;所有的革兰氏阳性菌都对复合物敏感,最敏感的为金色葡萄球菌,抑菌区直径为19 mm,最低抑菌浓度为10 mg/mL。在食品加工过程中通常利用多酚、蛋白质、多糖相互作用的特性提高食品的感官品质,因为酚类物质与口腔中唾液蛋白、糖蛋白发生沉淀反应,引起口腔上皮干燥、粗糙和褶皱的口腔感觉,称之为酒涩和茶涩,形成了酚类物质独特的收敛性质[58],而在红酒和茶中添加一些多糖,多糖与多酚物质在与蛋白质结合时发生竞争作用,而使其收敛性得以降低,提高了红酒的感官品质[51]。

图6 制备蛋白质多酚多糖共轭物方法示意图Fig.6 Schematic diagram of preparation method of protein polyphenol polysaccharide conjugate
3 多酚与蛋白质、多糖作用对改善乳化液性质的影响
3.1 乳化性质
在制备微胶囊或者乳化剂时,通常选用的壁材为蛋白质和多糖,多酚与蛋白质和多糖结合时,会改变蛋白质和多糖的界面性质,对乳化液的乳化特性和凝胶特性产生一定的影响[59]。蛋白质的构象是蛋白质乳化性能的主要因素,多酚在与蛋白质结合时,暴露处的部分疏水结构可以改变蛋白质的构象,增加蛋白质的不规则卷曲,从而提高了蛋白质的乳化活性。Wei等[60]在研究EGCG对蛋清蛋白功能性质的影响时,比较了蛋清蛋白、蛋清蛋白-EGCG偶联物的乳化活性,蛋清蛋白的乳化活性(ESI)在35 min左右,共轭物的乳化活性(ESI)在100 min以上,证明了EGCG对蛋白质的乳化活性有一定的影响。刘英杰等[61]在研究花青素对大豆分离蛋白功能性质的影响时,大豆分离蛋白的乳化性为50%左右,当蛋白质溶液中花青素的浓度为0.025%时,乳化性提升了90%左右。Morfo等[62]在制备乳清蛋白和姜黄素Pickering乳液时,发现油包水型的液滴,随着不溶性的多酚姜黄素的添加,液滴的稳定性随之增加,未加入姜黄素的液滴维持时间不超过24 h,而加入0.14%的姜黄素的液滴可以维持数周不分散。由此可以看出多酚可以提高乳化液的稳定性。
3.2 凝胶性
多酚对蛋白质有很高的亲和力,由于多酚与蛋白质的结合通常发生在侧链氨基上,为蛋白质表面提供更多的氢键,而氢键作为蛋白质形成网状结构凝胶的重要作用力,因此多酚有促进蛋白质凝胶的作用。Mariana等[63]在分析绿茶多酚对β-乳球蛋白凝胶化的影响时发现,当蛋白质胶体溶液pH为4.5时,随着绿茶多酚含量的增加,蛋白质胶体的弹性、凝胶粘度也随之增加。Cura等[64]在研究酪蛋白酸钠的凝胶特性时,发现在酪蛋白酸钠溶液中加入漆酶和阿魏酸可以提高溶液的凝胶强度,因为漆酶可以促进阿魏酸与酪蛋白酸钠共价键的形成,在测定溶液剪切力时发现,添加25 nkat/g漆酶的酪蛋白酸钠溶液和添加2.5 mmol阿魏酸的酪蛋白酸钠溶液的剪切力均在1 N以下,而联合添加25 nkat/g的漆酶、2.5 mmol阿魏酸及5%酪蛋白酸钠溶液的剪切力在1.5 N左右,且漆酶的浓度越高溶液的凝胶强度越强。由此可以看出多酚的添加可以提高蛋白质的凝胶能力。
3.3 界面特性

图7 多酚对蛋白质乳化剂界面性质的影响Fig.7 Effects of polyphenols on interfacial properties of protein emulsifiers
在分析乳化液的界面特性时,两个主要的指标分别为膜的表面压力和表面扩张弹性,表面压力值曲线的斜率反映的是乳化剂的扩散系数,扩散系数表现为乳化剂在油水界面的扩散能力,表面扩张弹性表现为乳化剂形成膜的弹性流变性。多酚在与蛋白质相互作用时,多酚会在氨基酸疏水侧链上堆积,使蛋白质的疏水结构无法在油水界面上完全扩散,导致蛋白质乳化剂表面活性降低,油水界面膜的表面压力减小。多酚与蛋白质结合使分子间的疏水作用增强,界面膜的厚度和密度上升,导致界面膜的机械强度增强,界面表面弹性减小,图7为多酚对蛋白质界面性质影响的示意图。Mariana等[65]在分析绿茶多酚与β-乳球蛋白复合物对鱼油界面影响时,发现随着绿茶多酚浓度的添加,β-乳球蛋白的扩散系数减小,绿茶多酚的浓度为0.25%,扩散系数为18 mNm−1·s−0.5,绿茶多酚浓度为0.5%,扩散系数为16.2 mNm−1·s−0.5,界面膜的表面扩张弹性也随着多酚浓度的增加而减小。Silvio等[59]在分析绿茶多酚-乳清蛋白复合物作为乳化剂时,发现多酚延缓蛋白质在油水界面的扩散,降低蛋白质乳化液油水界面膜的表秒扩张弹性和表面张力。由此可说明多酚的添加会降低蛋白质乳化液的界面性质。
4 展望
多酚的功能性质一直以来广泛引起人们关注。多酚不仅具有抗氧化、抗菌、预防和治疗慢性疾病的等生理作用,而且在食品工业、医药保健、生物膜材料等领域都有着巨大的应用价值。基于多酚对蛋白质和多糖功能特性的提高,将多酚-蛋白质-多糖共轭物应用于食品功能性因子传递系统的构建,分析多酚-蛋白质-多糖共轭物对传递系统功能因子的物理和化学稳态作用,及对生物利用率等影响。探究多酚-蛋白质-多糖共轭物的动力学与热力学规律,及多酚的生物活性对其他生物大分子的影响等,能为提高食品品质提供更加科学的理论依据。但多酚因其种类繁多和结构复杂,在与其他生物大分子结合时,很容易产生新生化合物,如果将这种化合物应用到食品工业中可能会存在安全性问题,这是在今后的研究中值得注意的。
