牛乳来源外泌体的生物学功能研究进展
2021-06-15周志立黄桂东钟先锋张宇博
周志立,黄桂东,2,3,4,钟先锋,3,4,5,张宇博,2,3,5,
(1.佛山科学技术学院食品科学与工程学院,广东佛山 528231;2.广东省传统发酵食品工程技术研究中心,广东佛山 528231;3.广东省食品流通安全控制工程技术研究中心,广东佛山 528231;4.佛山市酿造工程技术研究中心,广东佛山 528231;5.佛山农业生物制造工程技术研究中心,广东佛山 528231)
外泌体是由特定细胞分泌的微小囊泡,具有脂质双层膜结构,通常呈圆形或杯型[1],在大多数真核生物的体液中存在,如血液、尿液、唾液、以及乳液[2]。外泌体有着独特的形成途径,其前身是细胞内的多囊泡体(multivesicular body,MVB)中的一类腔内囊泡(intralumenal vesicles,ILV),在一定条件作用下MVB能够与细胞膜融合,通过胞吐的运输形式将这些囊泡释放到胞外基质从而形成了外泌体。有研究表明,外泌体也是一种通过其携带的特定miRNA和调控蛋白等物质实现细胞间通讯的关键介质[3−4]。许多研究者还利用外泌体具有与受体细胞相互作用的能力,将其作为天然的纳米载体进行药物的递送[5−8]。
牛乳是日常补充营养的饮品之一,是能量、营养素、钙、蛋白质和维生素的有效来源[9]。巴氏杀菌可以有效杀灭牛乳中的病菌但不影响维生素和外泌体等有机化合物[10−12]。目前,国内对于牛乳外泌体的研究主要集中在外泌体的提取和鉴定[13−14]以及作为药物运输载体、疾病筛查标志物[15]的研究上,对牛乳外泌体及其携带成分的生物学功能研究较少。而国外关于牛乳外泌体的生物学功能研究报道较多。研究表明,牛乳外泌体不仅对人体免疫系统和肠道发育起着重要作用[16−19],还能帮助人体预防一些疾病和缓解癌症[20]。同样也有报道指出,牛乳外泌体所携带的内含物还可能会给罹患肥胖、II型糖尿病等慢性疾病的发展带来风险[21]。据此,本文综述了牛乳外泌体的组成、形成途径、生物学功能和对人体的潜在风险,旨在为国内牛乳外泌体的研究与开发提供参考。
1 外泌体的组成与发现
外泌体是由细胞内的MVB与质膜融合后将其内部的ILV释放出胞外基质中的一种纳米级囊泡(如图1所示),大小约为30~200 nm[22]。外泌体的主要成分为蛋白质、核酸、脂质等[23],具有脂质双层膜结构,该脂质双层膜结构富含胆固醇、鞘磷脂和神经节苷脂GM3及长/短链饱和脂肪酸[24−25]。不同来源细胞所分泌的外泌体在组成成分上存在一定差异,不过大多数外泌体表面都有着细胞特异性受体和相类似的标志蛋白,如Alixs、HSP70、 CD63、CD81、CD9等[26],而这些蛋白目前主要被用于外泌体分离鉴定时的靶标。外泌体在传统透射电子显微镜下观察时,通常呈现简单的圆形或杯型,但通过冷冻电子显微镜观察,它们却表现为由双叶膜包围的圆形结构[27]。

图1 外泌体是MVB通过独特的生物形成途径形成的细胞外囊泡Fig.1 Exosomes are extracellular vesicles formed by MVB through a unique biological pathway
1983年,Stahl小组[28]和Johnstone小组[29]首次发现外泌体,当时并未称其为外泌体。他们发现,在成熟的哺乳动物网织细胞内体中,转铁蛋白受体和一些其他与膜相关的元素在MVB中形成一种囊泡的结合形式,然后这些囊泡被胞吐释放到细胞外基质。1987年,Johnstone小组[30]进行深入研究后将这些胞外囊泡命名为“Exosome”,即外泌体。当时,外泌体的发现并没有引起重视,仅仅被视为是细胞自身处理多余成分的一种手段。不过,在随后九十年代末,有研究者研究发现外泌体可能是细胞间通讯的重要媒介[31]。Hadley等[32]在研究人类羊膜上皮细胞时发现,该细胞分泌的外泌体会诱导子宫细胞的炎症反应增强,增加产妇妊娠细胞的炎症反应,进而发出分娩信号。同时有研究者还发现,同一种类型细胞产生的外泌体可以去刺激另外一种不同系的细胞。比如,来自人类骨髓间充质干细胞的外泌体可通过将肝细胞生长因子-1受体mRNA转移至肾小管细胞,进而刺激近端肾小管细胞增殖[33]。外泌体亦可以作为一种载体去传递亲水性或者亲脂性的小分子,包括一些治疗药物。因为其传递特性,外泌体能有效克服一些药物口服时生物利用度差的局限性,降低总给药量,最大程度减少或去除因大剂量摄入某些物质所带来的副作用[34]。总的来说,目前外泌体在参与生理学[35]、免疫学[36]和代谢相关[37]研究方面已经成为了广泛关注的主题。
2 外泌体的形成和释放
外泌体的形成和释放,以及将蛋白、核酸等生物分子物质分选载入外泌体内的过程是一种高度调控的机制,非常依赖内体运输分拣复合物(endosomal sorting complex required for transport,ESCRT)所引导的运输机制[38]。ESCRT为细胞膜塑形蛋白,能介导内吞囊泡出芽,加速外泌体的形成。ESCRT可分为ESCRT-0、ESCRT-I、ESCRT-II和ESCRT-III,它们是组成ESCRT机制的4种复合物[39],而这些复合物能够将具有泛素化状态的生物分子物质装载入ILV中[40–42]。
细胞为了释放外泌体,首先让细胞质膜向内出芽形成了早期的内体,随后逐渐转化为成熟的晚期内体。此时,细胞内的蛋白、核酸等活性物质在ESCRT机制下被选择性地吸收到囊泡中,形成了神经酰胺依赖型的ILV[43]。晚期内体的内部在形成了带有携带物的ILV后便成为了MVB,这些MVB可能被溶酶体降解,也可能向细胞外释放ILV形成外泌体[44]。而某些Rab蛋白家族成员,如Rab27A和Rab27B则是外泌体释放的关键介质,它们通过引导MVB向细胞外周运动以接近细胞膜[45],然后通过可溶性N-乙基马来酰亚胺(the soluble N-ethyl maleimide,NEM)和敏感因子附着蛋白受体(sensitive factor attachment protein re-ceptor,SNARE) 复合物的作用下驱动MVB与膜融合(如图2所示),促进了外泌体的分泌[46]。值得注意的是, MVB的命运可能由其内部ILV的胆固醇含量决定。有研究报道指出,MVB中的ILV富含胆固醇则ILV就会被释放出胞外,而ILV缺乏胆固醇则会连同MVB一起被送到溶酶体进行降解回收[47]。这可能是因为ILV储存胆固醇等物质过高会引起的溶酶体功能障碍,从而促使MVB被释放到细胞外空间,以维持细胞稳态[48]。

图2 外泌体的形成和释放Fig.2 Formation and release of exosomes
目前大多数研究报道对于ILV何时会被分泌出细胞外形成外泌体,何时会被溶酶体降解的分子机制尚无确切定论,外泌体的形成途径还需进一步深入系统研究。
3 牛乳来源外泌体对人体有益的功能特性
3.1 牛乳外泌体与人体免疫调控
牛乳在人们日常饮食生活中必不可少,是健康饮食的标志之一,除了富含营养,牛乳还含有许多功能因子和免疫活性相关的蛋白和核酸等[49]。有研究表明,市面上销售的牛乳经过巴氏杀菌后并不会破坏外泌体结构。外泌体可以在不同消化液(包括唾液、胃液、胰液和胆汁)中保留生物活性,所以人体可以通过饮食摄入并吸收牛乳外泌体[50]。当外泌体到达肠粘膜时,会发生两个不同的过程:外泌体被分解,随后携带物被转移到内源性外泌体进一步运输再发挥特定作用;外泌体完好无损地通过肠粘膜,到达肝脏、脾脏和肾脏后,其内含物被释放到相应组织部位的靶细胞,发挥特定作用[51−52]。
牛乳外泌体中含有丰富的miRNA,miRNA是一种内源性非编码RNA,在基因表达调控中发挥着重要作用[53]。有研究报道指出,牛乳外泌体的miRNA能直接作用于目的基因的mRNA以调节相应功能蛋白的表达,进而参与各种免疫调控反应[54]。张嘉齐[55]从牦牛乳外泌体中提取出miRNA并进行了高通量测序分析,筛选出251个差异表达的miRNA。对这些miRNA进行 GO和KEGG富集分析,结果表明,牦牛乳外泌体miRNA作用的靶基因参与了多种信号通路、细胞迁移、细胞迁移调节等生物学过程。牛乳外泌体的内含物miR-423-5p与人体免疫调控相关。Xie等[56]研究发现,集落刺激因子(colony stimulating factor 1,CSF1)是miR-423-5p的靶基因。miR-423-5p的不足会增加CSF1表达,这可能会导致粒细胞的大量增殖和雌激素的过度分泌,从而产生卵巢高反应的风险。该研究表明了牛乳外泌体可能可以用来调节卵巢排卵,避免卵巢高反应的发生。Liu等[57]在对miRNA的研究中,同样发现牛乳外泌体所携带的miR-151-3p(表1)能够作用于信号转导及转录激活因子(signal transducer and activator,STAT3)的3’-非 翻 译 区(3’-untranslated Region,3’-UTR),从而抑制STAT3的表达,促进了白介素-6(interleukin-6,IL-6)的产生,而IL-6是先天免疫应答和炎症的重要调控因子[68]。因此可以推测出miR-151-3p具有阻止先天免疫系统过度激活的功能。从上述研究可以看出,牛乳外泌体中的miRNA成分可能对于一些免疫异常所引发的疾病有调节作用。
牛乳外泌体中的miR-200c也与许多免疫抑制因子的生成有关,在Rogers等[62]的研究中,miR-200c(表1)能够通过靶向色氨酸-2,3-双加氧酶(tryptophan-2,3-dioxygenase,TDO2)的3’-UTR抑制TDO2的表达,进而导致免疫抑制代谢物犬尿氨酸的产量减少。此外TDO2的表达量减少同样抑制了许多编码免疫抑制因子的基因表达,包括PD-L1/2、HMOX1和GDF15。miR-200c对TDO2的调控机制可能是为了防止母亲在怀孕时的免疫系统过度表达,以确保处于妊娠时期胎儿免受母亲免疫系统的攻击。因此,孕妇或许可以服用相关含有牛乳外泌体成分的保健品,用于调节自身的免疫系统以确保胎儿的健康发育。Sun等[69]研究了牛乳外泌体的物理结构对于转移miRNA进入细胞的影响,在模拟胃肠道酸性环境的条件下,通过超声破坏了外泌体的结构后,发现外泌体携带的miRNA不能进入培养细胞内,也不能增加细胞miRNA的水平,对机体的免疫调节功能明显减弱。总的来说,牛乳外泌体的物理结构对于转移miRNA到细胞内以及后续对机体的免疫调节具有不可或缺的作用。
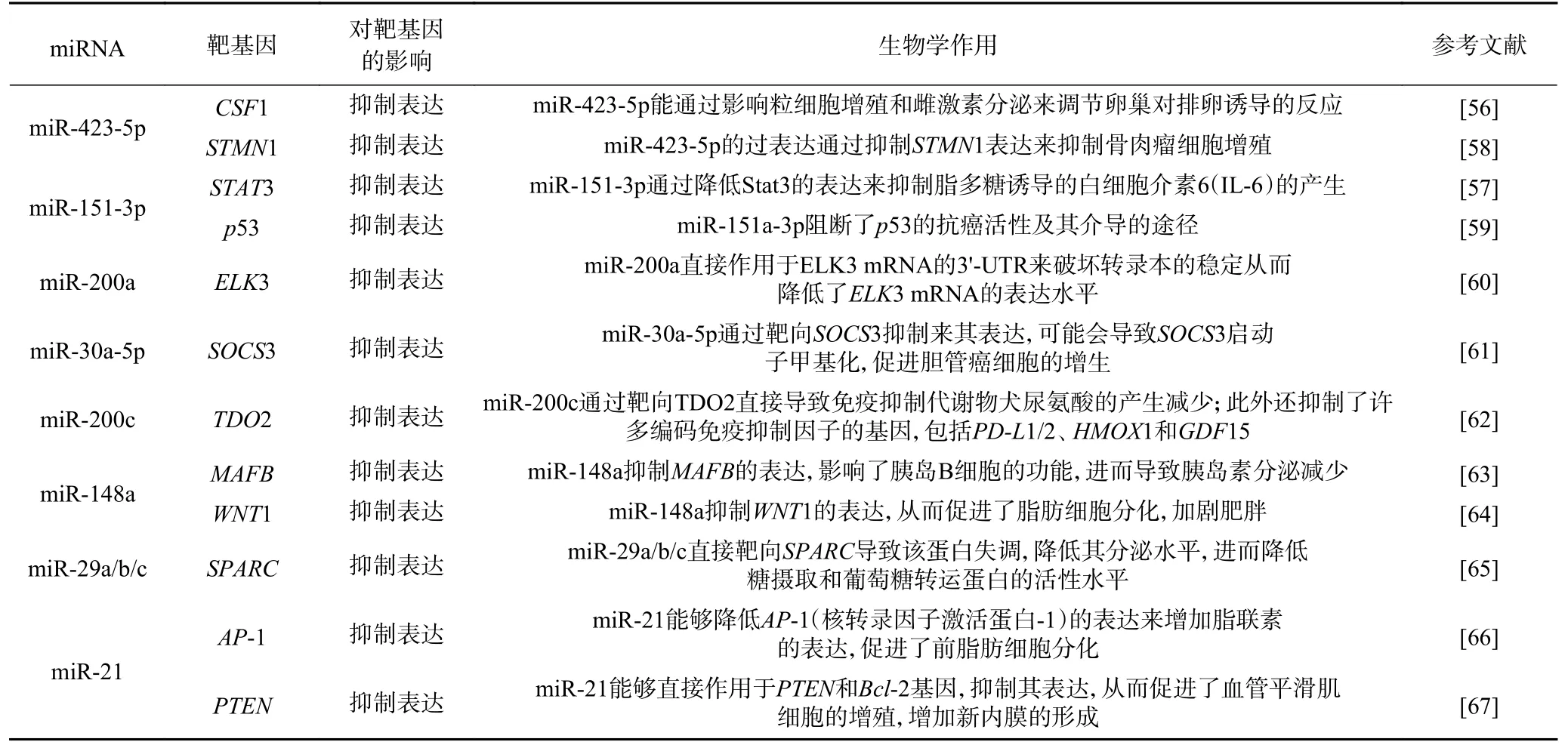
表1 牛乳外泌体中部分的miRNATable 1 Partial miRNA in cow milk exosomes
牛乳外泌体还含有丰富的免疫蛋白。Reinhardt等[70]以健康的荷斯坦奶牛的牛乳作为研究对象,鉴定出了牛乳外泌体中的2107个蛋白质,然后通过GO富集和KEGG途径分析发现牛乳外泌体蛋白质组有影响牛乳中免疫细胞的机制。且牛乳外泌体中免疫相关的蛋白可以在免疫反应中直接发挥作用。例如,主要组织相容性复合体I类分子(major histocompatibility complex I,MHCI)存在于牛奶外泌体的外表面。外泌体向同源T细胞表达MHCⅠ类抗原,导致免疫细胞特异性结合和活化。这表明了外泌体中的蛋白质能对机体的免疫功能具有一定的调节作用。Samuel等[71]在牛初乳和成熟乳外泌体的蛋白质组中共鉴定出8124和4443个独特蛋白质,随后使用FunRich工具进行功能富集分析,结果表明,来自牛初乳样品的外泌体富含与先天免疫反应、细胞生长和补体激活有关的蛋白质。上述研究表明,牛乳外泌体对人体的免疫调节功能之一是外泌体携带的一些免疫蛋白能够被吸收而发挥作用,因此可将牛乳外泌体中的免疫蛋白添加至一些乳制品中,如婴幼儿配方奶粉。然而,奶粉加工中的加热及均质处理是必要的操作单元,加热及均质处理会对牛乳外泌体中免疫蛋白的生物活性带来负面影响[72]。或许在奶粉喷雾干燥这一步骤通过干混加入牛乳外泌体可以避免上述影响,最大程度地保护牛乳外泌体免疫蛋白的生理活性。
上述的研究都表明了牛乳外泌体及其携带的核酸和蛋白质等成分对于人体的免疫功能具有一定的帮助作用,为外泌体对人体的免疫调节功能的研究以及相关免疫制剂产品开发提供了理论依据。
3.2 牛乳外泌体与人体肠道的发育
胃肠道系统是人体中最大的屏障组织,在人体健康状态下,肠道可以起到吸收营养以及特异性免疫的作用[73]。同样,肠道在调节人体,特别是婴幼儿的健康方面发挥着非常重要的作用。有许多研究表明,牛乳外泌体在人体肠道发育方面具有重要作用。高海娜[74]研究了牦牛乳外泌体缓解小鼠肠隐窝上皮细胞(intestinal crypt epithelial cells,IEC-6)缺氧损伤的作用机制。研究表明,牛乳外泌体在缺氧条件下能被IEC-6细胞摄取,进而更有效的激活HIF信号通路蛋白,抑制p53(tumor suppressor gene p53,p53)蛋白,增加IEC-6细胞的存活,调节肠道屏障功能。同样,Gao等[75]的研究也指出牛乳外泌体能够直接通过降低肠道上皮细胞中的p53抑癌基因的表达以及调控肠道上皮细胞的抗缺氧能力,从而显著促进细胞生成,进一步参与肠发育、肠表型的保持和维持。
牛乳外泌体还能够通过减轻一些肠道疾病的功能来帮助肠道的发育。坏死性小肠结肠炎[76](necrotizing enterocolitis,NEC)是一种在出生体重极低的婴儿中的破坏性肠道疾病,死亡率高达50%。Li等[77]研究表明,牛乳来源的外泌体可以有效预防NEC的进一步发展,提升肠上皮细胞的生存力,并刺激肠干细胞活性来促进肠上皮细胞的增殖,同时还能作用于葡萄糖调节蛋白94(glucose-regulated protein 94,GRP94),帮助蛋白质的合成来防止肠损伤的恶化。上述研究表明,牛乳外泌体可以通过促进肠细胞的增殖和预防某些肠道疾病,进而有助于肠道发育。而且牛乳外泌体能够将蛋白质、核酸等活性分子转运到人体的肠道系统,保护它们免受降解和消化,并使这些活性分子被肠道完整地吸收。这也是牛乳外泌体介导人体肠道发育关键的一步。
牛乳外泌体还能够刺激肠道微生物的生长,而促进肠道益生菌生长是肠道健康生长发育的主要驱动力之一[78]。在Zhou等[79]的研究中,对一组小鼠喂养一般的牛乳,而对另一组小鼠喂养已被破坏了外泌体结构的牛乳,然后将这两组小鼠肠道的微生物生长情况进行对比观察实验。结果表明,喂养一般牛乳的小鼠相比于另一组小鼠而言,肠道微生物的生长得到显著地促进。而且还有相关研究表明了牛奶外泌体可以被大肠杆菌K-12 MG1655和植物乳杆菌WCFS吸收利用[80]。上述结果表明,牛乳外泌体具有促进微生物生长的功能,或者可以将这一特性用于促进人体肠道益生菌的生长来帮助肠道的发育。
近年来,牛乳外泌体已被证实能通过促进人体肠道细胞的增殖来帮助肠道发育,这意味着牛乳外泌体有潜力去作为一种新型益生元制剂以应用于调节人体肠道。且根据研究结果可以看出,牛乳外泌体对肠道微生物的生长有一定的帮助作用,但对于牛乳外泌体在人体肠道中微生物的组成中起到的调控作用是否对人体一定有利,尚无明确定论,目前这方面的研究报道还比较少,是值得深入研究的方向之一。
3.3 牛乳外泌体其他有益功能特性
最近研究表明,牛乳外泌体在改善关节炎方面具有一定作用。Arntz等[81]研究了牛乳外泌体对小鼠关节炎的影响,小鼠经口服牛乳外泌体后,两种不同模型的骨髓炎症的症状明显减轻,同时也降低了由脾细胞产生的单核细胞趋化蛋白-1(MCP-1)和IL-6的血清水平,这表明了口服牛乳外泌体可能可以运用于治疗关节炎。牛乳外泌体所携带的miRNA分子还有一定的抗癌作用。Wang等[58]研究发现miR-423-5p(表1)能通过抑制STMN1 (stathmin1)的表达来抑制骨肉瘤细胞增殖,进而在骨肉瘤中起抑癌基因的作用。Kim等[60]研究报道,miR-200a(表1)能直接作用于ELK3(ETS 转录因子)mRNA的3'-UTR,破坏了转录本的稳定从而降低了ELK3 mRNA的表达水平,间接削弱了三阴性乳腺癌细胞的迁移和侵袭。上述研究结果为牛乳外泌体作为一些疾病的治疗药物的开发提供了理论依据。
4 牛乳来源外泌体对人体潜在的风险
4.1 牛乳外泌体与肥胖风险
随着人们生活水平的提高,肥胖的人群也越来越多,肥胖症在全世界已经成为非常严重的健康问题之一。肥胖与许多慢性疾病相关,尤其是增加了高血压、II型糖尿病以及心血管类疾病的患病风险[82]。牛乳外泌体中常见的miR-148a转录因子已被鉴定为人类肥胖风险因子。Shi等[64]研究报道指出,miR-148a(表1)能通过与其相应的靶基因WNT1(一种脂肪生成的内源性抑制剂)结合以抑制WNT1的表达,从而促进了脂肪细胞的分化。Shi等[83]在之后的研究中进一步地揭露了miR-148a与肥胖之间的关系,当一个肥胖个体体内的miR-148a过量表达时,瘦素和抵抗素也会通过负反馈抑制miR-148a的表达。而且miR-148a的启动子活性和表达水平还会受炎症因子和脂肪因子的调控,说明miR-148a还可能通过自身的转录机制参与肥胖并发症。
牛乳外泌体中另一个转录因子miR-21同样也参与脂肪细胞的分化调控[84]。Kang等[66]研究了miRNA对3T3-L1脂肪细胞分化的影响,结果显示,在3T3-L1脂肪细胞分化过程中, miR-21(表1)可通过降低AP-1(核转录因子激活蛋白-1)的表达来增加脂联素的表达,进而促进前脂肪细胞分化。还有最新研究表明,在肥胖糖尿病患者的脂肪组织中,miR-21的表达要比正常水平高两倍[85]。而在Kim等[86]的研究中发现miR-21还可以通过调节TGF-β信号机制来控制间充质干细胞向脂肪细胞分化。多功能间充质干细胞(mesenchymal stem cell,MSC)是存在于多种组织(如骨髓)中的成纤维细胞样细胞,具有分化为多种类型细胞的潜力(如脂肪细胞、软骨细胞等)[87]。在某些机制的作用下,MSC衍生的前脂肪细胞可分化为成熟脂肪细胞,这有助于肥胖中脂肪细胞的增生。因为上文已经提到牛乳外泌体可以随着消化系统抵达人体各个组织部位,所以有理由去相信牛乳输送的外泌体及其miRNA分子也可能会促进MSC分化为脂肪细胞。
外泌体以及其所携带“货物”对人体所产生的各种生理机制是目前的研究热点,也是研究难点。结合上述研究报道可知,牛乳外泌体中的miR-148a和miR-21可能会通过影响人体体内的一些蛋白类激素的释放以及刺激干细胞的转化来促进脂肪细胞的增生,进而导致人体的肥胖,这也许是一个对人类罹患肥胖潜在的危险因素。
4.2 牛乳外泌体和II型糖尿病
糖尿病被认为是当代社会对健康威胁最大的疾病之一。2015年国际糖尿病联合会估计有4.15亿成年人患有这种疾病[88]。糖尿病有三种主要类型(I型、II型和妊娠糖尿病)。II型糖尿病是最常见的糖尿病类型,是一种非常复杂的疾病,跟环境、饮食、生活方式、过度肥胖都有着密切的关系[89]。目前多数研究者认为,适量摄入乳制品有益于健康,可降低患II型糖尿病的风险[90–92]。但不置可否的是,少数研究者曾评估过牛乳外泌体可能会对于II型糖尿病的发展有促进作用[93],可能是因为牛乳外泌体影响肥胖从而导致患II型糖尿病的风险增加[94]。
miR-29s也是牛乳外泌体的携带物之一[95]。相关研究表明,miR-29转录因子超家族(miR-29 superfamily,miR-29s)可能会加重II型糖尿病患者的病情[96]。Massart等[97]研究报道,miR-29a具有调节脂质氧化和胰岛素对糖代谢的作用, miR-29a的过度表达会降低体内葡萄糖的摄取量。而II型糖尿病的特点之一便是胰岛素抵抗所导致的葡萄糖转运和代谢减弱[98]。而在Song等[65]的研究中,阐明了miR-29a/b/c(表1)能够直接靶向小鼠3T3-L1脂肪细胞的富含半胱氨酸分泌蛋白(secreted protein acidic rich in cysteine,SPARC),导致该蛋白功能失调。SPARC是一种参与多种生物活动的多功能分泌蛋白,该蛋白与II型糖尿病在内的多种肥胖相关疾病有关。SPARC功能的失调可导致降低体内葡萄糖的摄取量和葡萄糖转运蛋白的活性水平。因此,miR-29s是葡萄糖代谢的负调节因子,能够通过抑制SPARC来发挥作用。所以过度摄入牛乳外泌体可能会导致体内糖代谢的异常,从而加重糖尿病患者病情。
牛乳外泌体所携带的另一种“货物”miR-148a的含量过多也可能影响到人体内胰岛B细胞功能,进而损害胰岛素的分泌。MiR-148a(表1)通过直接作用靶标肌腱膜纤维肉瘤癌基因同系物B(v-maf avian musculoaponeurotic fibrosarcoma oncogene homolog B,MAFB)[63],使得MAFB的表达受抑制。MAFB是生成功能性胰岛B细胞必不可少的物质,一旦表达受抑制就会影响胰岛B细胞的功能,导致胰岛素分泌减少,加剧了II型糖尿病患者的风险[99]。
总的来说,牛乳外泌体可能通过影响人体内的一些糖代谢相关的蛋白质或者直接抑制胰岛B细胞的功能进而导致机体糖代谢的紊乱,这使得糖尿病患者摄入过多牛乳外泌体可能会引发病情进一步的加重。这对于人们来说也是一个不可忽视的危险因素。
4.3 牛乳外泌体其他潜在的风险
有研究报道了牛乳外泌体中的miRNA与心血管类型疾病发展相关[100]。在各种心血管疾病中(例如动脉粥样硬化和冠心病)中,新内膜的形成是常见的病理表型[101]。而作为牛乳外泌体之一的miR-21[67]与血管新内膜病变的形成有关,在Ji等[102]研究报道中,对颈动脉球囊损伤的小鼠作为目标,发现miR-21(表1)能够直接作用于小鼠体内的PTEN和Bcl-2基因,抑制这两个基因的表达,促进了血管平滑肌细胞的增殖,进而增加新内膜的形成。而在Weber[103]的研究中,也指出了内皮细胞中miR-21的上调也能促进内皮细胞增殖,并增加了eNOS磷酸化和一氧化氮的产生。上述情况表明,miR-21的上调能抑制细胞凋亡并诱导血管平滑肌细胞增殖,从而导致体内新内膜的增厚。
还有研究发现牛乳外泌体中携带的一些miRNA可能也与癌症的症状发展相关。Zhang等[61]研究miRNA在胆管癌细胞中的作用和机制中发现,MiR-30a-5p(表1)能通过靶向细胞因子信号转导抑制因子(suppressor of cytokine signaling 3,SOCS3)的3'UTR抑制其表达。这可能导致了SOCS3启动子甲基化,促进了胆管癌细胞的增生。而在Liu等[59]研究中则指出miR-151a-3p(表1)会阻断p53的抗癌活性及其介导的途径,导致了鼻咽癌细胞进一步增殖、迁移。
上述研究结果表明,对于某些患有心血管疾病以及鼻咽癌等疾病的人群而言,过度摄入牛乳外泌体有可能会导致疾病进一步地恶化。因此,这些特定的人群可能需要减少摄入牛乳外泌体,以降低相应的疾病症状加重的风险。
5 结语
外泌体作为一种具有多种功能的微型囊泡,在很多生理病理上起着重要作用,如免疫中的抗原呈递、肿瘤的生长与迁移、组织损伤的修复等。而不同细胞分泌的外泌体具有不用的组成成分和功能。已有研究表明,牛乳外泌体有助于免疫调控、调节人体肠道的发育以及一些疾病的缓解,说明外泌体或许可以被有效利用,作为一种新型益生元添加剂。但如果不全面了解牛乳外泌体对人体的作用,可能会适得其反,进而使牛乳外泌体成为致肥胖、糖尿病以及一些致癌的风险因子。因此,牛乳外泌体的研究及相关产品开发应全面评估其生理功能和潜在风险。牛乳外泌体对人体的生物学功能还需要更全面且深入的研究。
