桦褐孔菌多糖的分离纯化及其抗氧化活性测定
2021-06-15李欣欣李文香
李欣欣,李文香
(青岛农业大学食品科学与工程学院,山东青岛266109)
桦褐孔菌(Inonotus obliquus(Fr.)Pilat)又名桦树菇,隶属于真菌门、担子菌亚门、伞菌纲、锈革孔菌目、锈革孔菌科、纤孔菌属,是一种具有广泛应用前景的药用真菌[1],素有“特殊的天然物质”之称。因其具有较强的抗氧化、抗肿瘤、增强免疫力、促进益生菌增殖、降血糖等功效[2−9],故深受广大消费者青睐,在医药及保健品等领域具有极高的价值[10]。桦褐孔菌是一种生长在成熟桦树树干上的寄生真菌。主要分布在北纬45°~50°的地区,如北美北部、芬兰、波兰、俄罗斯西伯利亚、中国的黑龙江和吉林长白山、日本北海道等国家和地区[11]。桦褐孔菌子实体呈肿瘤形态(无菌块状),外表呈炭灰色,具有不规则的凹槽及裂痕,并且由坚硬和脆的物质构成,中心是淡黄色,可育部分为深褐色,前端开裂,孢子呈圆形或卵状,且有刚毛[12]。
桦褐孔菌多糖最常见的提取方法为水提醇沉法[13−14],此法具有操作简易、耗能少、环保、不易破坏多糖结构等优势。多糖分离纯化分为除杂、分级两个步骤。除杂指去除多糖中蛋白质、色素及其他小分子化合物。分级指将粗多糖中分子量相近的单一组分分离开来。多糖具有较突出的抗氧化、抗肿瘤、抑菌等活性。大量研究发现,自由基与多数疾病的产生与发展都有着紧密联系。自由基在人体中作为一种常见的中间介质起着至关重要的调节作用。正常状况下,自由基的产生与清除处于动态平衡,只有自由基的数量保持恒定才能维持机体正常运行,动态平衡一旦破坏,就会引发各种疾病[15]。大量体内和体外实验证明食药用真菌多糖是一种有效的抗氧化剂[16]。桦褐孔菌对人体健康益处归功于其抗氧化成分和免疫增强成分。桦褐孔菌多糖是一种强抗氧化剂,用于消除DPPH和羟基自由基。本研究采用水提醇沉法提取桦褐孔菌粗多糖(Inonotus obliquusPolysaccharide,IOP),分离纯化多糖组分,为桦褐孔菌多糖组分的后续研究提供技术支持。
1 材料与方法
1.1 材料与仪器
桦褐孔菌菌块 产于长白山;无水乙醇、丙酮、氯仿、正丁醇、苯酚、硫酸、考马斯亮蓝、牛血清白蛋白、3,5-二硝基水杨酸等 均为国产分析纯,购于天津希恩思生化科技有限公司。
LFP-800T高速多功能粉碎机 铂欧五金制品有限公司;DK-626电热恒温水浴锅 上海精宏有限公司;TGL-16C离心机 上海安亭科学仪器厂;SHB-Ⅲ旋转蒸发仪 上海精科实业有限公司;UV-5500可见-紫外分光光度计 上海元析仪器有限公司;ALPHA 2-4 LD plus 冷冻干燥机 德国Christ公司;1100高效液相色谱仪 美国Aglient公司;
1.2 实验方法
1.2.1 桦褐孔菌化学组成 多糖含量测定:参考胡欣蕾等[17]的多糖含量的测定方式,利用苯酚-硫酸法测定多糖含量。
还原糖含量的测定:参考王楠等[18]的测定方法,利用3,5-二硝基水杨酸法测还原糖含量。
蛋白质含量的测定:参考王文平等[19]蛋白质的测定方式检测桦褐孔菌中蛋白质的含量。
灰分含量的测定:520 ℃灼烧法,参照GB5009.4-2016
粗多糖提取率测定:粗多糖的提取得率(%)=(粗多糖重量/原料重量)×100
1.2.2 桦褐孔菌多糖的提取 桦褐孔菌菌块干燥至恒重,粉碎机破碎,过60目筛处理备用。准确称取桦褐孔菌菌粉50 g,料液比1:5于80 ℃提取三次,每次3 h,3500 r/min离心10 min后合并上清液,真空减压浓缩至原体积的1/5,加入三倍体积的无水乙醇沉淀12~14 h,离心后冻干得桦褐孔菌粗多糖,并命名为IOP,此方法根据前期预实验优化所得。
1.2.3 粗多糖脱蛋白方法筛选 多糖脱除蛋白质常用的方法有Sevage法、大孔树脂洗脱法、聚酰胺吸附柱层析法等[20−21],本实验通过比较这些方法对多糖中蛋白质脱除效果及多糖的保留效果,对多糖脱蛋白的方法进行挑选。
1.2.3.1 Sevage法 蛋白质在氯仿等有机溶液中发生变性,根据这一特点将粗多糖水溶液中加入Sevage试剂(氯仿:正丁醇=4:1),体积比为3:1,磁力搅拌60 min,4000 r/min离心,保留上清液,重复操作5~6次,测定上清液中的蛋白质含量,并测定其多糖含量,根据式(1)和式(2)计算多糖保留率和蛋白质的脱除率。
1.2.3.2 聚酰胺吸附柱层析法 将100 g聚酰胺于沸水中处理1 h,用蒸馏水洗去漂浮颗粒,冷却至室温装柱,用蒸馏水洗脱24 h备用。配制质量浓度为1.0 mg/mL的粗多糖溶液,以蒸馏水作洗脱剂。检测洗脱液中蛋白质的含量,并根据苯酚-硫酸法测定洗脱液中多糖含量,根据式(1)和式(2)计算多糖保留率和蛋白质的脱除率。
1.2.3.3 大孔树脂吸附柱层析法 将大孔树脂D101、S-8分别于质量浓度为5%的HCl中浸泡6~8 h,用蒸馏水洗至中性,然后于质量浓度为5%的NaOH中浸泡6~8 h,用蒸馏水洗至中性,装柱并用蒸馏水冲洗24 h备用。配制质量浓度为1.0 mg/mL的粗多糖溶液,以蒸馏水作洗脱剂。采用1.2.1方法检测洗脱液中蛋白质的含量,并根据苯酚-硫酸法测定洗脱液中多糖含量,根据式(1)和(2)式计算多糖保留率和蛋白质的脱除率。

式中:脱蛋白前多糖含量为A1;脱蛋白后多糖含量为A2;脱蛋白前蛋白的含量为B1;脱蛋白后蛋白的含量为B2。
1.2.4 粗多糖脱色剂筛选 桦褐孔菌粗多糖提取液颜色偏深,色素的存在影响多糖活性的测定,所以多糖脱色素为多糖生理活性研究奠定基础。多糖中常采用的脱色方法有吸附法、化学法、离子交换法等[22−23]。本研究采用吸附剂脱色法进行脱色实验,比较粉末活性炭、颗粒活性炭、大孔树脂D101、S-8、聚酰胺五种脱色剂的脱色效果。
1.2.4.1 活性炭脱色法 分别称取IOP100 mg溶于100 mL的蒸馏水中,配成多糖溶液。将配好的多糖溶液分别添加到粉末活性炭、颗粒活性炭中进行吸附,将多糖和活性炭混合液置于磁力搅拌器搅拌12~14 h,4000 r/min离心15 min保留上清液,于359 nm测定上清液的吸光度,根据式(3)计算脱色率,苯酚-硫酸法检测多糖,根据式(1)计算多糖保留率。
1.2.4.2 大孔树脂层析柱脱色法 分别称取IOP 100 mg溶于100 mL的蒸馏水中,配成多糖溶液。将配好的多糖溶液分别加到预处理后的大孔树脂D101、S-8中进行吸附,收集洗脱液,于359 nm测定上清液的吸光度,根据式(3)计算脱色率,苯酚-硫酸法检测多糖,根据式(1)计算多糖保留率。
1.2.4.3 聚酰胺吸附柱层析法脱色素 称取IOP 100 mg溶于100 mL的蒸馏水中,配成多糖溶液液。将配好的多糖溶液分别加到预处理后的聚酰胺吸附柱中进行层析,以蒸馏水作为冲洗剂,流速为2.0 mL/min。于359 nm测定收集液的吸光度,根据式(3)计算脱色率,苯酚-硫酸法检测多糖含量,根据式(1)计算多糖保留率。

式中:脱色前的吸光度为C1,脱色后的吸光度为C2。
1.2.5 紫外-可见光谱分析 将质量浓度为0.1 mg/mL的粗多糖溶液(经过聚酰胺吸附柱处理),在190~400 nm的波长范围内进行扫描,验证聚酰胺对IOP中蛋白质的脱除效果。
1.2.6 DEAE-52纤维素柱分离纯化 DEAE-52纤维素是具有亲水性的阴离子交换剂。准确称取DEAE-52纤维素树脂100 g,在蒸馏水中浸泡24 h,用蒸馏水反复洗涂,去除蒸馏水中的悬浮颗粒,抽干,用0.5 mol/L NaOH溶液浸泡30 min,搅拌后,用蒸馏水漂洗至中性;再用0.5 mol/L盐酸溶液浸泡30 min,搅拌后,用蒸馏水漂洗至中性;最后用0.5 mol/L NaOH溶液浸泡30 min,搅拌后,用蒸馏水漂洗至中性,抽干,备用。
将处理好的DEAE-52纤维素树脂加适量蒸馏水,并搅拌,沿玻璃棒小心缓慢的灌入层析柱,同时敲击柱壁,使填料沉降均匀、致密,随后放置静态沉降24 h,使层析柱达到平衡。
将经过聚酰胺层析柱纯化过的粗多糖配制质量浓度为1.0 mg/mL的溶液,过0.45 μm滤膜,分别以蒸馏水、1.0、2.0、4.0 mol/L的NaCl进行梯度洗脱。流速为2.0 mL/min,每个梯度的洗脱液收集100管。根据苯酚-硫酸法隔管测定洗脱液中多糖含量,并以管数为横坐标,以吸光度为纵坐标绘制洗脱曲线。
1.2.7 DPPH自由基清除活性 参考徐妍等[24]的测定方式并作修改。配制0.1、0.2、0.3、0.4、0.5 mg/mL的多糖溶液和维生素C溶液。在具塞试管中加入2 mL不同浓度的待测溶液,0.1 mmol/L DPPH乙醇溶液2 mL。室温,避光反应30 min,517 nm波长下测定吸光值,记吸光值为As。以2 mL蒸馏水代替样品溶液按照相同方法测定吸光值,是为Ao。以2 mL无水乙醇代替DPPH溶液,重复上述步骤测定吸光值,记为Ac。按公式:DPPH自由基清除率(%)=[1−(As−Ac)/Ao]×100,计算多糖样品对DPPH自由基的清除率。
1.2.8 Sephade G-100层析柱纯化 准确称取葡聚糖凝胶Sephade G-100树脂20 g,沸水浴加热使其充分溶胀,用蒸馏水充分冲洗,去除悬浮颗粒,将冲洗后的葡聚糖凝胶Sephade G-100树脂沿玻璃棒小心缓慢的灌入层析柱,随后以流速为3 mL/min的蒸馏水平衡柱子。将经过1.2.6纯化后的样品配制质量浓度为1.0 mg/mL的溶液,过0.45 μm滤膜,以蒸馏水作为洗脱剂,每5 min收集一管。根据苯酚-硫酸法隔管测定洗脱液中多糖含量,并以管数为横坐标,以吸光度为纵坐标绘制洗脱曲线。
1.2.9 纯度鉴定和相对分子质量分布 多糖的纯度可以根据色谱图上出峰的数目和形状进行判断。所以采用高效液相色谱(HPLC)对多糖样品进行纯度鉴定。将相对分子质量为6100、26290、84000、158000和291000的标准Dextran相继进样,利用GPC再解析软件分析绘制的测定分子量大小的标准曲线。由此得出线性方程为:Y=−0.040X3+0.907X2+6.960X+23.21,R2=0.9985。
色谱柱:Waters UllrallydrogelTMLinear(φ7.8 mm×300 mm);检测器:Waters2410型示差折光检测器;泵:Waters1525型泵;进样器:Waters717型自动进样器;流动相:纯净水;流速:1.0 mL/min;柱温:55 ℃。
1.3 数据处理
实验结果取三次平行实验的平均值,数据表示为 Mean±SD,采用OriginPro 8.6软件进行数据统计分析。
2 结果与分析
2.1 桦褐孔菌的化学组成
表1为桦褐孔菌的化学组成分析,分析了桦褐孔菌中多糖、还原糖、蛋白质、灰分的含量,蛋白质含量为2.70%±0.17%,含量较低,多糖含量为13.10%±0.31%,粗多糖得率为9.40%±0.13%,表明桦褐孔菌中多糖含量丰富。

表1 桦褐孔菌的化学组成(%,W/W)Table 1 Chemical compositions of Inonotus obliquus (%,W/W)
2.2 粗多糖脱蛋白方法筛选
图1为Sevage法、聚酰胺吸附柱层析法、大孔树脂D101、S-8吸附柱层析法对IOP脱蛋白的效果图。由图1可知,Sevage法脱除效果较差,且多糖的损失大,而聚酸胺、大孔树脂D101、S-8吸附柱层析法,脱除蛋白效果较好,脱除率达93.1%、88.8%、94.3%,且多糖损失少,保留率达到90.3%、71.2%、84.6%。综合蛋白脱除率、多糖保留率的影响,选择聚酰胺吸附柱层析法为最佳的脱蛋白法。
2.3 粗多糖脱色剂的筛选
图2为粉末活性炭、颗粒活性炭、聚酰胺吸附柱层析法、大孔树脂D101、S-8吸附柱层析法对IOP进行脱色的效果图。由图2可知,活性炭法脱除色素效果较差,且多糖的损失大,而大孔树脂D101、S-8、聚酰胺吸附柱层析法脱色效果较好,脱除率达61.4%、76.2%、75.8%,且多糖损失少,保留率达到71.8%、84.6%、90.3%。综合脱色率、多糖保留率的影响,选择聚酰胺吸附柱层析法为最佳的脱色素方法。通过以上实验可知,聚酰胺吸附柱层析法可以同时脱除桦褐孔菌多糖中的色素和蛋白质,且多糖损失较少。此法可有效缩短桦褐孔菌多糖纯化的工艺流程。
2.4 紫外-可见光谱分析
图3为IOP在190~400 nm范围内的紫外-可见全光谱扫描。由图3所示,经过聚酰胺吸附柱层析法处理过的桦褐孔菌多糖在260、280 nm处未出现特殊吸收峰,说明桦褐孔菌多糖几乎不含核酸和蛋白质。

图3 IOP的紫外-可见全光谱扫描Fig.3 UV-visible full spectrum scan of IOP
2.5 DEAE-52纤维素柱分离纯化
粗多糖通过聚酰胺层析柱清除蛋白质、色素等杂质后,要想获得纯度较高的多糖组分,需要对多糖进行下一步的分级纯化。选用DEAE-52纤维素柱对初步纯化后的桦褐孔菌粗多糖进行分离纯化, 图4为IOP在DEAE-52纤维素柱上的洗脱曲线图。由图4可知,利用DEAE-52纤维素柱对IOP进行分离纯化,分别用不同浓度的NaCl进行洗脱,得到四个洗脱组分,并命名为IOP-1、IOP-2、IOP-3、IOP-4。

图4 IOP在DEAE-52纤维素柱上的洗脱曲线Fig.4 Elution curve of IOP on DEAE-52 cellulose column
2.6 DPPH自由基清除效果
DPPH自由基清除能力是检测真菌多糖抗氧化活性的一种重要指标[25],图5为桦褐孔菌粗多糖(IOP)及其分离纯化产物IOP-1、IOP-2、IOP-3、IOP-4对DPPH自由基的清除能力。由图5可知,各多糖组分对DPPH自由基清除率均随着多糖浓度的增加而增大。在同一浓度下,对DPPH自由基的清除率大小情况为IOP>IOP-2>IOP-1>IOP-4>IOP-3,所以选取桦褐孔菌多糖组分IOP-2为研究产物进行后续探索。

图5 桦褐孔菌多糖不同组分清除DPPH自由基能力Fig.5 Scavenging ability of DPPH free radicals by different components of IOP
2.7 Sephade G-100层析柱纯化
葡聚糖层析是按分子量大小分离物质的一种方法,此法被广泛应用于多种活性物质的分离纯化及产品制备中。利用Sephade G-100层析柱对IOP-2进行进一步的分离纯化,IOP-2组分的洗脱曲线如图6所示。由图6可以看出,IOP-2在Sephade G-100层析柱上的洗脱可得两个组分,分别命名为IOP-2a、IOP-2b。
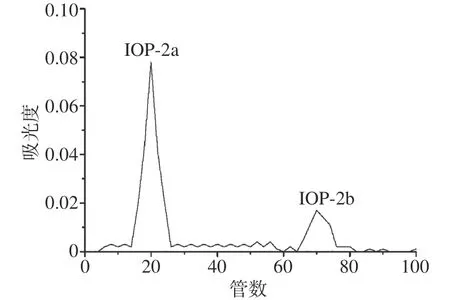
图6 IOP-2在Sephade G-100层析柱上的洗脱曲线Fig.6 Elution curve of IOP-2 on Sephade G-100 column

图7 IOP-2不同组分清除DPPH自由基能力Fig.7 Scavenging ability of DPPH free radicals by different components of IOP-2
2.8 IOP-2经Sephade G-100层析柱分离各组分对DPPH自由基的清除率
图7 为IOP-2经Sephade G-100层析柱分离纯化后组分IOP-2a、IOP-2b对DPPH自由基的清除率,由图7可知,IOP-2a、IOP-2b对DPPH自由基的清除率与多糖浓度成正比,且在同一多糖浓度下,IOP-2a对DPPH自由基的清除率明显高于IOP-2b,IOP-2a对DPPH自由基的清除率要高于IOP-2b、IOP-2,原因可能是IOP-2a、IOP-2b未分离时相互作用,对DPPH自由基的清除起抑制作用,或者IOP-2中含有其他物质影响其对DPPH自由基的清除率,所以选取桦褐孔菌多糖组分IOP-2a为研究产物进行后续探索。
2.9 纯度鉴定和相对分子质量分布
图8为IOP-2a的高效液相色谱图,由图8可知,IOP-2a经过高效液相色谱柱后只检测出一个峰,峰形对称且陡峭,说明IOP-2a为均一性多糖组分。由表2可知,IOP-2a的相对分子质量为72461 Da。
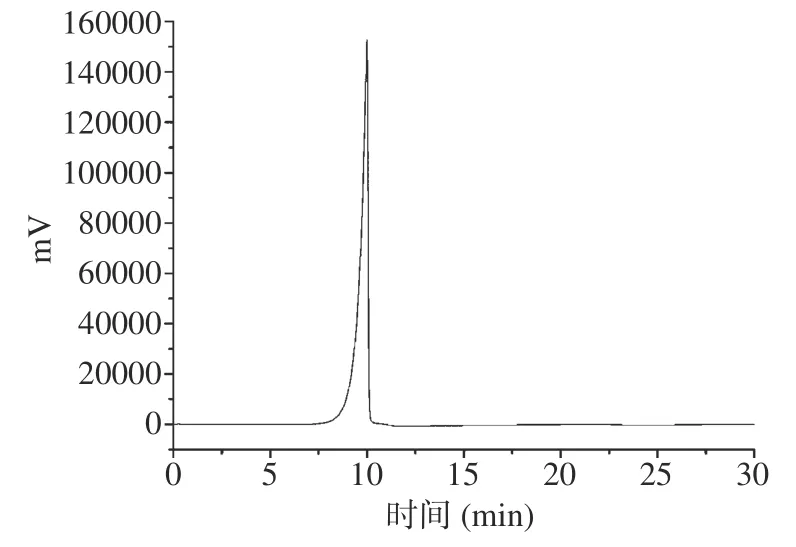
图8 IOP-2a高效液相色谱图Fig.8 High performance liquid chromatography of IOP-2a

表2 IOP-2a的相对分子质量分布Table 2 Relative molecular mass distribution of IOP-2a
3 结论
本文以桦褐孔菌为原料,研究了桦褐孔菌子实体的化学成分组成:多糖13.10%±0.31%、还原糖4.21%±0.40%、蛋白质2.70%±0.71%、灰分9.60%±0.31%。采用水提醇沉的方法提取桦褐孔菌粗多糖,对桦褐孔菌粗多糖脱蛋白、脱色素的试验方法进行挑选,得到聚酰胺层析法为最佳的脱除方法。蛋白质的脱除率为93.1%、脱色率为75.8%,多糖的保留率为90.3%。IOP经过DEAE-52纤维素柱层析后得到四个单糖组分:IOP-1、IOP-2、IOP-3、IOP-4。对四个多糖组分进行抗氧化实验发现,IOP-2对DPPH自由基的清除率最高。IOP-2经过Sephadex-100层析柱后获得两个多糖组分:IOP-2a、IOP-2b。对比其抗氧化活性,发现IOP-2a的活性较高。采用高效液相色谱法鉴定多糖组分IOP-2a,只检查出一个对称峰,说明IOP-2a为均一性多糖。
本研究以DEAE-52纤维素柱、Sephade G-100层析柱分离纯化桦褐孔菌粗多糖,最后获得分布均一、高纯度的多糖组分IOP-2a,为桦褐孔菌多糖组分的结构研究及其活性研究提供技术支持。
