聚苹果酸高产菌的筛选与鉴定
2021-06-15吕磊磊周丹凤陈林杰魏培莲
吕磊磊,周丹凤,陈林杰,魏培莲
(浙江科技学院生物与化学工程学院,浙江杭州 310023)
聚苹果酸(Poly malic acid,PMA)最早是由Shimada等[1]从圆弧青霉菌(Penicillium cyclopium)中分离得到,现已被确定是一种无毒性、具有生物可降解性和生物相容性的水溶性聚酯类高分子材料[2−6],在生物材料[7−8]、医药载体[9−11]等方面极具市场前景。PMA由L-苹果酸单体组成,具有3种构型:α型、β型、γ型,而微生物合成的PMA只有β型[12−13]。目前PMA的制备通常采用化学合成法或微生物发酵法。化学合成法可以得到3种构型的PMA,但材料来源单一,能耗高,对设备要求严格,无法满足绿色制造的要求[14−15];而生物发酵生产PMA具有条件温和、产物纯度和分子量较高等优点,且能使用可再生资源,符合绿色环保理念,目前备受国内外研究人员的关注[16−17]。
现有研究表明短梗霉、环状青霉和多头绒泡菌等菌株都可以用于发酵制备PMA[18],其中短梗霉不仅形态稳定,易于实现发酵过程中的有效调控,其合成PMA的能力也高于其他菌种[19]。短梗霉属存在4个变种[20],分别是:A. pullulans,A. melanogenum,A. subglaciale和A. namibiae,其中A. pullulans是生产PMA的主要菌种。目前PMA的生产菌种由于发酵周期较长、单位时间内产量较低、生产成本偏高等因素,微生物发酵制备PMA还未见成功商业化应用的报道。通过自然筛选或遗传改造来获得高产菌株是提高PMA发酵产量、实现微生物发酵制备PMA的有效手段。已有一些研究者开展了这方面的工作,获得了一些高产菌[17−18,21]。本研究拟从自然界取样进行PMA高产菌的分离筛选工作,以期获得PMA的高产菌株,为PMA的工业化生产提供新的菌种来源。
1 材料与方法
1.1 材料与仪器
采样样本:花(编号Ⅰ-1~15)、土壤(编号Ⅱ-1~10)、树叶(编号Ⅲ-1~20)、草叶(编号Ⅳ-1~15),共计60个 均取自校园及周边;L-苹果酸标准品 纯度>99%,国药集团化学试剂有限公司;硫酸 纯度95%~98%,无水乙醇 纯度≥99.7%,上海凌峰化学试剂有限公司;乙腈 色谱纯,安徽天地高纯溶剂有限公司;培养基配方所用药品和试剂 均为分析纯;菌种保藏培养基(马铃薯葡萄糖琼脂(PDA)):马铃薯粉 0.6%,葡萄糖 2%,琼脂 2%;富集培养基:甘露醇10%,NH4NO30.1%,KH2PO40.05%,MgSO4·7H2O 0.02%,柠檬酸 0.2%,Span 80 0.02%;分离培养基(含氯霉素PDA):马铃薯粉 0.6%,葡萄糖 2%,琼脂 2%,氯霉素 0.01%;种子培养基:葡萄糖 5%,蛋白胨0.1%,酵母提取物 0.1%,KH2PO40.5%,MgSO4·7H2O 0.04%,NaCl 0.1%;发酵培养基:葡萄糖 12% ,NH4NO30.1%,KH2PO40.01%,KCl 0.05%,MgSO4·7H2O 0.02%,CaCO33%(单独灭菌,接种前加入)。
YXQ-LS-50SII立式压力蒸汽灭菌器 上海博讯实业有限公司医疗设备厂;生化恒温培养箱 宁波海曙赛福实验仪器厂;SKY-2102C恒温培养摇床上海苏坤实业有限公司;BA310T生物显微镜 麦克奥迪实业集团有限公司;SU1510扫描电镜 日立高新技术公司;TDZ4-WS台式低速离心机 湖南湘仪实验室仪器开发有限公司;e2695高效液相色谱仪美国Waters。
1.2 实验方法
1.2.1 高产PMA菌株的筛选 分离筛选流程如下:自然界取样→富集培养→涂布分离→划线纯化→离心管发酵初筛→摇瓶发酵复筛→斜面保藏
1.2.1.1 富集与菌落分离纯化 将适量样品剪碎后置于装有10 mL富集培养基的30 mL离心管中,28 ℃、180 r/min摇床培养2~3 d,直至培养液中有明显浑浊出现;将培养液震荡摇匀后,取1 mL菌液适当稀释后,移取100 μL稀释液于分离培养基上涂布,28 ℃恒温培养2~3 d。定期观察平板菌落生长情况,根据菌落形态特征选择单菌落,进行平板划线纯化。如果一个平板上生长有多个类似目的菌落,则用a、b等加以区别,如1a、1b。
1.2.1.2 离心管发酵初筛 从分离平板挑取纯化后单菌落于装有15 mL发酵培养基的50 mL离心管中,28 ℃,180 r/min摇床培养7 d后,取发酵液检测,有PMA产生的作为初筛目标菌株。1
.2.1.3 摇瓶发酵复筛 取初筛目标菌株的单菌落于PDA斜面上,28 ℃培养箱培养2~3 d后,取2环于装有50 mL种子培养基的250 mL锥形瓶中,28 ℃、180 r /min摇床培养2 d,再以6%的接种量接种到发酵培养基中,28 ℃,180 r/min摇床培养7 d,测定发酵液中PMA产量,以产量较高的菌株为复筛目标菌株,并做进一步研究。
1.2.2 发酵产物的分析鉴定
1.2.2.1 有机溶剂法定性检测PMA 在初筛研究中采用乙醇沉淀法[22]对发酵液中的PMA进行定性检测分析。参考已有研究[23],将发酵液4000 r/min离心15 min后,取上清液加入2.8倍体积无水乙醇,立即观察到有明显絮状沉淀产生或者溶液离心后有沉淀产生,即说明发酵液中有PMA生成,通过观察沉淀生成情况,可初步判断菌株产PMA的能力。
1.2.2.2 高效液相色谱法鉴定PMA 目前主要是将聚苹果酸水解为L-苹果酸单体进行检验测定,通过检测水解前后发酵液中L-苹果酸含量的变化,一方面确定发酵液中含有PMA,另一方面是以L-苹果酸的浓度换算获得PMA的浓度。
复筛研究中采用高效液相色谱法(HPLC)对目标菌株的发酵液进行测定,方法参考文献[24−25]。样品处理方法:将复筛目标菌株的发酵液在4000 r/min条件下离心15 min,取上清液两份,其中一份加入等体积1 mol/L H2SO4,90 ℃水浴水解9 h。上清液和水解液各稀释20倍,用0.22 μm微孔滤膜过滤,置于进样瓶中,用于L-苹果酸的HPLC检测。
HPLC条件:色谱柱Hypersil ODS C18柱(4.6 mm×250 mm 2.5 μm),紫外检测器(检测波长210 nm),柱温25 ℃,进样量50 μL。采用等度洗脱方式,流动相A为乙腈,流动相B为0.025 mol/L的KH2PO4缓冲溶液(pH 2.5),流速为 1.0 mL /min。

式中:CPMA表示PMA浓度,g/L;0.864表示L-苹果酸与PMA的换算系数,ΔC苹果酸表示酸水解前后L-苹果酸的浓度差值,g/L。
1.2.3 菌种鉴定
1.2.3.1 形态学特征鉴定 a.显微形态观察:取液体培养1 d的菌液100 μL制片,若菌体浓度过大,适当稀释后,再取100 μL制片。在显微镜的视野里随机选取单细胞进行细胞形态观察,并拍照记录菌体形态。
b.扫描电镜观察[27]:取液体培养2 d的菌液,4000 r/min离心15 min后倒去上清液,沉淀用适量5%戊二醛处理12 h;4000 r/min离心5 min后,将沉淀细胞用不同浓度梯度的乙醇(10%、20%、30%、50%、70%、90%、100%)进行脱水处理,每次脱水10 min;脱水完成后于40 ℃烘箱中烘干乙醇,再用棉签蘸取少量样品,铺在载物台导电胶上,喷金,电镜观察。
1.2.3.2 分子鉴定 菌种分子鉴定委托生工生物工程(上海)股份有限公司完成。按照生工SK8259真菌基因组DNA抽提试剂盒说明书,对鉴定菌种的细胞DNA进行提取,引物设计如下:
上游引物(ITS1):5´TCCGTAGGTGAACCT GCGG 3´ (19 bp)
下 游 引 物(ITS4):5´TCCTCCGCTTATTGA TATGC 3´ (20 bp)
PCR 25 μL反应体系设计如表1所示:

表1 PCR反应体系Table 1 The reaction system of PCR
PCR扩增条件如表2所示:

表2 PCR扩增条件Table 2 The amplification conditions of PCR
用1%琼脂糖凝胶电泳分离PCR产物,按生工SK8131 DNA胶回收试剂盒说明书纯化回收PCR产物,由委托公司进行序列测定。测序结果在NCBI上进行BLAST分析,搜索与其同源性高的基因序列,用MEGA 7软件构建系统发育树,确定菌种分类,最后由Banklt向NCBI提交基因序列,申请基因编号。
1.3 数据处理
采用Excel 2016作表,MEGA7软件构建系统发育树。
2 结果与分析
2.1 菌种初筛结果
富集培养后,在分离培养基上经划线分离共获得36个单菌落。对所有单菌落进行离心管发酵培养,采用乙醇沉淀法检测是否有PMA产生(图1)。经初筛得到21株产PMA菌株,通过观察沉淀情况,初步判断编号Ⅰ-2、Ⅰ-13a、Ⅲ-16菌株的产PMA能力较强(表3)。

图1 乙醇沉淀结果Fig.1 Results of ethanol precipitation
2.2 菌株复筛结果
对初筛中产PMA的菌株进行摇瓶发酵复筛,HPLC测定发酵液中的PMA,结果见表4。从结果可以看出,分离自样本编号为I-13a的菌株产量最高,PMA产量达到(43.08±0.36) g/L。

表4 菌株复筛结果Table 4 The results of secondary screening
2.3 发酵产物分析鉴定
对L-苹果酸标准溶液和水解前后的发酵液进行HPLC检测,结果显示(图2)L-苹果酸的平均保留时间为3.190 min,RSD为1.11%,水解前后的样品目的峰与标准品出峰时间一致,且发酵液经水解后L-苹果酸的浓度大幅度升高(图3、图4),说明发酵液中含有L-苹果酸的聚合物。

图2 L-苹果酸标准溶液的HPLC图谱Fig.2 HPLC chromatogram of L-malic acid standard solution
2.4 高产菌株的鉴定
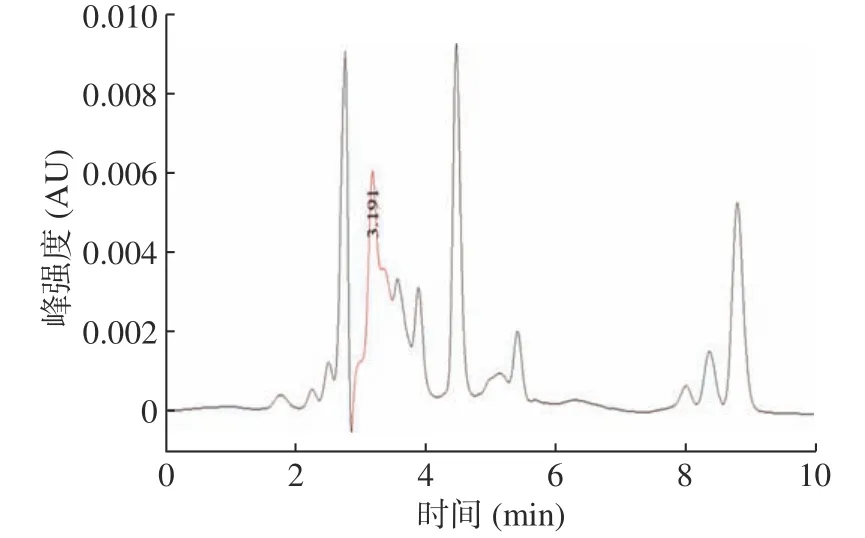
图3 水解前发酵液的HPLC图谱Fig.3 HPLC chromatogram of fermentation broth before hydrolysis

图4 水解后发酵液的HPLC图谱Fig.4 HPLC chromatogram of fermentation broth after hydrolysis
2.4.1 形态学鉴定 对筛选出的高产PMA菌株进行形态学观察。编号I-13a菌株在分离平板上的菌落生长初期为浅粉色,外表有光泽,菌落边缘呈现明显根状(图5a),菌落生长后期逐渐变绿变暗,最终呈黑色皮革状;菌体细胞在光学显微镜下呈卵圆形,大小相近,呈出芽方式增殖(图5b);在扫描电镜下菌体细胞也呈现明显的卵圆形,酵母样,单个存在,大小为(20~30) μm×(40~50) μm(图5c)。以上特征都与典型的短梗霉特征相似。

图5 编号I-13a菌株的形态观察结果Fig.5 Morphological observation results of strain I-13a
2.4.2 高产菌株的分子鉴定 提取编号Ⅰ-13a菌株的基因组DNA,经PCR扩增后回收测序,所测菌株ITS核苷酸序列长度为560 bp,电泳结果如图6所示。将该序列提交到NCBI上进行BLAST分析,发现编号Ⅰ-13a菌株与Aureobasidium melanogenum的同源性最高,采用Neighbor-joining法构建了系统发育树(图7),再结合其形态学特征,确定编号Ⅰ-13a菌株属于Aureobasidium melanogenum,并命名为ZUST-HD,GenBank库登录号为MK754072.1。
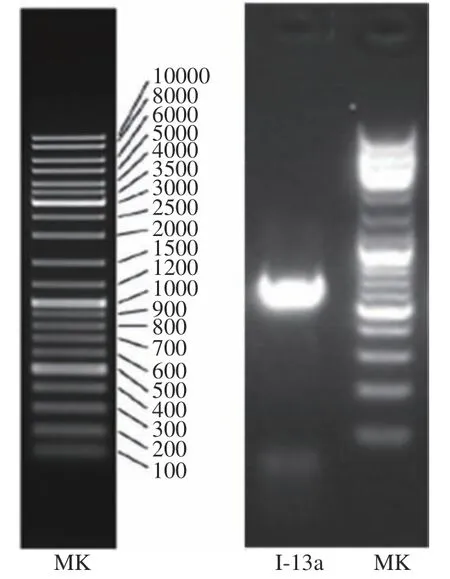
图6 琼脂糖凝胶电泳结果Fig.6 The result of agarose gel electrophoresis

图7 基于编号Ⅰ-13a菌株基因序列构建的系统发育树Fig.7 Phylogenetic tree based on gene sequence of strain Ⅰ-13a
3 结论与讨论
本研究建立了富集培养、平板分离、离心管发酵初筛、摇瓶发酵复筛的分离筛选方法。经大量筛选获得了一株PMA高产菌,产量达到(43.08±0.36) g/L。该菌株经初步鉴定属于Aureobasidium melanogenum。
已有文献报道中PMA的生产菌主要为Aureobasidiumpullulans[18,21,28],Aureobasidium melanogenum相对较少。Aureobasidium melanogenum在生长过程中可产生一定量的黑色素,广泛用于普鲁兰糖、黑色素、liamocin等的生产[29−31]。一般来说,黑色素的产生会影响菌株PMA的发酵产量和后期分离纯化,但通过发酵过程中的代谢调节调控等手段可以限制副产物黑色素的生成,使得Aureobasidium melanogenum在生产PMA方面也有良好的研究应用[32]。目前文献报道中PMA摇瓶发酵的产量多为26~30 g/L,通过发酵罐补料发酵、重复批次发酵等手段,可使产量进一步提高到50~110 g/L[33]。本研究所获得的菌种初步摇瓶发酵产量为(43.08±0.36) g/L,高于大多数已报道菌株,经后期的培养基优化和发酵工艺改进产量还有望得到大幅度提高。该菌株在生产普鲁兰多糖和liamocin方面的能力也有待进一步探究。
