SIX1 和TGF-β在人喉鳞癌上皮-间质转化中的作用
2021-06-15张继华米楠楠崔旭媛苏静梅文华
张继华 米楠楠 崔旭媛 苏静 梅文华
在恶性肿瘤局部浸润和远处转移过程中上皮-间质转化(EMT)起着重要的作用,这一过程是由多个信号传导途径触发和调控的,这些信号途径能够对细胞外的刺激产生应答而激活。在这些传导途径中,转化生长因子-β(TGF-β)途径被认为是最重要的途径之一[1,2]。以往研究表明SIX1同TGF-β相互作用能偶促进多种恶性肿瘤细胞淋巴结的转移[3],但他们具体的相互作用机制以及对恶性肿瘤细胞EMT的影响尚不明确,三者在人喉鳞癌中的相互作用仍少见报道。本研究对96例人喉鳞癌患者肿瘤组织及32例肿瘤周围正常喉黏膜组织中同源异形框基因(SIX1)、转化生长因子-β(TGF-β)以及E-钙黏蛋白(E-cadherin)及其 mRNA的表达进行了检测,旨在探讨SIX1、TGF-β在人喉鳞癌上皮-间质转化中的作用及相关作用机制,为临床喉癌的诊治、判断人喉解癌的转移及预后提供理论参考。
1 资料与方法
1.1 一般资料 收集并整理2015年1月至2017年12月河北医科大学第一医院收治的96例住院喉鳞状细胞癌患者标本及病历资料(患者术前均未经放化疗),其中诊断声门上型患者58例,声门型患者38例;32例癌旁正常喉黏膜组织取自距离肿瘤切缘≥0.5 cm(病理检查确认无肿瘤细胞存在)。96例喉鳞癌组织样本具体情况如下,男79例,女17例;年龄32~76岁,平均(58.6±7.0)岁;淋巴结转移39例(T1N1M06例,T1N2M05例,T2N1M08例,T2N2M09例,T3N1M07例,T3N2M02例,T4N1M02例,T4N2M00例),无淋巴结转移57例(T1N0M014例,T2N0M018例,T3N0M013例,T4N0M012例);临床分期:Ⅰ期22例,Ⅱ期28例,Ⅲ期35例,Ⅳ期11例。肿瘤分化程度:高分化45例,中分化16例,低分化35例。所有实验样本,经病理科两位副高以上职称医生确认。
1.2 主要试剂与仪器 SIX1免疫组化用多克隆抗体,武汉博士德公司,工作浓度为1∶75。TGF-β免疫组化用多克隆抗体,武汉博士德公司,工作浓度均为 1∶55。E-cadherin免疫组化用多克隆抗体,北京奥维亚生物技术有限公司,工作浓度为1∶50。免疫组化用SP染色试剂盒、DAB显色用试剂,北京中杉金桥生物公司。第一链合成cDNA试剂盒,Fermentas 公司。扩增试剂盒GoTaq Green Master Mix,Promega公司。上下游引物,北京奥科生物公司。培养箱:MCO175型二氧化碳培养箱,日本三洋。倒置显微镜X-PC-2型倒置相差显微镜,日本OLYMPUS。
1.3 方法
1.3.1 免疫组织化学染色:修剪留取组织标本,常规脱水、固定、石蜡包埋,蜡块进行连续切片,厚度5 μm,SP法(参照说明书)免疫组织化学染色,固定、封片,镜下判读组化染色结果。
1.3.2 结果判断:采用半定量双评分法,显微镜高倍镜视野下根据阳性细胞所占比例以及细胞染色强度做综合判定。表达强度评分标准:不着色记0分,黄色记1分,棕黄色记2分,棕褐色记3分。阳性细胞所占视野细胞比例评分标准:阳性细胞百分率<25% ,记0 分;阳性细胞百分率25%~50% ,记1 分;阳性细胞百分率51%~75%,记2分;阳性细胞百分率>75%,记3分。两种方法所得评分和,0~1为目的蛋白阴性(-);2为目的蛋白弱阳性(+);3~4为目的蛋白阳性(++),5~6为目的蛋白强阳性(+++)。
1.3.3 Western 法测肿瘤细胞内SIX1、TGF-β和E-cadherin蛋白表达:参照试剂说明书,提取样本蛋白,制备Western blot检测样品,检测各组样品蛋白浓度,常规上样,配制选用12%分离胶以及4%浓缩胶,每组样品上样量65 μg,同时设置Marker预染蛋白,100 V电泳约85 min,转膜30 V,0.9 mA过夜。洗膜,定影后进行图像分析。
1.3.4 RT-PCR测定肿瘤组织细胞SIX1、TGF-β及E-cadherin mRNA:Trizol法提取样本肿瘤细胞总的RNA,检测各组样本细胞浓度,确定样本细胞RNA完整,cDNA反转录合成,取转录产物2 μl进行PCR反应。GAPDH,上游 5’-GACAGTCAGCCGCATCTTCT-3’,下游 5’-TTAAAAGCAGCCCTGGTGAC-3’;SIX1:上游5’-CCACTAGAAGAGGAATT-3’,下游5’-CACGCCGGAGCCAAACT-3’,产物大小254 bp,退火温度56.3℃; TGF-β:上游 5’-CTGTAATTCTGCTGTAATA-3’,下游 5’-GGCTTAGTATTCTGGGAAA-3’,产物大小287 bp,退火温度54.2℃;Ecadherin:上游 5’-AGGCCAAGCAGCAGTACATT-3’ ,下游5’-ATTCACATCCAGCACATCCA-3’,产物大小为288 bp,退火温度为56.6℃。反应条件如下:94℃变性1 min,57℃复性1 min,75℃延伸1 min,共设计32个循环,最后设计75℃延伸10 min。以GAPDH的荧光表达量度作为检测基因表达参照量。

2 结果
2.1 免疫组化检测SIX1、TGF-β以及E-cadherin蛋白在人喉鳞状细胞癌及喉正常黏膜组织中的表达 96例人喉癌组织标本中及32例瘤体周围正常喉黏膜组织标本中E-cadherin的阳性表达率分别为21.9%(21/96)和81.3%(26/32);SIX1的阳性表达率分别为88.5%(85/96)和12.5%(4/32);TGF-β的阳性表达率分别为86.5%(83/96)和18.8%(6/32)。喉鳞状细胞癌SIX1、TGF-β阳性表达率均高于癌旁正常黏膜E-cadherin低于癌旁正常黏膜组,差异均有统计学意义(P<0.05)。见表1,见图1。
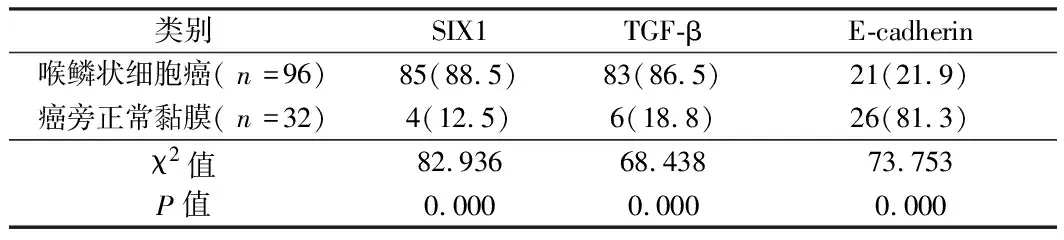
表1 SIX1、TGF-β and E-cadherin蛋白在喉鳞癌及癌旁正常喉黏膜中的表达情况 例(%)

A(+++)B(+++)C(+)
2.2 Western Blot检测SIX1、TGF-β 和E-cadherin蛋白在人喉鳞状细胞癌及喉正常黏膜组织中的表达 喉鳞状细胞癌中SIX1、TGF-β蛋白表达明显高于癌旁正常黏膜,E-cadherin蛋白表达明显低于癌旁正常黏膜,差异均有统计学意义(P<0.05)。见表2。

表2 SIX1、TGF-β and E-cadherin在喉鳞癌及癌旁正常喉黏膜中的表达情况
2.3 PCR测定人喉鳞癌组织中SIX1、TGF-β及E-cadherin mRNA的表达 96例人喉癌组织标本中及32例瘤体周围正常喉黏膜组织标本中E-cadherin的阳性表达率分别为22.9%(22/96)和78.1%(25/32);SIX1的阳性表达率分别为89.6%(86/96)和9.3%(3/32);TGF-β的阳性表达率分别为85.4%(82/96)和15.6%(5/32)。喉鳞状细胞癌SIX1、TGF-β阳性表达率均高于癌旁正常黏膜,E-cadherin阳性表达率低于癌旁正常黏膜,差异均有统计学意义(P<0.05)。见表3。

表3 SIX1、TGF-β and E-cadherin mRNA在喉鳞癌及癌旁正常喉黏膜中的表达情况 例(%)
2.4 SIX1、TGF-β 和E-cadherin蛋白表达与喉鳞癌患者临床病理特征的关系 有淋巴结转移的患者中,喉鳞癌组织中SIX1的阳性表达率高于无淋巴结转移的患者(P<0.05),同时在中低分化患者中SIX1的阳性表达率高于其在高分化患者中的表达(P<0.05)。不同性别、年龄、临床分期的患者喉癌组织中SIX1的阳性表达率比较,差异无统计学意义(P>0.05)。有淋巴结转移的患者中,喉鳞癌组织中TGF-β的阳性表达率高于无淋巴结转移的患者(P<0.05)。不同分化程度的喉鳞癌组织中TGF-β阳性表达率比较,差异无统计学意义。不同性别、年龄、临床分期的患者喉癌组织中TGF-β的阳性表达率比较,差异无统计学意义(P>0.05)。有淋巴结转移的患者中,喉鳞癌组织中E-cadherin的阳性表达率低于无淋巴结转移的患者(P<0.05)。同时在中低分化患者中,E-cadherin的阳性表达率低于其在高分化患者中的表达(P<0.05)。不同性别、年龄、临床分期的患者喉癌组织中E-cadherin的阳性表达率比较,差异无统计学意义(P>0.05)。见表4。
2.5 Six1、TGF-β和E-cadherin在人喉鳞癌患者肿瘤组织中表达相关性 人喉鳞癌组织中E-cadherin的表达与SIX1表达呈负相关(P<0.05);E-cadherin的表达与TGF-β表达呈负相关(P<0.05)。见表5。

表5 喉鳞癌组织中Six1、TGF-β和E-cadherin表达的相关性 例
3 讨论
EMT是指肿瘤上皮细胞在一定的环境及相应转化因子等共同因素的相互影响下逐步转变成充质细胞的现象[4]。目前多数学者认为EMT是恶性肿瘤生长、转变的过程之一,同恶性肿瘤细胞的局部浸润及远处淋巴转移紧密相关。EMT转化的过程主要表现为,原肿瘤上皮细胞极性逐渐消失,上皮细胞及其与其周围其他细胞的接触相应减少,细胞间的连接,包括黏附连接及紧密连接减少,使得细胞脱离的机会增加,易于发生局部浸润及发生远处迁移,EMT的发生会出现原有上皮细胞表型的转变,其上皮表型如E-eadherin、角蛋白丝等消失,间质表型,纤维连接蛋白,N-钙粘素等逐渐形成。其中代表细胞间黏附力的E-cadherin表达下降是ENT的主要表现,也被视为EMT转化的标志[5]。实验研究表明,EMT同肿瘤细胞向局部浸润和淋巴转移的过程密切相关,EMT可诱导多种恶性肿瘤细胞局部侵润和淋巴转移,比如卵巢癌、肝癌、结肠癌及恶性黑色素瘤等[6-9]。因此,EMT被认为是多种上皮来源肿瘤转移潜能的标志。
上皮间质转化的过程是由多个信号传导通路触发和调控的,在这些信号传导通路中,TGF-β被认为是最重要的途径之一[10]。TGF-β能够通过MAPK (mitogen-activated protein kinases)通路、SMAD通路及Wnt通路等途径对肿瘤的浸润及转移进行调节,在大肠癌、肺癌、乳腺癌等多种肿瘤组织中均存在TGF-β的高表达[11],其表达强度与肿瘤的分化、淋巴转移及预后密切相关[12]。以往的研究证实,TGF-β能够被细胞中的多种活性因子激活,并与这些因子共同作用,激活及影响细胞内多种传导通路,但肿瘤细胞中转录因子的高表达能否增强TGF-β途径在诱导人喉鳞癌EMT过程中的作用尚不清楚。
SIX1是一种成熟相关的细胞因子,在发育成熟的细胞内很少表达,然而最近研究表明,SIX1在多种恶性肿瘤组织中却呈现出高表达,SIX1能够影响Cyclin A1、Cyclin D1及Ezrin等多种下游编码基因的表达[13-16]。SIX1在卵巢癌、乳腺癌、肝细胞癌等多种恶性肿瘤中表达强度同肿瘤的预后密切相关[12-14]。最近研究证明,SIX1 能够与TGF-β共同作用,并通过SMAD2/3途径调节VEGF等多种基因的表达,进而发挥其促进肿瘤细胞淋巴结转移功能,基于以上研究结果,本研究的目的在于,探讨SIX1与TGF-β是否在人喉鳞癌EMT的过程中起着促进作用。
研究表明, SIX1能够同TGF-β共同作用促进肿瘤细胞上皮-间质转化,进一步提高肿瘤细胞局部浸润及远处转移的能力[17]。本研究结果显示,Six1、TGF-β蛋白在人喉鳞癌组织中均出现了阳性表达,同癌周正常黏膜相比出现了明显的增强,提示Six1、TGF-β同喉鳞癌的发生发展密切相关。同时研究结果显示,在有淋巴结转移组中Six1、TGF-β蛋白的阳性表达率明显升高,同无淋巴结转移组相比差异有统计学意义,同时,E-cadherin阳性表达率在有淋巴结转移组中出现了降低,同无淋巴结转移组相比,差异有统计学意义(P<0.05)。相关性研究结果显示,Six1、TGF-β的表达与E-cadherin表达呈负相关(P<0.05),提示, SIX1及TGF-β可能是调节喉鳞癌上皮-间质转化的重要影响因子,二者的高表达可能共同促进了喉鳞癌的上皮-间质转化,抑制了E-cadherin蛋白的表达,进而促进人喉鳞状细胞癌的淋巴结转移。同时PCR测定人喉鳞癌组织中SIX1、TGF-β及E-cadherin mRNA的表达结果显示人喉癌组织标本及瘤体周围正常喉黏膜组织标本中E-cadherin mRNA的阳性表达率同其蛋白的阳性表达率基本一致,说明上述表达变化发生在基因表达水平。
本课题对SIX1、TGF-β在人喉鳞癌上皮-间质转化中的作用做了初步探讨。结果提示,SIX1和TGF可能成为抑制喉鳞癌EMT发生的重要因素,联合检测SIX1、TGF-β及E-cadherin对判断人喉鳞癌的转移及预后有重要临床意义。
