一株血清5 型副猪嗜血杆菌的分离鉴定与药敏试验
2021-06-15邓汝森颜广智陈盛楠张海龙顾万军黄良宗
邓汝森,颜广智,陈盛楠,张海龙,顾万军,黄良宗
(佛山科学技术学院 生命科学与工程学院,广东 佛山 528225)
副猪嗜血杆菌(Haemophilus parasuis,HPS)可引起猪以浆液性、纤维蛋白性多发性浆膜炎、关节炎和脑膜炎为特征的严重全身性疾病[1],由该病原引起的疾病称为革拉泽病(Glasser’s disease)。HPS 只感染猪,可以影响2 周龄~4 月龄的猪,主要在断奶前后和保育阶段发病,常见于5~8 周龄,感染高峰通常见于保育期的4~6 周,有些早在保育舍内最初2 周时就开始出现,并一直持续到肥育期早期,发病率可达40%,严重时死亡率可达50%[2]。
2020 年3 月,广东茂名某规模猪场的2 月龄保育猪突然发生散发性死亡,猪场共有保育猪510 头,发病78 头,死亡17 头,发病率15.29%,病死率21.79%。根据流行病学调查分析、猪群临床表现和病猪病理变化作出初步判断,并对可疑病毒进行PCR 检测,但未检测到相关病毒;同时进行细菌分离培养、生化鉴定和16S rRNA 基因测序分析,确定为副猪嗜血杆菌病,菌株命名为MM20200311,对分离菌株进行药敏试验,参考药敏试验结果对发病猪群进行治疗,取得了良好的治疗效果。
1 材料与方法
1.1 病料
从茂名市某规模猪场采集病猪肺脏、心脏、胸腔积液、脾脏和脑。
1.2 主要试剂
感受态细胞DH5α,由本实验室保存;蛋白酶K 购自大连宝生物工程有限公司;DNA Marker DL2000、PCR 扩增试剂盒、PMD-18T 载体、琼脂糖购自TaKaRa 公司;DNA 胶回收试剂盒(D6902-01)购自美国齐特科公司;药敏纸片购于赛默飞世尔科技(中国)有限公司;新型微生物微量生化鉴定管购自广东环凯微生物科技有限公司;麦康凯培养基、普通琼脂培养基、巧克力培养基、普通血平板、含V 因子血平板、普通营养肉汤和含V 因子营养肉汤均由本实验室配制。
1.3 病猪解剖观察
剖检病死猪,观察内脏的病理变化,并拍照记录。
1.4 病毒检测
进行猪繁殖与呼吸综合征病毒、猪伪狂犬病毒、圆环病毒、猪流感病毒和猪瘟病毒PCR 检测。
1.5 细菌分离培养
无菌采集猪肺脏、心脏、胸腔积液、脾脏和脑病料,分别接种于含NAD 鲜血培养基,置于5%的二氧化碳培养箱,37 ℃培养24~48 h 后观察结果,然后再进一步纯培养。从NAD 鲜血平板上挑取可疑菌落进行涂片,革兰氏染色,进行细菌形态特征观察。将疑似HPS 菌落的纯培养物分别接种于麦康凯培养基、普通琼脂培养基、巧克力培养基、普通血平板和含V 因子的血平板,观察细菌生长状况。
1.6 卫星现象试验
在普通营养琼脂平板分别均匀划线致密接种可疑菌株,同时在平板的中心平行划线接种两行金黄色葡萄球菌,置5%二氧化碳培养箱,于37 ℃条件下培养24~4 h,观察细菌生长状况[3]。
1.7 V 因子依赖性试验
将分离菌株纯培养物分别接种到普通营养肉汤和含V 因子营养肉汤,观察肉汤的浑浊度。
1.8 生化鉴定
将HPS 可疑菌株纯培养物接种生化微量鉴定管,生化微量鉴定管中同时加入5 μL 0.07%的V 因子,置于5%的二氧化碳培养箱37 ℃培养24 h,观察生化反应结果。
1.9 分离菌16S rRNA 基因序列分析
根据副猪嗜血杆菌16S rRNA(M75065)序列设计引物[4],上游引物:5’-GGCTTCGTCACCCTCTGT-3’;下游引物:5’-GTGATGAGGAAGGGTGGTGT-3’,16S rRNA PCR 扩增产物预期大小为822 bp,引物由生工生物工程(上海)股份有限公司合成。用水煮法提取分离菌株的基因组DNA,以提取的DNA 为模板,用16S rRNA 基因特异性引物进行PCR 扩增,随后对PCR 产物进行胶回收纯化,纯化PCR 产物连接PMD-18T 载体后转化感受态细胞,涂布氨苄营养琼脂培养皿,挑取5 个阳性克隆送生工生物工程(上海)股份有限公司测序,对测序结果做同源性分析。
1.10 副猪嗜血杆菌血清型分子分型
副猪嗜血杆菌血清型分型引物参照文献[3]进行设计,引物序列见表1。对分离菌进行PCR 血清型鉴定,反应体系为25 μL:2×premix 12.5 μL,上下游引物各1 μL,DNA 模板3 μL,ddH2O 7.5 μL。反应条件为:94 ℃5 min;94 ℃30 s,64 ℃30 s,72 ℃60 s,共30 个循环;72 ℃5min。

表1 血清型鉴定PCR 引物序列

续表
1.11 血清凝集试验
取上述1.5 中纯化培养的菌落用无菌PBS 混匀作为待检菌液,分别取5 型、12 型和7 型标准阳性血清50 μL 与50 μL 菌液进行凝集试验[5],以待检菌液作为阴性对照,对分离菌株进行血清型鉴定。
1.12 药敏试验
挑取单菌落接种于含V 因子营养肉汤中,置于37 ℃恒温摇床培养5~6 h,取100 μL 均匀涂布于含V 因子血平板上[6]。用纸片琼脂扩散法(K-B 法)[7]进行药敏试验,选取氧氟沙星、头孢拉定等20 种常用抗生素为试验药物。于37 ℃二氧化碳培养箱中培养24 h,测定抑菌圈直径并参考美国临床和实验室标准协会(CLSI)的标准判断耐药(R)、敏感(S)或中介(I)进行结果判断与耐药性分析。
2 结果
2.1 死亡猪的病理剖检
发病猪群临床表现为采食量下降,体温升高,严重者呼吸困难,个别伴有咳嗽,关节肿大,身体震颤。解剖病猪发现,呼吸困难的仔猪可见其肺脏有大量纤维性析出,胸腔积液,个别病猪有心包积液,且心包发生粘连,慢性发病猪呈现绒毛心;剖开肿胀关节有大量清亮液体流出。
2.2 病毒检测
未检测到相关病毒。
2.3 细菌分离培养与形态观察
疑似HPS 感染的猪病料接种于V 因子血平板,出现白色、半透明、细小露珠状菌落(见图1a),从中分离到1 株可疑菌株,分离菌株镜下形态都相似,均为革兰阴性短小杆菌,无芽胞,多呈散在排列,菌体细小(见图1b)。分离菌株在麦康凯培养基和普通琼脂培养基上均不生长;在巧克力培养基和普通血平板上生长缓慢;在V 因子血平板上生长良好,长成白色半透明细小露珠状菌落,边缘整齐、光滑、圆形隆起,菌落直径约0.5~1 mm,具反光特性,均不溶血。

图1 分离菌菌落和菌体形态
2.4 卫星试验结果
卫星现象试验可观察到越接近葡萄球菌,分离菌形成的菌落越大、越多,离葡萄球菌越远,菌落越小,甚至不生长(见图2)。
2.5 V 因子依赖性试验结果
分离菌株在1 号和2 号普通营养肉汤中未见生长,肉汤清亮,而在V 因子营养肉汤中生长良好,肉汤十分浑浊(见图2),说明该分离菌对V 因子存在一定的依赖性。

图2 卫星生长现象和V 因子依赖性试验
2.6 生化特性试验
把分离菌株接种在含V 因子的生化微量鉴定管,置于5%的二氧化碳培养箱37 ℃培养24 h 后,其生化特性表明该分离菌能分解蔗糖、棉子糖、木糖、葡萄糖、鼠李糖、尿素及七叶苷,而其不分解阿拉伯糖、苯丙氨酸、硫化氢、甘露糖、葡磷胨水、半乳糖、侧金盏花醇。精氨酸脱羧酶试验、赖氨酸脱羧酶试验及靛基质试验阴性。参照《伯杰细菌鉴定手册》,以上生化鉴定结果符合副猪嗜血杆菌的生化特征。
2.7 16S rRNA 基因序列分析
以分离菌株的DNA 为模板,用16S rRNA 基因特异性引物进行PCR 扩增,在约822 bp 位置可见清晰条带,与阳性对照一致,阴性对照在相应位置未见条带(见图3)。把16S rRNA 基因测序结果与GenBank 中登录的副猪嗜血杆菌参考菌株序列进行同源性比对,分离菌与副猪嗜血杆菌同源性>99%,发育进化树显示分离菌株与副猪嗜血杆菌HS1080 株处于同一分支(见图4),表明分离株为副猪嗜血杆菌,命名为MM20200311。

图3 HPS-16S rRNA PCR 鉴定和HPS 血清型鉴定
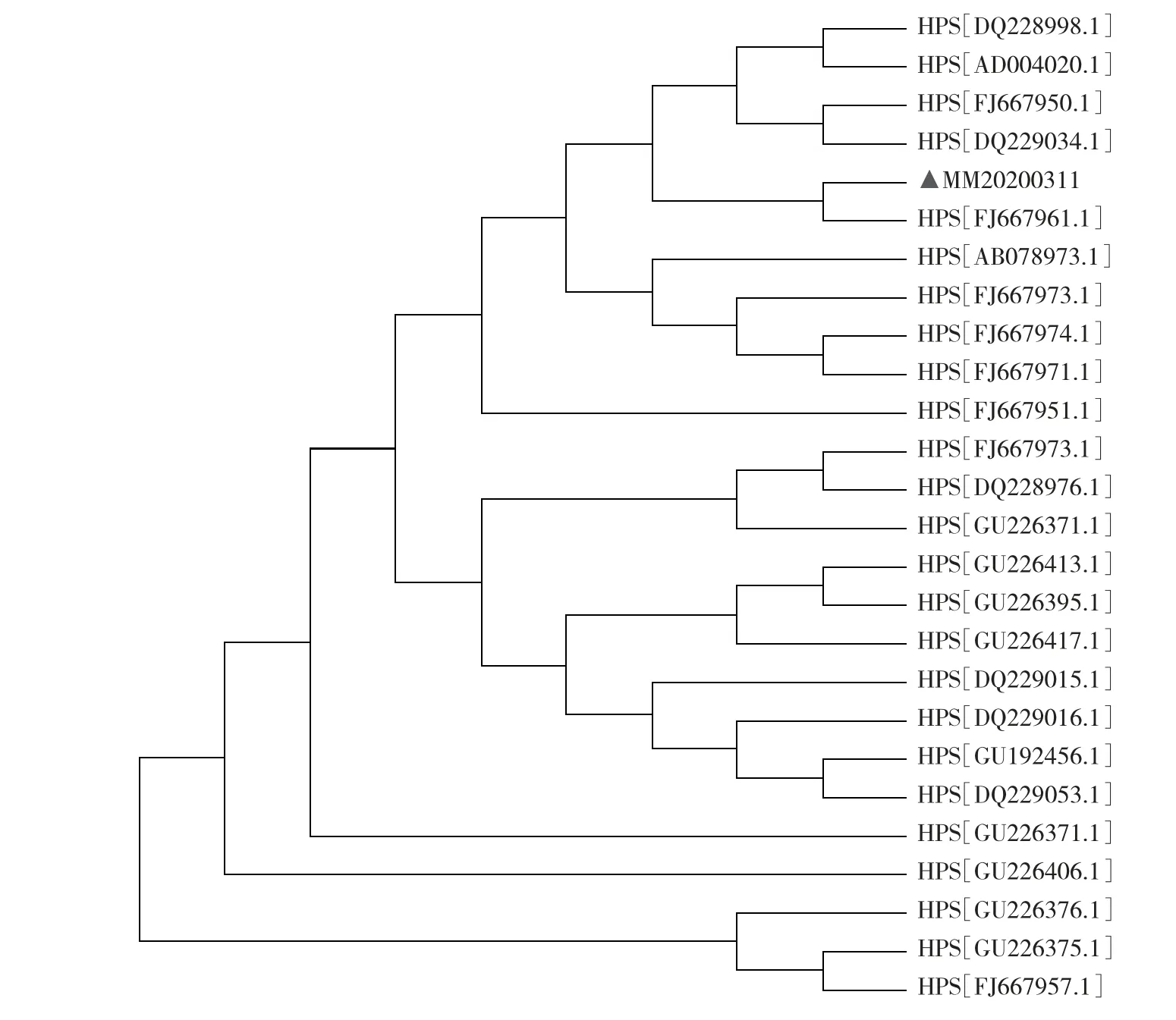
图4 分离菌株与参考株16S rRNA 序列系统进化树
2.8 分离菌血清型鉴定
利用HPS 血清分型引物对分离菌进行血清型分型,结果见图3,在500 bp 左右出现特异性条带,由此推测分离菌MM20200311 可能为5 型或12 型HPS。因此,利用HPS 的5 型和12 型标准阳性血清进一步验证,结果表明只有5 型标准血清与待检菌液发生凝集反应,说明本次试验分离出一株血清型5型HPS。
2.9 药敏试验结果
从表2 可见,分离菌MM20200311 对头孢唑啉、头孢拉定、奥格门丁、庆大霉素、氟哌酸、头孢喹肟、氨苄西林、阿莫西林、大观霉素、红霉素、氟苯尼考高度敏感;对氧氟沙星、诺氟沙星、阿米卡星、多西环素、链霉素、金霉素、甲氧苄啶、利福平耐药。

表2 药敏试验结果
3 讨论
通过流行病学调查、猪群临床表现、病猪剖检分析、病毒检测、细菌分离鉴定及最终猪群用药效果,初步确定引起该猪场本次疾病的病原为5 型副猪嗜血杆菌。经了解,该批猪群在发病前1 周从外地购苗转入,之后陆陆续续有猪出现低烧、少吃,注射氟尼辛普甲胺注射液后仍未见好转。发病第3 天出现个别猪只死亡,病死猪表面多部位出现发绀症状,尤其在耳后、腹部及四肢内侧等部位表现明显。现场发现该猪场保育猪舍内地面湿滑,猪只密度较大,空气闷热,通风条件较差,导致氨气味较浓,偶尔有猪只间歇性咳嗽,声音低沉。仔细观察发病猪群,发病猪精神状况欠佳,个别发病猪有松毛现象,长期趴地上,不愿站立,严重者关节肿大,肌肉震颤,后肢共济失调,触碰发出惨叫声。
解剖病猪可见气管黏膜充血,严重的带有淡红色泡沫;肺门淋巴结肿大出血;病猪心外膜有纤维蛋白析出,形成一层绒毛性假膜,可明显看到心包积液增多,新冠脂肪呈胶冻状,心内膜有少量出血点;腹腔脏器与腹壁,心脏及肝脏与胸壁发生黏连。无菌操作采集肺脏、心脏、胸腔积液、脾脏和脑,低温保存送检。
从上述临床症状及发病特征初步判断本次疫情可能由细菌感染引起,将以上送检病料进行细菌分离培养,分离出一株可疑菌株,经革兰染色镜检、生理生化鉴定、16S rRNA 基因克隆测序分析及血清型鉴定,最终确定分离菌株MM20200311 为5 型副猪嗜血杆菌。对该分离菌株进行药敏试验,结果显示分离株对头孢拉定、氨苄西林、大观霉素、氟苯尼考等药物高度敏感,而对磺胺类药物严重耐药,可能与临床长期使用磺胺类药物有较大关系,也可能由于副猪嗜血杆菌的耐药机制发生改变而引起耐药性。因此,在发生该病时应该合理使用抗菌药物,减少耐药性产生,提高治疗效果。
本猪场推荐使用氟苯尼考进行肌肉注射,饮水添加复合维生素,连用3 天;另外每天早晚使用过硫酸氢钾以1:100 的浓度进行场地消毒;加强通风,地面保持干爽;把病情严重的保育猪单独隔离治疗。用药第2 天,整体猪群精神状态有较大好转,采食量明显恢复,有2 头保育猪因病情过长衰弱死亡。直到第4 天,全场保育猪恢复稳定,疫情得到了控制,整体治疗效果较为满意。
目前对于副猪嗜血杆菌的防控应从饲养管理做起,坚持自繁自养、全进全出的饲养模式,尽可能减少应激(如断奶、转群、饲料更替、潮湿、气温骤变等),以达到控制该病的目的。猪场中一旦发现该病,应立刻进行药敏试验,选取敏感药物及时治疗或用本场分离的菌株制成灭活疫苗及时做好免疫接种;日常可选用中药保健,以提高猪群整体免疫力[8]。
