白秃马勃粗脂肪化学成分分析
2021-06-15峰2梁滢滢梁晓棠陈佳珊曾玉环
李 皓,陈 浒,朱 峰2,*,梁滢滢,梁晓棠,陈佳珊,曾玉环
(1.佛山科学技术学院 食品科学与工程学院,广东 佛山 528225;2.佛山科学技术学院佛山市活性天然产物与功能化学品工程技术研究中心,广东 佛山 528000;3.佛山科学技术学院 环境与化学工程学院,广东 佛山 528000)
从秃马勃属Calvatia sp.真菌已经发现了许多具有重要生物活性的化学成分[1],例如从粟粒皮秃马勃C.boninensis 分离到一个具有转译抑制、抗增值、抗有丝分裂活性的新蛋白calcaelin[2-3],从头状秃马勃C.craniiformis[4]和红黄秃马勃C.rubro-flava[5]发现了系列对羟基苯基重氮甲酰胺衍生物和甾体化合物,从杯形秃马勃C.cyathiformis 分离获得系列新的甾体化合物[6-8],从大秃马勃C.gigantea 发现了抗肿瘤物质马勃菌素calvacin[9],从紫色秃马勃C.lilacina[10-11]和头状秃马勃C.craniiformis[12]中分离到抗细菌和抗真菌马勃酸。特别是,BENTLEY 等[13]研究表明大秃马勃C.gigantea 脂肪酸成分主要是棕榈酸、油酸和亚油酸。药食两用秃马勃属Calvatia sp.高等真菌白秃马勃Calvatia candida(Rostk.)Hollós,喜生于草地上,在我国分布广泛,常用于消炎、解热、利喉、止血等作用[14],但罕见白秃马勃C.candida 化学成分的研究报道。前期研究[15]表明,白秃马勃甲醇粗提物具有有效的抗氧化活性,含有生物碱、甾体和萜类化学成分。本文进一步对该菌粗脂肪化学成分进行研究,旨在为白秃马勃的开发利用提供科学依据。
1 材料与方法
1.1 材料
Bruker AV-400 核磁共振波谱仪(瑞士Bruker Corporation,溶剂CDCl3,内标TMS);Esquire HCT-Agilent 1200 型质谱仪(德国Bruker 公司);450 型气相色谱串联320 型四级杆质谱仪(德国Bruker公司);BioTek Elx800 酶标仪(美国赛默飞公司)。所用试剂均为市售分析纯和色谱纯试剂。
白秃马勃菌于2017 年7 月30 日采自广东省佛山市千灯湖景区草坪,经佛山科学技术学院卢卫红副教授鉴定为白秃马勃真菌Calvatia candida(Rostk.)Hollós。
1.2 白秃马勃粗脂肪的制备
参照国标GB5009168-2016[16]制备白秃马勃粗脂肪。将采摘的新鲜野生菌子实体剪碎风干,称取500 g 干燥子实体用乙醚连续渗漉回流提取24 h。乙醚提取液用50 ℃水浴加热蒸馏回收乙醚得粗脂肪47.45 g,提取率9.49%。
1.3 白秃马勃粗脂肪化学成分分离纯化与结构鉴定
将白秃马勃粗脂肪用硅胶拌样,通过硅胶柱色谱进行分离纯化,先用正己烷-乙酸乙酯(90∶10,v/v)混合溶剂洗脱得到白秃马勃菌油1.40 g,再继续用正己烷-乙酸乙酯(80∶20,v/v)混合溶剂洗脱,先后得到化合物MB1(80 mg)和MB2(50 mg),通过ESI-MS、1D NMR 和2D NMR 对化合物进行结构鉴定。
1.4 白秃马勃菌油脂肪酸组成分析
甲酯化:参照国标[16],称取白秃马勃菌油100 mg,加入石油醚-苯(1∶1,v/v)混合溶剂4 mL,震荡溶解后加入0.4 mol/L 氢氧化钾的甲醇溶液4 mL,振荡3 min,在4 000 r/min 下离心10 min,取上清液进行GC-MS 分析。
色谱条件:色谱柱采用DB-5MS 石英毛细管柱(30 m×250 μm,0.25 μm);升温程序设置起始温度50 ℃,以5 ℃/min 速度升温至150 ℃后,再以15 ℃/min 速度升温至300 ℃,保持20 min;进样口温度280 ℃,进样量1 μL;分流比1∶10;载气为氦气,载气流速1.0 mL/min。
质谱条件:EI 离子源,电离源能量70 eV,离子源温度230 ℃,质量扫描范围m/z 35~600。
1.5 白秃马勃菌油DPPH 自由基清除试验
改进文献[17]方法,采用96 孔板测定样品对DPPH 自由基的清除活性。白秃马勃菌油用无水乙醇稀释成30.0 mg/mL 的样品溶液。准确吸取一定体积样品溶液依次加入到96 微孔板中,然后加入无水乙醇至每孔体积100 μL,使得每孔菌油浓度依次为3~30 mg/mL,再各加入100 μL 新鲜配制的DPPH 乙醇溶液(0.2 mmol/L),盖上板盖置于酶标仪中震荡均匀,然后于25 ℃恒温避光反应30 min 后,取出板盖,以无水乙醇为空白对照,在510 nm 波长读取各孔吸光度值并计算自由基清除率(%RSA)。半数清除浓度(IC50)定义为自由基清除率为50%时所需样品的浓度。试验平行测定3 次。抗坏血酸为参照。自由基清除率计算公式为:%RSA=[1-(Ai-A)j/Ao]×100。其中:Ai为100 μL 样品和100 μL DPPH 混合物的吸光度值,Aj为100 μL 样品和100 μL 无水乙醇混合物的吸光度值,Ao为100 μL DPPH 和100 μL无水乙醇混合物的吸光度值。
2 结果与分析
2.1 白秃马勃菌油脂肪酸组成及含量
从500 g 白秃马勃中获得菌油1.40 g,菌油产率为0.28%,说明菌油在干燥白秃马勃子实体中占比较低。其脂肪酸组成分析结果见表1。脂肪酸组成分析结果说明,白秃马勃菌油以不饱和脂肪酸为主,含量占71.60%,其中多不饱和脂肪酸亚油酸含量占44.11%,单不饱和脂肪酸油酸含量占27.49%,而饱和脂肪酸中,以棕榈酸为主,含量占17.60%。
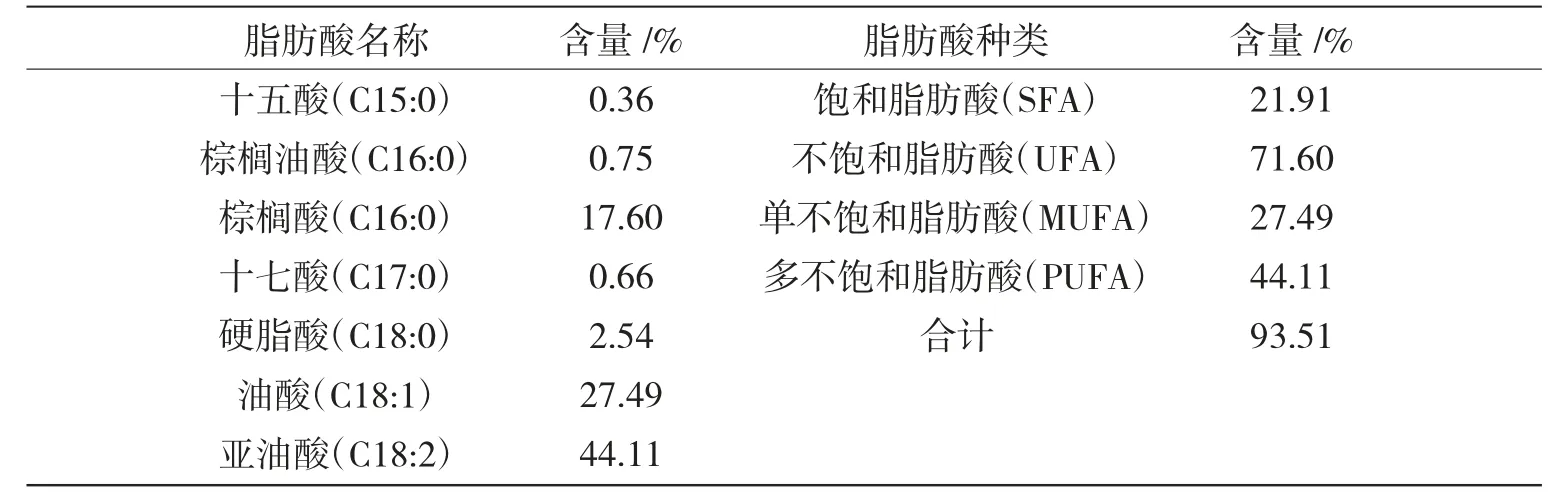
表1 白秃马勃菌油脂肪酸组成和含量
2.2 白秃马勃菌油清除DPPH 活性
以白秃马勃菌油浓度为横坐标,DPPH 自由基清除率为纵坐标,得到白秃马勃菌油清除DPPH 自由基活性图,见图1。
从图1 可以看出,在试验浓度范围内,白秃马勃菌油具有一定的清除DPPH 自由基抗氧化活性,而且其活性呈浓度依赖关系,菌油DPPH自由基清除能力随着菌油浓度增大而相应增强。通过多项式拟合计算得到半数清除浓度IC50值为26.61 mg/mL。

图1 白秃马勃菌油清除DPPH 自由基活性
2.3 化合物结构鉴定
从白秃马勃粗脂肪分离纯化得到的2 个化合物MB1 和MB2 均为无色针状结晶。ESI-MS 谱提示化合物MB1 的准分子离子峰在m/z 493.5[M+Na]+。综合1H NMR、13C NMR 和DEPT 谱得知该化合物含有30 个碳原子和46 个质子,从而推测其分子式为C30H46O4,不饱和度为8。NMR 谱图显示典型的麦角甾类化合物特征。18 位和19 位的2 个角甲基的碳谱和氢谱信号分别在13.01(q,C-18)和0.81(s,H-18)以及18.20(q,C-19)和0.90(s,H-19),17 位支链的4 个甲基的碳谱和氢谱信号分别在21-CH(319.77和0.82)、26-CH3(20.09 和0.83)、27-CH3(21.01 和1.00)以及28-CH3(17.71 和0.91)。麦角甾类化合物3 位连氧原子次甲基的碳谱和氢谱特征信号在69.62(d,C-3)和4.98(m,H-3)。另外,在135.21(d,C-6)和6.23(d,H-6)以及131.04(d,C-7)和6.51(d,H-7)给出一组环内双键特征,在132.43(d,C-22)和5.22(dd,H-22)以及135.33(d,C-23)和5.14(dd,H-23)给出一组环外双键特征。特别是,在170.26(s)以及21.46(q)和2.02(s)还给出一组乙酰基信号。通过HSQC 对化合物MB1 的碳谱和氢谱化学位移进行归属,结果见表2。综合解析1H NMR、13C NMR、DEPT、gCOSY、HSQC 和HMBC 谱,并与文献[18]对比,鉴定该化合物为麦角甾-5,8-表二氧-6,22-二烯-3-乙酸酯,结构式见图2。
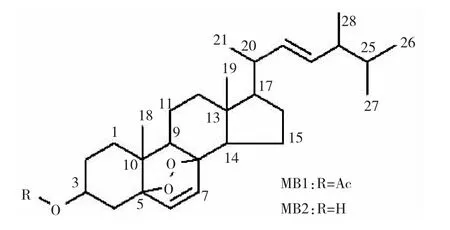
图2 化合物MB1 和MB2 的化学结构式
ESI-MS 谱提示化合物MB2 的准分子离子峰在m/z 451.4[M+Na]+,比化合物MB1 少42。综合1H NMR、13C NMR 和DEPT 谱得知该化合物含有28 个碳原子和44 个质子,从而推测其分子式为C28H44O3,不饱和度为7。其氢谱和碳谱特征与化合物MB1 的非常相似,不同点在于少了一个乙酰基信号特征。通过HSQC 对化合物MB2 的碳谱和氢谱化学位移进行归属,结果见表2。综合解析1H NMR、13C NMR、DEPT、gCOSY、HSQC 和HMBC 谱,并与文献[19]对比,鉴定该化合物为麦角甾-5,8-表二氧-6,22-二烯-3-醇,结构式见图2。
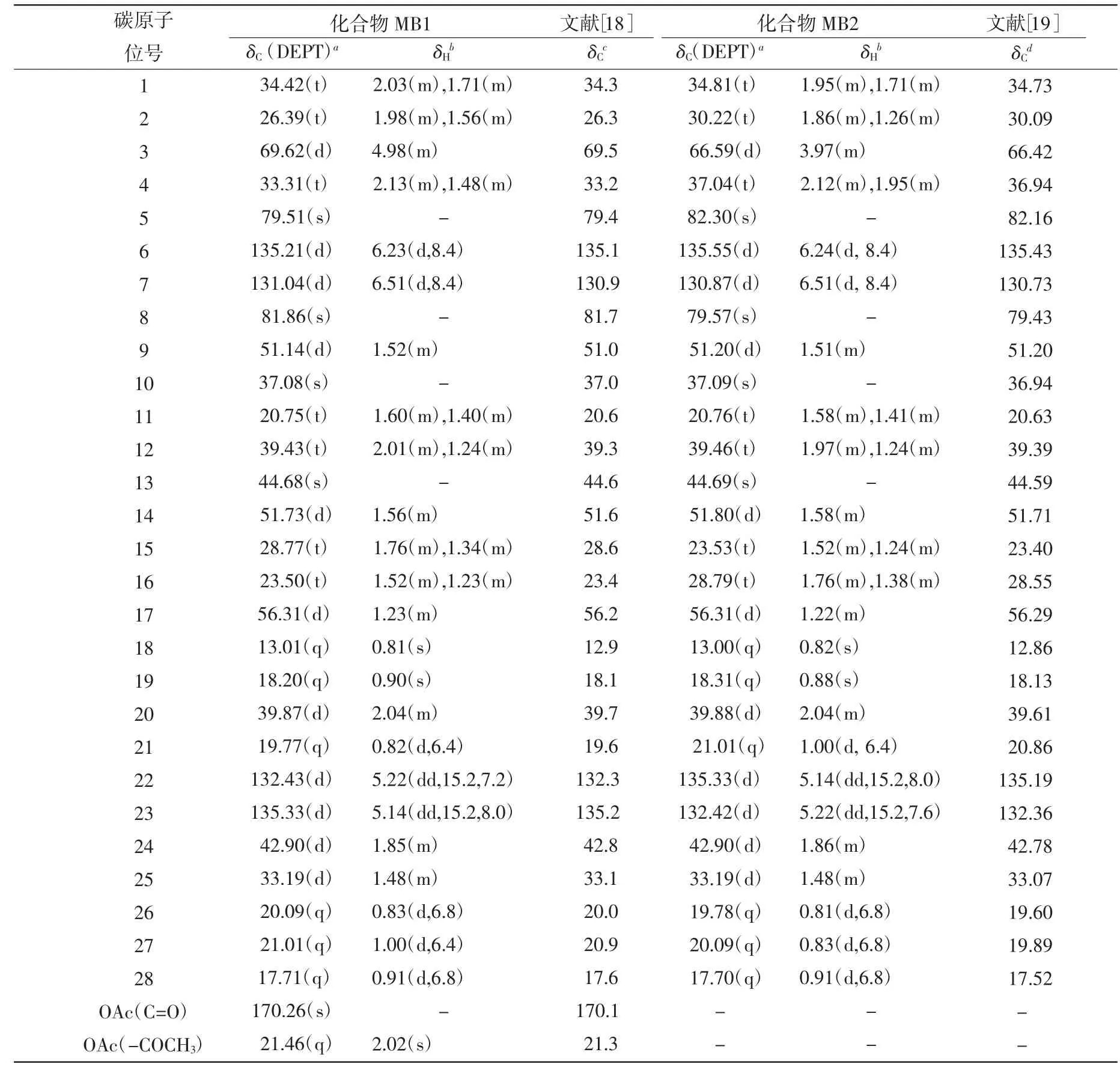
表2 化合物MB1 和MB2 的NMR 数据
3 讨论与结论
脂类是食用菌中研究最少的成分,因为它们在已知食用菌中的总含量几乎不超过干重的6%~8%。然而低脂含量则是食用菌作为营养食品的优势之一。本实验结果显示,白秃马勃菌油在其干燥子实体中含量甚微,仅占0.28%。GC-MS 分析表明该菌油以亚油酸、油酸和棕榈酸为主。自由基清除试验结果表明,该菌油在试验浓度范围内具有一定的清除DPPH 自由基活性,IC50值为26.61 mg/mL,并且自由基清除活性呈现浓度依赖关系。白秃马勃菌油中高含量不饱和脂肪酸的存在以及它具有一定的自由基清除活性,展现出白秃马勃菌油作为新型保健菌油的开发应用前景。
NMR 技术在鉴定化合物结构中具有重要的作用[20]。从白秃马勃粗脂肪还分离纯化得到2 个化合物,通过综合解析ESI-MS 谱和NMR 谱,确定它们分别为麦角甾-5,8-表二氧-6,22-二烯-3-乙酸酯(MB1)和麦角甾-5,8-表二氧-6,22-二烯-3-醇(MB2)。作为天然产物,麦角甾-5,8-表二氧-6,22-二烯-3-乙酸酯最早发现于海绵附生真菌Talaromyces trachyspermus(KUFA 0021),在高浓度256 μg/mL 时对受试革兰氏阳性细菌(Staphylococcus aureus ATCC 25923 和Bacillus subtilis ATCC 6633)和革兰氏阴性细菌(Escherichia coli ATCC 25922 和Pseudomonas aeruginosa ATCC 27853)以及真菌Candida albicans 均不敏感[18]。而化合物麦角甾-5,8-表二氧-6,22-二烯-3-醇是常见真菌甾醇。但是这2 个化合物均是首次从白秃马勃中分离得到。
