营养盐对藻类生长影响的原位实验研究
2021-06-15邓开开李奕璇方芳陈彬王伟先宇郭劲松
邓开开,李奕璇,方芳,陈彬,王伟,先宇,郭劲松
(重庆大学 环境与生态学院;三峡库区生态环境教育部重点实验室,重庆400045)
氮、磷等营养盐大量输入相对静止水体会导致富营养化并诱导水华的暴发,降低水体的生物多样性,对水生态系统产生负面影响[1]。影响藻类水华暴发的重要因素包括营养盐、气象要素(如温度、光等)、水文条件和浮游动物捕食等[2-3]。在众多因素中,水体营养盐水平是水华爆发的决定因素[4],其供给量及其变化影响着藻类生物量和净生产力[5]。营养盐供给量不仅影响藻类ATP的合成[6-7],还影响蛋白质组成[8]。目前,关于营养盐对藻类生长的计量性研究主要在实验室条件下开展。相关研究采用不同浓度的营养盐培养不同的纯藻种(蓝藻、绿藻、硅藻等),以解析影响与调控的机理。相关研究发现,当N/P为200时,能有效控制蓝藻的生长[9]。然而,实验室内得出的结果往往与自然条件下存在差异,在实验室条件下,一些细小的差距会被放大[10]。例如,Vitousek等[11]认为没有单个因素可以维持蓝藻的生存,甚至有学者发现微囊藻的密度与营养盐浓度之间没有任何相关性[12]。为了缩小室内和野外观测之间存在的差距,需要进行原位受控实验。原位受控实验以原位条件得到的结果更能反映受控因素对研究对象的实际影响[13-14]。
三峡水库是世界上最大的水利工程,库容约为39.3×108m3 [15]。自蓄水以来,三峡水库的水动力条件发生了很大的变化,导致部分支流回水区营养盐浓度过高,富营养化程度增加[16]。许多学者已经就三峡水库水华形成进行了多方面的研究。通过野外监测,探究了水华形成与环境变量间的统计关系:主要围绕降雨[17-18]、氮磷[19]、光照[20]、温度[21]、电导率[22]等环境变量展开,通过建立模型[19, 23]预测藻类对环境变量的响应;或在实验室内模拟环境变量对藻类生长的影响机理,如N、P[24]、Ca2+[25]、温度[19]、流速[20]等环境参量的受控变化;为使藻类生长环境更加接近自然环境,学者们设计了不同的原位装置以探究藻类的形成:秦镕聪等[26]利用透光性的半封闭的原位培养桶,得出了三峡库区典型优势藻的细胞N∶P比,李哲等[27]利用流速实验槽在原位条件下探究了流速对澎溪河藻类原位生长速率的影响。随着研究的逐渐深入,原位和室内实验条件下藻类与环境变量之间的关系愈加明晰,但利用原位受控实验探究藻类形成机理的研究仍有待深入。
为了研究在环境因素协同影响下营养盐对藻类生长产生影响的程度,以三峡水库的典型支流——澎溪河中的原生藻类群落作为实验和研究的对象,在2019年4月—6月的水华暴发期进行了3种不同类型的原位受控实验(磷实验、高氮实验、低氮实验),并对澎溪河原水和原位装置中的化学指标、生物指标进行监测。在探究营养盐对藻类生长影响的基础上,与外界环境因子对藻类生长的影响相结合,运用化学计量学方法和相关性分析,揭示了3种不同受控实验下藻类叶绿素a(Chl.a)形成不同变化趋势的原因,以阐明营养盐在自然背景下对Chl.a的变化造成影响的程度,为水华形成机理的研究提供依据。
1 材料与方法
1.1 研究区域概况
研究站点为澎溪河的高阳平湖(30°49′24″N—31°42′59″N,107°56′35″E—108°54′18″E),见图1。澎溪河流域气候属北回归线以北的亚热带湿润气候,季风明显,四季分明,年平均气温为17.5 ℃,年平均降水量为1 545.1 mm[28]。流域面积约为5 172 km2,是三峡库区中段北岸最大的支流[26]。高阳平湖是库区直接与干流相接的最大湖面,该处水面变宽,水体流速降低,是近年水华暴发最频繁的区域。

图1 澎溪河回水区及高阳平湖示意图[29]Fig.1 Backwater area of the Pengxi River and Lake
1.2 原位实验装置
原位实验装置如图2所示。装置由1个大的培养箱体、4个通风孔、1个透明箱盖、4个固定臂、4个水体交换管和多个小孔组成。箱体底部半径为0.15 m,高度为0.8 m,体积为56.52 L。顶部4个通风孔的半径为0.04 m。水体交换管的半径为0.05 m。

图2 原位装置及现场实验图Fig.2 Sketch map of the incubation devices and scene photographs of in situ
为了防止装置下沉,装置外部设计了固定臂,方便其固定在浮排上。与李哲等[27]设计的装置相比,增加了水体交换管和内层小孔。水体交换管管口处设置了可拆卸的双层夹板和中间夹膜,进行水体交换时更换为附带小孔的夹板和透水尼龙膜。实验期间换为无孔夹板,以隔绝外界水体交换作用。装置壁的小孔用有机玻璃覆盖,实验期间小孔不与外界连通,它的作用是使装置内部不平坦,以减少藻类沾壁。通风孔有两个作用,一是使装置内外空气得以交换,二是防止雨水、杂物落入装置造成装置内局部污染。与秦镕聪等[26]的装置材料不同,该装置采用的有机玻璃材料具有透光性好、机械强度高的特点。
实验开始前,将澎溪河原水及该时刻水中的原生藻类群落一同加入培养装置中,将装置置于浮排周围的水体中。用装置外缠绕的绳索将装置固定于浮排上,以此保障实验期间装置内除了添加的实验影响因子外,其他均与周边环境一致。
1.3 实验组设计
实验分为两个部分:一部分对澎溪河现场指标进行原位监测,另一部分则利用自主设计的原位装置在现场进行原位受控实验。藻类取自澎溪河原水,与原水共同注入原位装置中,最后装置内液体总体积为39 L(图2)。
设计了3种不同类型的实验。其中一组为磷实验组,由于氮浓度变化范围较宽,设计了两组氮实验组,分别为高氮组和低氮组。通过添加KH2PO4和NaNO3来控制原位装置中磷浓度和氮浓度,实验组的浓度均在澎溪河常年监测到的营养盐浓度范围内[30]。每组实验共设计了4个浓度梯度,分别在5个装置中同步进行(其中1个为空白组),在实验进行的同时,同步测定澎溪河原水的水样。磷实验组的加磷浓度分别为0.03、0.06、0.09、0.12 mg/L;高氮实验组的加氮浓度分别为0.30、0.60、1.20、1.80 mg/L;低氮实验组的加氮浓度分别为0.09、0.18、0.27、0.36 mg/L。由于原位条件以及实验平台承载力的限制,装置设置为5个,在采样及处理过程中,设置了3组平行结果,实验周期为7 d。
1.4 样品监测方法
实验采集了澎溪河水体和原位装置中的水样,测试了系列水质和生物质指标。溶解氧浓度和水温通过溶解氧仪在现场测定(YSI ProODO,Xylem,USA);pH值等通过多参数水质仪(WQC-30,DKK,Japan)在现场测定。采集的水样均用聚乙烯瓶分装并于4 ℃冷藏,带回实验室立即进行相关水质指标测定。测定的化学指标包括总氮(TN)[31]、总磷(TP)[32]。溶解性总氮(TDN)、溶解性总磷(TDP)浓度测定时,先将水样经GF/F(Whatman,Anpel,China)玻璃纤维滤膜(直径47 mm,孔径为0.7 μm)过滤;测定的生物指标为Chl.a和浮游植物群落。浮游植物群落测定需要将采集的水样装入塑料瓶后,加入10 mL鲁哥试剂固定。在所有的指标中,TN、TP、TDN、TDP、Chl.a均利用分光光度法测定(Chl.a需先加入丙酮在冰箱中放置24 h)[33]。
1.5 计算公式
装置内的化学指标及生物指标扣除背景的修正值通过式(1)计算。
y=y*+(y河-y0)
(1)
式中:y为装置内化学指标及生物指标的修正值(若为营养盐或叶绿素浓度,则单位为mg/L;若为水温,则单位为℃);y*为测定的装置内的化学指标及生物指标值;y河为同一时刻测定的澎溪河水中的化学指标及生物指标值;y0为同一时刻测定的空白装置内化学指标及生物指标值。
用Chl.a代表藻类的生物量,藻类比生长速率计算如式(2)所示[34]。
μ=ln(x2/x1)/t
(2)
式中:μ为藻类的比生长速率,d-1;x1为Chl.a当日开始时的浓度,mg/L;x2为Chl.a在t时刻的浓度,mg/L;t为培养时间,d。
藻类质量利用Kasprzak等[35]建立的Chl.a与细胞质量之间的关系模型进行计算。
0.229(logBMcount)2-0.040(logBMcount)3
(3)
式中:Chl.a的单位为mg/L;BMcount为细胞质量,mg/L。
1.6 数据统计分析
所有数据利用SPSS软件进行统计分析:采用单因素分析(P<0.05时具有差异,P<0.01时具有显著差异)来说明方差相同的数据间差异显著性。采用Kruskal-Wallis分析(K-W)说明方差不同的数据间差异显著性。采用Pearson相关性分析说明环境因素之间的相关关系(相关系数用r表示,相关系数在0.4~0.5之间代表强相关,相关系数在0.5~1之间代表极强相关)。
2 结果与分析
2.1 营养盐对藻类生长的影响
2.1.1 磷元素对藻类生长的影响 实验设置5个不同磷浓度(原水、0.03、0.06、0.09、0.12 mg/L)对澎溪河藻类进行培养,磷对藻类生长的影响实验结果如图3(a)、(b)所示。如图3(a)所示,在实验初期,原水与实验组的Chl.a平均浓度均为0.04 mg/L。在实验结束后(第7天),原水与实验组中的Chl.a含量呈下降趋势,在第7天,净投磷浓度为0.06 mg/L时Chl.a的浓度最低,为初始浓度的4.24%。但单因素方差分析表明,各磷浓度实验组间Chl.a差异不显著(P>0.05)。如图3(b)所示,实验期间比生长速率大多为负值。
2.1.2 氮元素对藻类生长的影响 氮实验分为低氮实验组与高氮实验组,共设计了10个不同氮浓度对澎溪河原位藻类进行培养:其中,高氮实验组的氮浓度分别为原水、0.30、0.60、1.20、1.80 mg/L;低氮实验组的氮浓度分别为原水、0.09、0.18、0.27、0.36 mg/L。
高浓度氮对藻类生长的影响实验结果如图3(c)、(d)所示。在实验初期,原水与实验组的平均Chl.a浓度为0.06 mg/L。在实验期间各实验组中的藻类生物量先上升后下降,且实验组中的藻类生物量显著小于(P<0.05)原水中的藻类生物量。原水中的Chl.a含量在所有组别中第4天达到最大值,为初始平均浓度的10.37倍。Chl.a在4个实验组中的浓度无显著差异(P>0.05),但显著小于原水中的浓度(P<0.01)。
低浓度氮对藻类生长的影响如图3(e)、(f)所示。在实验初期,原水与实验组的平均Chl.a为0.88 mg/L,实验期间Chl.a浓度呈下降趋势。在实验结束时,原水与实验组的平均浓度Chl.a下降为初始平均浓度的10.92%,为0.10 mg/L。Chl.a在5个组别中的浓度无显著差异(P>0.05)。

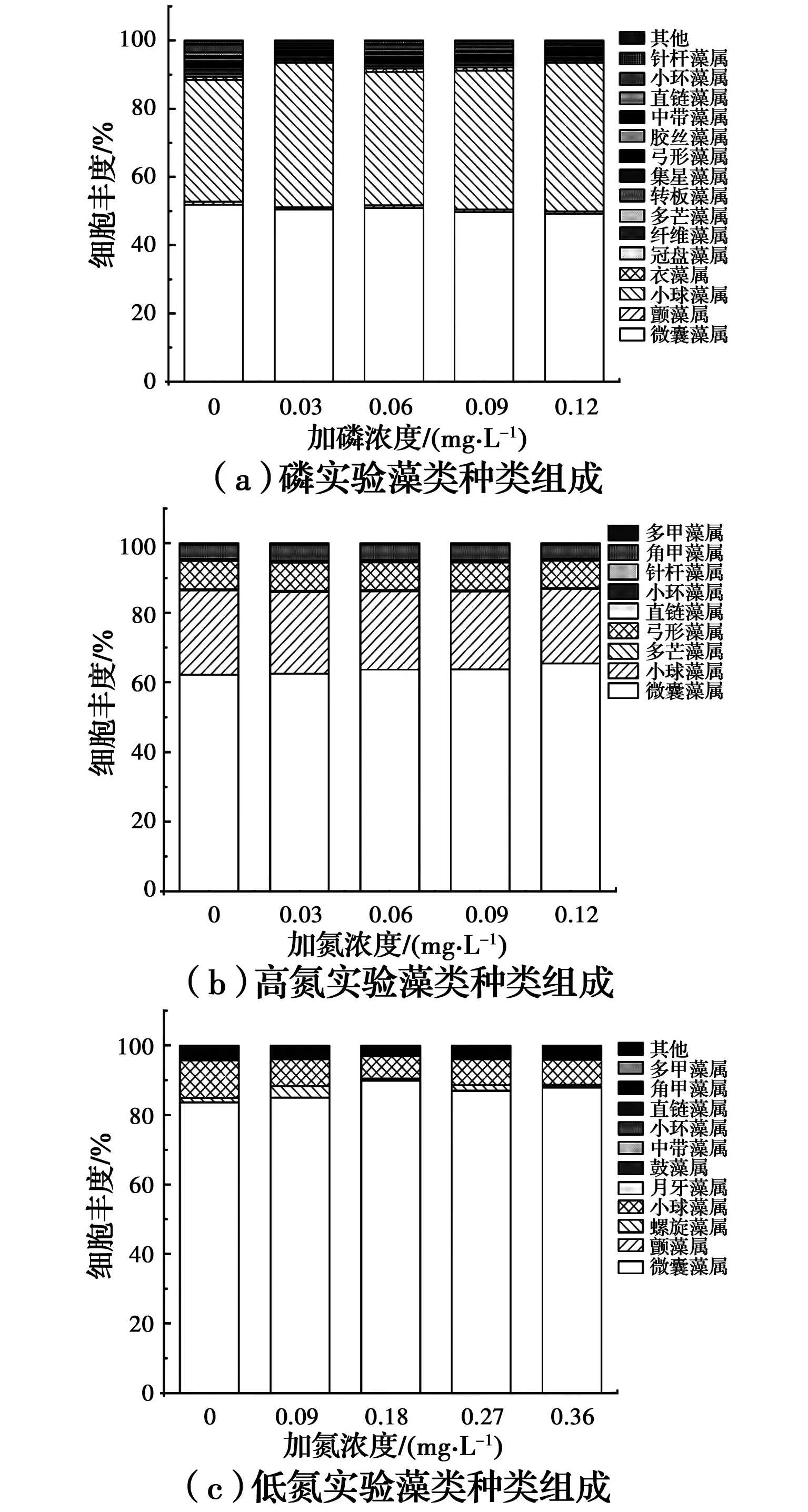
图3 不同实验条件下Chl.a和比生长速率变化(误差棒代表3组样本的方差(±1SD) Chl.a(o,i,m,n 利用化学计量学方法判断实验期间是否存在营养盐不足以支持藻类生长的现象。以式(3)为基础,结合Stumm等[36]得出的微藻计量化学关系,同时类比一般藻类光合作用反应机理,得到微藻的光合作用反应式为 C106H263O110N16P+138O2+154H2O (4) 根据式(3)中Chl.a与藻细胞质量的关系式,得到的质量值如表1所示:1)在磷实验期间,原水中藻细胞质量的起始值为1.66 mg/L;在实验组中,当磷净添加浓度分别为0.03、0.06、0.09、0.12 mg/L时,藻细胞的起始质量值分别为1.68、1.67、1.67、1.67 mg/L。2)在高氮实验期间,原水中的藻细胞质量起始值为1.72 mg/L;在实验组内,当氮净添加浓度分别为0.3、0.6、1.2、1.8 mg/L时,藻细胞的质量起始值分别为1.70、1.72、1.69、1.70 mg/L。3)在低氮实验期间,原水中藻细胞质量的起始值为4.97 mg/L;在实验组内,当氮净添加浓度分别为0.09、0.18、0.27、0.36 mg/L时,藻细胞的质量起始值分别为5.02、4.77、4.77、4.86 mg/L。 表1 藻类生长所需的最低营养盐值Table 1 Minimum nutrient concentrations required for algae growth 将上述得到的质量值代入式(4)即得到藻类生长所需的最低营养盐浓度值,计算结果如表2所示。 1)磷实验期间,原水和实验组内营养盐浓度满足藻类生长所需的最低营养盐浓度:藻类在原水及实验组内生长所需最低磷浓度值(以KH2PO4计,下同)为0.06 mg/L,氮浓度值(以NaNO3计,下同)为0.64 mg/L。表2显示磷实验期间原水的总磷浓度值为0.06 mg/L,总氮浓度值为1.83 mg/L;4个实验组内的平均总磷浓度范围为0.09~0.16 mg/L,总氮浓度范围为2.22~2.88 mg/L。说明磷实验期间营养盐浓度范围满足藻类生长所需的最低营养盐浓度。 2)高氮实验期间,原水和实验组内营养盐浓度满足藻类生长所需的最低营养盐浓度:高氮实验期间,原水中藻类生长所需的最低磷浓度为0.07 mg/L,最低氮浓度为0.66 mg/L;在实验组中,当净投氮浓度分别为0.3、0.6、1.2、1.8 mg/L时,藻类生长所需的最低磷浓度分别为0.07、0.07、0.06、0.07 mg/L,所需的最低氮浓度值分别为0.65、0.66、0.65、0.65 mg/L。表2显示高氮实验期间原水的总磷浓度值为0.20 mg/L,总氮浓度值为2.26 mg/L;而实验组内的平均总磷浓度范围为0.17~0.18 mg/L,总氮浓度范围为2.99~4.33 mg/L。说明高氮实验期间营养盐浓度值范围满足藻类生长所需的最低营养盐浓度。 3)低氮实验期间,原水和实验组内的氮浓度基本满足藻类生长所需最低氮浓度,但磷浓度不满足藻类生长所需的最低磷浓度:藻类在原水中生长所需的最低磷浓度值为0.19 mg/L,最低氮浓度值为1.90 mg/L;对于实验组,当净投氮浓度分别为0.09、0.18、0.27、0.36 mg/L时,藻类生长所需的最低磷浓度值为0.19、0.18、0.18、0.19 mg/L,所需的最低氮浓度值为1.92、1.83、1.83、1.86 mg/L。表2结果显示,低氮实验期间,原水中的总磷浓度值为0.10 mg/L,总氮浓度值为1.73 mg/L;而实验组内的平均总磷浓度值均为0.11 mg/L,总氮浓度范围为1.88~2.49 mg/L。说明低氮实验期氮浓度范围部分满足藻类生长所需的最低氮浓度,而磷浓度范围不满足藻类生长所需的最低磷浓度。 表2 实验期间营养盐浓度和环境因素测试值Table 2 General nutrient concentrations and environmental conditions for the Pengxi River during the experimental period 综上所述,磷实验、高氮实验期间的氮、磷浓度均足以支持藻类生长,而低氮实验期间的磷浓度不足以支持藻类的生长。 实验期间藻类细胞丰度如图4所示。磷实验期间共监测到4门16种,其中,蓝藻门2种,绿藻门10种,硅藻门3种,甲藻门1种。高氮实验期间共监测到4门9种,其中,蓝藻门1种,绿藻门3种,硅藻门3种,甲藻门2种。低氮实验期间监测到4门16种,其中,蓝藻门4种,绿藻门8种,硅藻门2种,甲藻门2种。 图4 实验期间藻类种类组成Fig.4 Species composition of algae under different 磷实验期间的原水及实验组内的优势藻为微囊藻属和小球藻属(图4(a)),平均值分别占总数的50.45%和40.29%。高氮实验期间的原水及实验组内的优势藻为微囊藻属和小球藻属(图4(b)),平均值分别占总数的63.53%和22.79%。低氮实验期间原水及实验组内的优势藻为微囊藻(图4(c)),平均值占总数的86.65%。 值得注意的是,原水与实验组的细胞丰度差异不显著(ANOVA,P>0.05),且在低氮实验期间微囊藻的细胞丰度最大。 温度是影响藻类生物量的关键因素之一[37],它不仅影响脂质和蛋白质的合成,细胞代谢和藻类细胞的光合作用[5],还会通过改变藻类细胞膜通透性来影响它们对营养盐的吸收能力[38]。温度过低将严重影响藻类的生长。实验结果表明,磷实验和高氮实验期间的优势藻为蓝藻(微囊藻)和绿藻(小球藻),而低氮实验期间的优势藻类为蓝藻(微囊藻)。适合蓝藻生长的温度范围为22~23.7 ℃[14],而小球藻则在16~25 ℃的温度范围内生长较快[39]。磷实验期间和高氮实验期间内的适宜温度范围使得小球藻和微囊藻成为此时的优势藻。氮是藻类遗传物质合成和生长的必要物质,氮营养盐的缺乏会降低藻细胞叶绿素a含量,最终导致藻类光合作用效率降低[35]。因此,氮浓度较低会降低微囊藻和小球藻的细胞生长速率,且由于氮缺乏对小球藻的抑制更强,最终使微囊藻成为低氮组中的优势藻。 另外,观察到Chl.a与水温在磷实验期间具有明显的相关性(rchl.a-水温=0.82),但同样的情况没有出现在高氮实验与低氮实验中。导致相同的两个因素相关性在不同条件下结果不一致的潜在原因包括:(a)两种因素在理论上不相关;(b)两种因素的相关性是由其他因素作为中间桥梁建立起来的;(c)对于复杂的系统,变化因素受到多种因素的冲突影响[40];(d)两种因素之间的相关性需要满足一定的条件[41]。 水温与Chl.a在磷实验期间相关,而在氮实验中不相关应是由(c)和(d)两种原因引起的: 1)原因(c)是引起氮实验期间Chl.a与水温不相关的一个原因。荀尚培等[42]的研究得出外源的汇入、水环境的不稳定都会导致叶绿素与水温的相关性程度不高。本实验为原位实验,且主要受控因素为外源营养盐浓度:在高氮实验期间,叶绿素浓度与TP高度相关(rchl.a-TP=0.88),在低氮实验期间,叶绿素浓度与TN高度相关(rchl.a-TN=-0.50)。因此,在氮实验期间,水温与Chl.a浓度间没有明显相关性的一个潜在原因是其他环境因子对叶绿素浓度造成的影响更大,而导致了水温与叶绿素浓度相关性不高。 2)原因(d)是引起氮实验期间Chl.a与水温不相关的另一个原因。只有当温度是限制藻类生长的一个决定性因素时,温度与Chl.a间才会具有强烈的相关性[42]。与磷实验相比,氮实验的温度相对较高(表2),也更适合微囊藻和小球藻的生长,因此,氮实验中限制藻类生长的决定性因素并不是水温。 上述结果说明,在氮实验中藻类生长的限制性因素并不是温度,而是其他因素。而与氮实验相比,磷实验期间Chl.a与水温具有较高的相关性。 将磷实验期间的Chl.a浓度和水温进行非线性拟合,结果如图5所示。结果表明,当温度大于20 ℃时,藻类生物量表现出明显的增长趋势,这一结果与之前学者得出的结论接近[39]。但是磷实验期间,实验组和原水的平均水温为19.86 ℃,低于20 ℃。因此,只有在温度低于藻类最适生长温度的情形下,Chl.a和水温之间的相关性才会显著。 图5 磷实验期间水温与Chl.a的非线性拟合结果Fig.5 Linear relationship between water temperature and Chl.a. (Error bars represent ±1SD of samples around this point) 藻类生长所需的最低营养盐浓度值实验结果表明,磷实验期间与高氮实验期间,藻类生长环境的营养盐浓度满足藻类生长所需的最低营养盐浓度值,但高氮实验组中的藻类生物量明显低于原水,因此,需要探究是否是因为营养盐浓度过高抑制了藻类生长。 首先需要判断两种实验期间的限制性底物。判定限制性底物的第1种方法为Monod等[43]提出的比生长速率与营养盐浓度之间的相关性理论:若某种营养盐与比生长速率相关,则藻类生长受到该营养盐的限制(下文简称Monod法);第2种方法为Redfield等[44]提出的N∶P比理论值:当N∶P>16时,藻类生长受磷限制;当N∶P<16时,藻类生长受氮限制;当N∶P=16时,藻类生长受氮和磷的共同限制(下文简称Redfield法)。 在磷实验期间,实验组内平均N∶P比的最小值为37.05>16(表2),表明磷是此时的限制性底物[44]。但没有观察到比生长速率与总磷之间具有显著相关性(rμ-TP=0.07),这是因为此时水温对藻类生长有更强烈的影响(rchl.a-水温=0.82),导致总磷与比生长速率之间的相关性被削弱。 在高氮实验期间,实验组内平均N∶P比的最小值为40.62>16(表2)。总磷、正磷酸盐与藻类比生长速率三者中两两之间均具有明显的相关性(rμ-TP=0.77,r正磷酸盐-TP=0.98,rμ-正磷酸盐=0.73)。根据Redfield法和Monod法,磷(主要是正磷酸盐)是此时的限制性底物。 在低氮实验期间,实验组内平均N∶P比的最小值为27.60>16(表2)。Monod法表明比生长速率与总氮(rμ-TN=0.43)、总磷(rμ-TP=0.72)均具有一定的相关性,说明低氮实验阶段藻类生长可能受到氮和磷的共同限制,且磷对藻类生长的限制高于氮,此时藻类生长可能处于两种营养盐转换的过渡阶段,N∶P值被认为是最适N∶P值[45],且该值会随着生境变化而改变[46],说明澎溪河藻类生长的最适N∶P范围为27.60~36.53,可近似判断该值为4个实验组内的N∶P平均值,即32.52。另外,观察到比生长速率与正磷酸盐具有强烈相关性(rμ-正磷酸盐=0.68),而TDN与总氮具有强烈相关性(rTDN-TN=0.92),即说明低氮实验期间引起磷限制的营养盐为正磷酸盐,引起氮限制的营养盐为TDN。 综上,磷是磷实验、高氮实验期间的限制性底物,而氮和磷都是低氮实验期间的限制性底物,且澎溪河藻类生长的最适N∶P比约为32.52。 应当注意到,磷是3种实验条件共同的限制性底物。当营养盐为限制性底物时,藻类生长与营养盐浓度具有相关性,据此建立了TP和Chl.a的非线性拟合模型。非线性拟合结果表明,当TP为0.12 mg/L时,Chl.a将达到最大值。根据最适N∶P比为32.52,可以得出当TN为限制性底物且值为2.44 mg/L时,Chl.a将达到最大值。 图6模拟曲线的结果表明,营养盐超过了最适值后,藻类生物量会随着营养盐浓度升高而下降。表3列出了每组实验中超出了最适TN、TP值的实验个数所占的比例,结果表明,高氮实验中磷浓度、氮浓度超过最适值所占比例最大。 图6 多项式拟合ln(TP)与ln(Chl.a)的非线性关系结果Fig.6 Linear relationship between ln(TP) and ln (Chl.a) (Error bars represent ±1SD of samples 表3 营养盐高于藻类生长的最适营养盐浓度的实验占比Table 3 Ratio of nutrient concentration higher than the suitable concentration for algae growth during the experimental period 在特定的时空条件下,一定范围内营养盐浓度的增加会促进藻类生长并改变藻类的群落结构。为了明确藻类群落变化与营养盐浓度的相关性,对藻类群落的变化进行Pearson相关性分析,结果如图7所示。 在磷实验期间(图7(a)),藻类的生物量与种类随着磷浓度的升高而升高,其中与温室效应、富营养化密切相关的微囊藻和小球藻是各实验组中的优势藻类。磷实验结束后,微囊藻属与衣藻属(P=-0.17)、颗粒直链藻属(P=-0.22)、颤藻属(P=-0.21)、和针杆藻属(P=-0.20)呈负相关性(0.05<|p|<0.5),微囊藻属与集星藻属(P=-0.08)呈显著负相关性(0.01<|p|<0.05);小球藻属与衣藻属呈极显著负相关性(0<|p|<0.01),与颗粒直链藻(P=-0.12)和集星藻(P=-0.20)呈负相关性(0.05<|p|<0.5)。这一结果说明微囊藻和集星藻或小球藻和集星藻间会出现此消彼长的现象。观察到只有磷实验中存在这一现象,说明磷实验与氮实验中,不同环境条件是触发这一现象的前提,而不同的环境条件主要表现在较低的温度和磷浓度上(表2),但目前还无法得到确切的证据,是否存在这一现象还需进一步研究验证。 在高氮实验过程中(图7(b)),藻类的种类和生物量随着氮浓度的升高而降低。此时,微囊藻和小球藻与其他藻类的相关性较弱。说明当水体氮浓度高于藻类的生长需求时,藻类之间生长的相关性将不再受营养盐的调控。 在低氮实验过程中(图7(c)),藻类的种类与生物量随着氮浓度的升高而升高。与磷实验相同,微囊藻属与多甲藻属(P=0.28)、与团藻属(P=0.14)呈正相关性(0.05<|p|<0.5);小球藻属与团藻属呈极显著正相关性(P=0.007)(0<|p|<0.01),与多甲藻藻属(P=0.26)呈正相关性(0.05<|p|<0.5)。这一结果表明在低氮实验条件下,团藻与多甲藻藻属可能与微囊藻属与小球藻属存在共生关系。 图7 属水平藻类之间的皮尔森相关性分析Fig.7 Pearson correlation analysis between algae characteristics at genus 在磷实验过程中(图8(a)),RDA第1轴和第2轴分别解释了33.5%和16.8%的藻类活性与环境之间的关系,所有环境因子共能解释藻类群落变异的50.1%。电导率对藻类活性的影响最大,为变异总数的11.3%;光照次之,为变异总数的10.5%;TN为变异总数的8.6%。研究发现,电导率是影响藻类群落结构的重要环节因子,藻类活性随着电导率的改变而出现明显变异,但其他重要的环境因子未能与藻类活性产生明显的相关性,可能是自然条件下环境因子之间存在复杂的相互作用,出现了类似重叠效应的情况而难以区分主次。 在高氮实验过程中(图8(b)),RDA第1轴和第2轴分别解释了30.5%和12.8%的藻类活性与环境的关系,所有环境因子共能解释藻类群落变异的43.3%。光照强度是影响藻类活性的主要因素,为变异总数的9.7%;其次是TN,为变异总数的8.6%;然后是温度,为变异总数的6.9%。光照强度往往会与温度的变化密切相关,但因为光照强度与藻类光合作用密切相关,因此,常用来解释其对藻类活性变化的影响。研究发现,在高氮条件下,藻类活性最容易受到光照影响。因此,当水中营养盐的含量超过藻类生长所需阈值,光照强度将成为影响藻类活性的关键因素。 在低氮实验过程中(图8(c)),RDA第1轴和第2轴分别解释了32.1%和16.6%的藻类活性与环境的关系,环境因子共能解释藻类群落变异的48.7%。温度是影响藻类活性变化的主要因素,为变异总数的10.6%;其次是Chl.a,为变异总数的9.3%。藻类活性会受到温度影响,但若氮源不足,藻细胞就会进入内源呼吸的状态,以此维持自身代谢和光合作用,直至细胞衰亡;在藻细胞生长以及内源呼吸的后期,藻细胞会分解Chl.a来为自身供能。因此,Chl.a为低氮条件下影响藻细胞活性的重要因素。 图8 不同营养盐对属水平藻类活性的冗余分析(RDA)Fig.8 Redundancy analysis (RDA) of algae activity of different nutrients on genus 表3结果说明磷实验与高氮实验均存在部分营养盐浓度超过最适浓度值的现象,且高氮实验中营养盐浓度超过最适营养盐值占比大于磷实验,但是两种实验类型下叶绿素的变化趋势并不相同:高氮实验叶绿素浓度呈先上升后下降的趋势(图3(b)),而磷实验期间叶绿素呈下降趋势。高氮实验中实验组内叶绿素浓度的最大值低于原水中叶绿素浓度的最大值,但叶绿素变化趋势一致,这是因为高浓度的氮会产生氧化胁迫,从而抑制藻类的光合作用并降低藻类的生物量[47-49],且高浓度营养盐只会降低藻类生物量的大小而不会改变变化趋势。另外,磷实验的营养盐浓度水平虽然部分超过了最适营养盐值,但明显低于高氮实验(表3),这说明磷实验期间藻类生物量趋势的改变可能不是由高营养盐而是温度导致。 值得注意的是,尽管高浓度营养盐也会抑制藻类的生长,但这种抑制程度会由于藻类自身的适应能力被削弱,因为藻类能够通过3种方式适应环境变化:通过改变藻类群落构成来应对环境的改变[50];通过浮力或者运动力调整自身在水中的位置[51];通过改变自身细胞大小适应周围环境的变化[52]。 藻类生物量在高氮试验和低氮实验中变化趋势也不同,高氮实验期间实验组内营养盐浓度大于藻类生长所需,而低氮实验组内的磷浓度略低于藻类生长所需的最低磷浓度范围。说明与高氮实验相比,低氮实验期间中的磷浓度不足以支持藻类的生长。而Zhang等[53]的研究表明,营养盐的缺乏会导致藻类代谢减慢并抑制藻类生长。因此,低氮实验期间藻类生物量的下降趋势是磷浓度过低引起的。 综上所述,磷实验期间藻类生物量下降的原因是水温过低抑制了主要藻种的生长,模型计算结果表明,当温度高于20 ℃时才适合藻类生长。高氮实验期间,实验组内生物量低于原水的原因是营养盐浓度过高,但高营养盐只改变了实验组内藻类生物量的大小而没有改变生物量的变化趋势。低氮实验期间藻类生物量下降的原因是营养盐浓度(主要是磷)过低,而不足以支持藻类生长。 因此,对于澎溪河,只有当水温高于20 ℃且营养盐浓度高于藻类生物量化学计量学上的最低值时,藻类生物量才会呈现上升趋势。另外,3种实验结果说明,藻类生长会受到高营养盐浓度、低营养盐浓度、低水温的抑制,且藻类对3种抑制条件的敏感性为:水温/营养盐过低>营养盐浓度过高。 以营养盐浓度作为受控因素,以澎溪河原生藻类群落作为研究对象,利用自主设计的实验装置,探究了营养盐对藻类影响程度,得出如下结论: 1)澎溪河藻类生长同时受到氮和磷两种营养盐限制时的N∶P比为32.52,这个比值也是澎溪河藻类生长的最适N∶P。澎溪河藻类生长的最适磷浓度值为0.12 mg/L,最适氮浓度值为2.44 mg/L。 2)当澎溪河水中总氮浓度高于2.44 mg/L时,藻类的生长会受到抑制,但高营养盐浓度只改变藻类生物量的大小而不改变藻类生物量的变化趋势。 3)对于澎溪河的原生藻类,营养盐浓度过高(氮浓度高于2.44 mg/L)、营养盐浓度过低(低于化学计量学上藻类所需要最低营养盐浓度)、水温过低(低于20℃)均会抑制藻类的生长,且藻类对3种抑制条件的敏感性为:水温/营养盐浓度过低>营养盐浓度过高。因此,澎溪河水华的暴发需要同时满足温度(水温高于20 ℃)条件和营养盐条件(氮、磷浓度高于化学计量学上藻类所需要的最低营养盐浓度)。2.2 藻类生长所需的最低营养盐浓度值


2.3 实验期间藻种组成
3 讨论
3.1 温度对藻类生长的影响

3.2 藻类所需的最适营养盐浓度值


3.3 藻类群落结构的变化

3.4 不同营养盐对藻类的影响

3.5 叶绿素变化趋势机理分析
4 结论
