利拉鲁肽前体肽GLP-1(7-37)K34R在大肠埃希菌中的表达与优化*
2021-06-15李朋彦周成慧李潜赵伟罗学刚
李朋彦,周成慧,李潜,赵伟,罗学刚
(1.天津科技大学生物工程学院工业发酵微生物教育部重点实验室暨天津市工业微生物重点实验室,天津 300457;2.天津市微生物代谢与发酵过程控制技术工程中心,天津 300457;3.正大天晴药业集团股份有限公司,南京 210046)
糖尿病、高脂血症等糖脂代谢紊乱性疾病已成为威胁人类生活质量及经济社会发展的重大公共卫生问题[1]。胰高血糖素样肽1(glucagon-like peptide-1,GLP-1)是一种肠促胰岛素激素,在糖脂代谢的实时应答调节过程中发挥至关重要的作用[2]。但天然的GLP-1在体内不稳定,半衰期仅约2 min,临床可行性差[3]。利拉鲁肽(liraglutide)是将人GLP-1(7-37)第34位的Lys替换为Arg(K34R),同时在第26位Lys上引入一个由Glu介导的16碳棕榈酸侧链[4]。利拉鲁肽保留GLP-1的全部生物活性,不良反应显著减少,且体内半衰期可延长至13 h[5-6]。大量研究证实,利拉鲁肽不仅具有高效、持久的降糖效果,且可显著改善细胞功能,为2型糖尿病治疗带来福音[7-8]。但此药物价格相对较高,而迄今国内还没有利拉鲁肽生物类似药获批上市。笔者在本研究利用遗传背景清楚、成本低、易于产业化的大肠埃希菌表达系统[9],对GLP-1(7-37)K34R(简称GLP1a)的基因工程表达制备工艺进行探索研究。由于大肠埃希菌过量表达蛋白时常形成不可溶的包涵体[10],且GLP1a相对分子质量小(31个氨基酸),对基因工程表达及分离纯化都十分不利。为了提高目的蛋白的可溶性与及分离纯化效率,笔者在本研究将目的蛋白分别与谷胱甘肽转移酶(GST)、泛素(Ub)、小泛素相关修饰蛋白(SUMO)等3种不同标签蛋白进行融合,分析比较其可溶性表达效果[11]。优化表达工艺条件,最终通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)和高效液相色谱(HPLC)对所获目的蛋白进行分析确证。
1 材料与方法
1.1菌株和载体 大肠埃希菌(Escherichiacoli,E.coli)菌株DH5α、Rosetta(DE3)均为天津市工业微生物重点实验室保存。pE-SUMO质粒购自lifesensors,pET28a+、pGEX-6p-3质粒均为本实验室保存。
1.2主要试剂 质粒小提试剂盒(北京索莱宝科技有限公司,批号:20180610),BCA Protein Assay Kit(Thermo Scientific公司,批号:EE60997A),GLP-1(7-37)K34R标准品(正大天晴药业集团股份有限公司),限制性内切酶(Fermentas公司,批号:LT02241),T4 DNA连接酶(Thermo Scientific公司,批号:00353024),Pfu DNA聚合酶(批号:K21029)和dNTPs(批号:M10316)购自北京康为世纪生物科技公司,其他试剂均为国产分析纯,PCR引物和Ub基因合成以及序列测序均由金唯智生物科技有限公司(苏州)完成。
1.3glp1a系列表达载体的构建与鉴定 通过glp1a的氨基酸序列,按大肠埃希菌密码子偏爱性进行优化后获得编码基因序列,同时,为了后续纯化能切除融合标签,在glp1a基因前面肠激酶切割位点的编码DNA序列。文中所用引物序列见表1。glp1a基因是由3条引物通过重叠延伸PCR技术扩增得到的,首先以P1/F、P1/Z为引物,扩增得到片段A;然后以P1/F、P1/R为引物,片段A为模板扩增得到目的片段glp1a,回收目的片段。①将回收的glp1a目的片段利用引物P6/F、P6/R克隆到pGEX-6p-3表达载体的BamHⅠ和SalⅠ酶切位点之间,构建表达载体pGEX-6p-3- glp1a。②化学合成Ub编码DNA,将回收的glp1a目的片段和Ub利用引物P7/F、P7/R,通过重叠PCR整合到一起,将扩增产物连接到pET28a载体的EcoRⅠ和NcoⅠ酶切位点之间,构建表达载体pET28a-Ub-glp1a。③将回收glp1a目的基因利用引物P9/F、P9/R克隆到pE-SUMO的BsaⅠ和HindⅢ酶切位点之间。构建表达载体pE-SUMO-GLP1a。

表1 引物序列
将以上三个重组质粒分别转化至大肠埃希菌DH5α感受态,涂布于含有卡那霉素(50 μg·mL-1)的LB平板,培养12~16 h,分别挑取转化子进行菌落PCR验证,将正确的质粒送至测序公司,得到构建成功的重组质粒pGEX-6p-3-GLP1a、pET28a-Ub-GLP1a、pE-SUMO-GLP1a。
1.4GLP1a蛋白的表达及SDS-PAGE分析 提取构建成功的重组表达质粒pGEX-6p-3-GLP1a、pET28a-Ub- GLP1a和pE-SUMO-GLP1a。分别转化E.coliRosetta (DE3)感受态细胞。挑取单菌落于5 mL含卡那霉素(50 μg·mL-1)、氯霉素(34 μg·mL-1)的LB培养基中过夜培养。将过夜培养菌液按2%接种量于50 mL发酵培养基中(250 mL摇瓶),37 ℃,200 r·min-1培养至吸光度(A600)为0.6~0.8时,加入终浓度1 mmol·L-1的IPTG,在25 ℃,200 r·min-1条件下诱导培养12 h。同时以空质粒pGEX-6p3、pET28a+和pE-SUMO转化E.coliRosetta(DE3)诱导培养作为阴性对照。
诱导完后,于4 ℃,10 000 r·min-1离心10 min,收集菌体,用磷酸盐缓冲液(PBS)洗涤菌体3次,超声破碎菌体。破碎后未离心的标记为全菌体;12 000 r·min-1(r=13.5 cm)离心10 min,上清标记为上清液;沉淀标记为沉淀。3个样品经SDS-PAGE电泳检测,利用Odyssey成像,图片经Quantity one软件分析各样品上清液中目的蛋白的百分含量,根据BCA测定的各个菌体上清液中总蛋白浓度,计算出各菌体上清液中目的蛋白浓度。
1.5优化蛋白表达 为提高目的蛋白在大肠埃希菌表达系统中表达量,对关键因素进行优化,其中包括诱导温度、诱导时机、诱导剂浓度和诱导时间[12]。
1.5.1诱导温度的优化 将上述构建成功的目的菌株按2%接种量于50 mL发酵培养基中(250 mL摇瓶),37 ℃,200 r·min-1培养至A600为0.6时,加入终浓度为1 mmol·L-1的IPTG,分别在25,30,37 ℃,200 r·min-1条件下诱导培养6 h。
1.5.2诱导时机的优化 首先测定菌体在37 ℃培养时生长曲线,选择A600为0.6,0.8和1.0时,分别用终浓度为1 mmol·L-1的IPTG,按照前面得到的最佳诱导温度诱导6 h。
1.5.3诱导时间优化 用前面实验得到最佳优化温度和时机,加入终浓度为1 mmol·L-1的IPTG分别诱导4,6,8,10 h。
1.5.4IPTG浓度优化 按照前面实验优化好的表达条件,分别加入0.2,0.4,0.6,1.0 mmol·L-1的IPTG进行诱导。
1.6GLP1a融合蛋白的纯化和分析
1.6.1融合蛋白的纯化 超声裂解后的菌体,10 000 r·min-1(r=13.5 cm),4 ℃离心10 min,收集上清液中可溶性的融合蛋白,并用孔径0.45 μm滤膜滤过。加入和菌体上清液等体积结合缓冲液[20 mmol·L-1Tris-HCl(pH值7.9),10 mmol·L-1咪唑,0.5 mol·L-1氯化钠],将上清液稀释后负载上柱。上样完后使用结合缓冲液冲洗树脂,洗脱和树脂非特异性结合的杂蛋白。使用洗脱缓冲液[20 mmol·L-1Tris-HCl(pH值7.9),咪唑梯度,0.5 mol·L-1氯化钠]进行洗脱,分别用10,50,100,300 mmol·L-1咪唑洗脱缓冲液进行洗脱,收集300 mmol·L-1咪唑洗脱液。300 mmol·L-1咪唑洗脱液通过梯度浓度透析以除去咪唑和降低盐离子浓度,再于50%甘油(10 mmol·L-1PBS配制)透析12 h,以浓缩目的蛋白。在浓缩后蛋白90 μL(约50 μg)中,加入2 U·μL-1重组肠激酶0.5 μL和10×缓冲液10 μL,最后用去离子水定容到100 μL,25 ℃酶切16 h。将酶切蛋白采用SDS-PAGE分析。
1.6.2高效液相色谱法分析 将酶切后回收蛋白利用高效液相色谱法分析。色谱条件:色谱柱:Jupiter Proteo 90A(4.6 mm×250 mm,4 μm)Phenomenex C12柱;流速:1.0 mL·min-1;柱温:35 ℃;进样体积:30 μL;检测波长:215 nm;流动相A:磷酸二氢铵11.5 g,乙腈100 mL,85%磷酸调pH值至3.7,超纯水定容至1 000 mL;流动相B:乙腈960 mL、水270 mL;精密称取标品0.001 0 g,超纯水定容至2 mL,超声波溶解制得0.5 mg·mL-1的供试品溶液。
2 结果
2.1GLP1a系列重组蛋白表达载体的构建 对GLP1a基因进行大肠埃希菌的密码子优化,构建3个表达载体质粒pGEX-6p-3-GLP1a、pET28a-Ub-GLP1a和pE-SUMO-GLP1a,见图1-A。质粒通过BamHⅠ、SalⅠ双酶切和PCR产物鉴定,见图1-B中各电泳图的1和2泳道所示,分别得到符合预期的目标条带,表明质粒构建成功,再进行测序后,将测序正确的转化子用于下一步试验。
2.2GLP1a不同融合蛋白的可溶性表达分析 重组大肠埃希菌在25 ℃下,经IPTG诱导12 h,超声裂解菌体,将得到空载菌株超声裂解液、重组菌株超声裂解液全菌体、裂解液上清液、裂解液沉淀进行SDS-PAGE分析,结果见图2。可以发现IPTG诱导后的pGEX-6p-3-GLP1a、pET28a-Ub-GLP1a、pE-SUMO- GLP1a相对分子质量分别约为30 600,14 190,16 280,相对分子质量与理论值一致。由图可明显看到融合GST、Ub和SUMO标签后,蛋白主要以可溶形式表达,极大促进目的蛋白的溶解性。
2.3不同标签融合GLP1a的表达条件优化与比较
2.3.1E.coliRosetta(DE3)/pGEX-6p-3-GLP1a菌株的表达条件优化 将菌株表达条件逐一进行优化,见图3。图中可以看出,在A600值为0.6时,蛋白量最大。从本实验在发酵8 h时,培养基中营养物质能充分供应菌株的生长并产生较多的蛋白。将诱导的重组大肠埃希菌E.coliRosetta(DE3)/pGEX-6p-3-GLP1a在不同的温度下诱导,25 ℃目的蛋白的产量较高,随着诱导温度的升高,目的蛋白的产量持续降低。此外,在诱导剂浓度为0.4 mmol·L-1时蛋白量相对最大,因此确定最适的表达条件为在A600为0.6时添加浓度为0.4 mmol·L-1IPTG,以25 ℃的诱导温度诱导8 h。
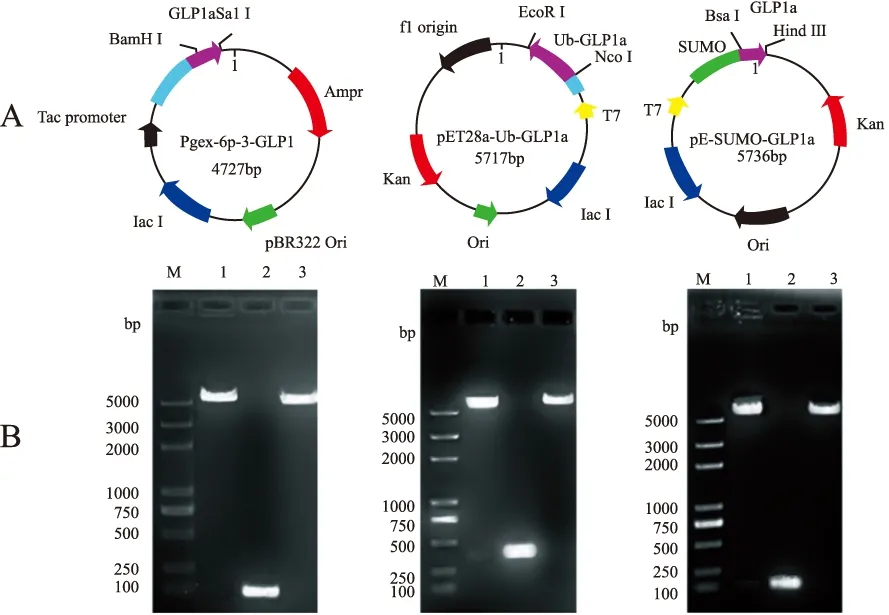
A.pGEX-6p-3-GLP1a、pET28a-Ub-GLP1a、pE-SUMO-GLP1a质粒的示意图;B.M:marker;1.重组质粒采用BamHⅠ和 SalⅠ双酶切分析;2.PCR产物;3.空质粒,采用BamHⅠ和 SalⅠ双酶切分析。

A.pGEX-6p-3-GLP1a;M.分子量标记;1.诱导pGEX-6p-3;2.诱导pGEX-6p-3-GLP1a;3.裂解后上清液;4.裂解后沉淀。B.pET28a-Ub-GLP1a;Lane M.分子量标记;1.诱导pET28a;2.诱导pET28a-Ub-GLP1a;3.裂解后上清液;4.裂解后沉淀。C.pE-SUMO-GLP1a;M.分子量标记;1.诱导 pE-SUMO;2.诱导pE-SUMO-GLP1a;3.裂解后上清液;4.裂解后沉淀。

①与A600=0.6比较,P<0.05;②与8 h比较,P<0.05;③与25 ℃比较,P<0.05;④与1 mmol·L-1比较,P<0.05。
2.3.2E.coliRosetta(DE3)/pET28a-Ub-GLP1a菌株的表达条件优化 基于优化E.coliRosetta(DE3)/pGEX-6p-3-GLP1a菌株蛋白表达的方法,对E.coliRosetta(DE3)/pET28a-Ub-GLP1a菌株的表达进行优化,结果见图4。当A600值为0.8时蛋白表达量相对最高,而A600在1.0时蛋白产量反而下降,说明在适当的菌体密度加入诱导剂对大肠埃希菌蛋白表达有重要的影响,对于该Ub融合表达质粒,在A600为0.8时加入诱导剂时较为理想。较短诱导时间不能完全生长达到产酶高峰期[13],随着诱导时间的增加,蛋白产量增加,当诱导时间为8 h,Ub融合蛋白量相对最高。诱导温度对蛋白的产量有极其重要的影响,当诱导温度为30 ℃时,蛋白产量达到一个较大值。图4可看出,随着诱导剂浓度的增大,蛋白表达量增加,但当升至1.0 mmol·L-1时,蛋白产量下降。最终,确定最优表达条件为在A600为0.8时添加浓度为0.8 mmol·L-1的IPTG,以30 ℃的诱导温度诱导8 h。
2.3.3E.coliRosetta(DE3)/pE-SUMO-GLP1a菌株的表达条件优化 按照同样的思路对E.coliRosetta(DE3)/pE-SUMO-GLP1a菌株的蛋白表达进行优化。从图5可看到A600值在0.8时,加入0.8 mmol·L-1IPTG,在30 ℃诱导8 h时蛋白表达量最高。

①与A600=0.6比较,P<0.05;②与8 h比较,P<0.05;③与25 ℃比较,P<0.05;④与1 mmol·L-1比较,P<0.05。
发酵条件经优化后,GST-GLP1a、Ub-GLP1a、SUMO-GLP1a融合蛋白产量从优化前44.8,59.3,53.5 mg·L-1增加到88,130,112 mg·L-1,通过比较三株菌融合蛋白表达量,发现E.coliRosetta(DE3)/pET28a-Ub-GLP1a表达量最好。因此选取这株菌的表达蛋白作为后续纯化的目标蛋白,进行蛋白纯化。
2.4Ub-GLP1a融合蛋白的纯化 将E.coliRosetta(DE3)/pET28a-Ub-GLP1a大肠埃希菌在30 ℃下,经0.8 mmol·L-1IPTG诱导12 h,诱导完菌体超声破碎后,上清液部分通过镍亲和层析纯化Ub-GLP1a融合蛋白,分别用配置好的10,50,100,300 mmol·L-1咪唑的洗脱缓冲液进行洗脱,结果可看出,融合蛋白Ub-GLP1a能够很好地与Ni树脂结合并被咪唑洗脱下来。可以发现纯化后的Ub-GLP1a相对分子质量是14 190,经肠激酶酶切后得到的GLP1a相对分子质量约为4600,相对分子质量与理论值一致,见图6。
2.5HPLC法检测纯化后的GLP1a融合蛋白 由于融合蛋白再次过镍亲和层柱,目的蛋白小,且蛋白量少,SDS-PAGE分析不灵敏,所以将穿透液通过HPLC分析。结果见图7。HPLC分析结果显示,与标准品比较,目的蛋白的出峰时间、保留时特征均完全正确。经计算得出最终切除标签蛋白后的GLP1a含量为15.95 mg·L-1。
3 讨论
利拉鲁肽原研药是通过酵母表达系统生产,但是利用酵母表达利拉鲁肽可能存在以下问题:酵母表达载体传代不稳定;分泌表达的产物会增加产物的抗原性,不利于治疗;酵母高密度发酵难度较大[14]。利用大肠埃希菌表达,有繁殖迅速、培养简单、操作方便和遗传稳定的优势。

①与A600=0.6比较,P<0.05;②与8 h比较,P<0.05;③与25 ℃比较,P<0.05;④与1 mmol·L-1比较,P<0.05。

A.镍亲和层析Ub-GLP1a融合蛋白;M.分子量标记;1~5.用10,50,100,300,500 mmol·L-1咪唑洗脱Ub-GLP1a的裂解液;6.Ub-GLP1a细胞裂解液上清液;B.肠激酶酶切融合蛋白,M.分子量标记;1~3.经肠激酶酶切后的融合蛋白;4~6.未经酶切的融合蛋白;7.GLP1a标准品。
本实验构建GST、Ub、SUMO 3种不同融合标签的大肠埃希菌表达载体。大量研究表明,菌体密度达到一定浓度后,目的蛋白表达量最高[15]。同时诱导温度过高菌体生长速率及代谢都较快,产酶速率也同时加快,导致蛋白来不及进一步折叠,而致使大量包涵体的形成;培养基中营养物质随着发酵时间的延长会逐渐被消耗,影响菌体的正常生长代谢,使其产酶能力下降并产生较多的副产物,而较短发酵时间不能完全生长达到产酶的高峰期[16];由于IPTG具有一定的毒害作用,当IPTG的浓度过高时会对细胞的生长产生毒害作用,使表达的产量降低[17]。最佳的诱导条件为:在A600为0.8时添加浓度为0.8 mmol·L-1的IPTG,以30 ℃诱导温度诱导8 h,得到蛋白含量为130 mg·L-1。利用镍柱亲和层析对表达的Ub-GLP1a重组蛋白进行纯化,将纯化后的蛋白采用肠激酶酶切后经SDS-PAGE和HPLC分析证明得到正确的目的蛋白。
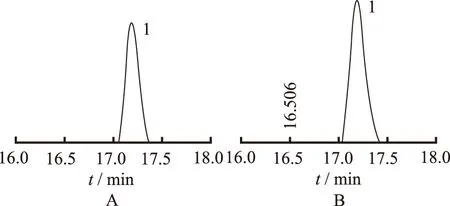
A.标品;B.目的蛋白;1.GLP1a。
为了实现GLP1a的可溶性表达,本实验利用融合标签构建表达载体。GST标签是细菌表达系统中纯化蛋白较为成功的标签之一,可使蛋白正确折叠成有功能的区域[18]。Ub是由76个氨基酸组成的小分子蛋白质,可增强蛋白表达效率,并且简化蛋白纯化过程[19]。SUMO蛋白具有抗蛋白酶水解以及促进靶蛋白正确折叠、提高可溶性等功能[20]。不同的融合标签赋予外源性目的蛋白新的特性,促进目的蛋白的正确折叠和溶解[16]。通过实验,可以看出蛋白标签对蛋白的表达量以及包涵体的形成有显著影响。笔者在本文以大肠埃希菌为宿主,首次从不同蛋白标签对表达GLP1a蛋白的影响方面进行了研究,提高蛋白的表达量和可溶性。
