特殊组织类型乳腺癌的影像学表现和病理分析
2021-06-15张梅花占鸣冯波张联合
张梅花 占鸣 冯波 张联合
乳腺癌是女性常见恶性肿瘤,其发病率和病死率逐渐升高,且发病逐渐年轻化,严重威胁女性健康和生活质量[1]。乳腺癌的病理组织学分类比较复杂,影像学表现也多样,由于浸润性导管癌发病率较高,目前研究较多的是浸润性导管癌的影像学特点,而一些少见的、特殊组织类型的乳腺癌研究较少,笔者回顾性分析23例乳腺特殊组织学类型的乳腺癌的影像学表现,并与病理结果进行对照,旨在提高对少见、特殊组织类型乳腺癌的认识。
1 资料与方法
1.1 临床资料 收集2018年1月至2020年5月本院23例特殊类型乳腺癌的钼靶、超声或CT资料。均为女性,年龄30~77岁,平均58.9岁,患者影像检查前及术前均未进行任何抗肿瘤治疗,术后均有病理证实。
1.2 影像学检查方法 (1)钼靶:采用GE钼靶机,摄影条件为24~35 kV,40~185 mAs,自动曝光。常规投照体位为头尾位(CC)和外侧斜位(MLO)。左右侧乳腺摄影条件一致,经图像后处理工作站处理后传入PACS系统工作站。(2)常规胸部CT检查:采用西门子Aquilion 64排CT,吸气后屏气进行螺旋扫描,扫描范围为肺尖至横膈,得到胸部0.5 mm容积数据,然后常规5 mm横断位重建。(3)超声检查:患者取仰卧位或侧卧位,双臂上举充分暴露双侧乳房及腋窝。采用GE LOGIQ E9 彩色多普勒超声仪;探头频率为7~13 MHz,检查乳腺各个象限,详细描述病变特点及内部血流情况。部分患者进行了自动乳腺全容积扫查系统(ABVS)检查,采用SIEMENS Acuson S2000 ABVS系统,探头为18L6 HD,嘱患者平静呼吸,对双侧乳腺进行外侧位、内侧位和正位扫查。将数据传输至影像数据处理系统进行三维重建,对图像进行观察。
1.3 影像结果判断 所有钼靶、CT图像均经2名高年资放射科医师共同阅片,结合BI-RADS诊断标准进行分级诊断,超声结果与病理结果对照,以诊断为BIRADS:4类或5类为诊断正确,计算诊断符合率。
2 结果
2.1 病理结果 129例乳腺癌,其中浸润性导管癌106例,特殊类型乳腺癌23例,特殊类型乳腺癌占17.8%,右乳13例,左乳10例。导管内癌9例,黏液癌5例,浸润性小叶癌5例,导管内乳头状癌2例,浸润性微乳头状癌2例。除1例浸润性微乳头状癌伴浸润性导管癌患者可见邻近淋巴结转移,其余患者术后淋巴结病理检查结果均为阴性。
2.2 诊断符合率 23例患者中,钼靶共误诊或诊断不明确4例,19例诊断为BI-RADS:4或5类,钼靶诊断符合率82.6%;超声共误诊2例,21例诊断为BIRADS:4或5类,超声诊断符合率91.3%,所有患者CT图像上相应部位均可发现乳腺内病变。三者结合诊断符合率100%。
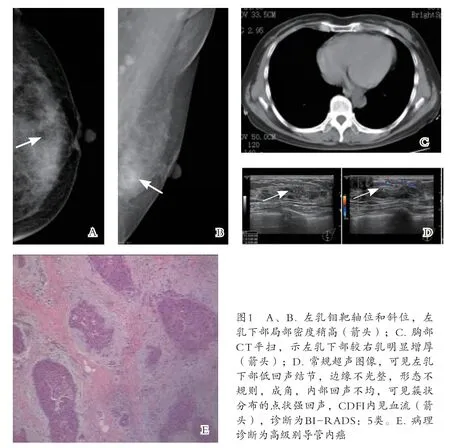
2.3 影像学表现与病理 (1)导管内癌:钼靶表现为结节样、肿块样、放射状高密度影,边缘不规则,境界不清楚,部分可见斑点钙化,超声表现为低回声团块或厚壁囊性结节,CDFI均可见血流,CT表现为低密度、等密度或稍高密度影;1例钼靶上仅见左乳内下密度稍高,诊断为BI-RADS:0类,CT上见左乳局部较右乳增厚,而超声表现为低回声结节,边缘不光整,形态不规则,成角,内部回声不均,可见簇状分布的点状强回声,CDFI内见血流,诊断为BI-RADS:5类,病理诊断为高级别导管内癌(粉刺型)。见图1。(2)黏液癌:4例钼靶表现为形态不规则、境界尚清楚的分叶状高密度肿块,CT表现为形态不规则的分叶状等密度或低密度肿块,并见周围纤维索条、皮肤增厚等征象。超声表现为形态不规则的低回声肿块,部分肿块内见点状强回声光斑,CDFI可见丰富血流信号。1例钼靶表现左乳类圆形肿块,边缘欠光滑,诊断为BI-RADS:3类,而CT图像上可见左乳分叶状肿块,局部囊性密度,临近皮肤增厚,考虑恶性,手术病理为黏液腺癌。见图2。(3)浸润性小叶癌:4例钼靶表现为形态不规则的肿块样、片样高密度影,超声表现为形态不规则,边缘不光整、分叶状的低回声肿块,部分病变内见点状强回声,CDFI可见血流。CT表现为等低密度肿块,边缘模糊不清。1例双乳钼靶均未见明显肿块影,CT表现为左乳外侧高密度影,边缘模糊不清,而超声表现为左乳外侧低回声团,边界不清,形态不规则,呈蟹足样,内见点状强回声,CDFI可见丰富血流,诊断为BI-RADS:4C类,病理结合免疫组化考虑为浸润性小叶癌。(4)导管内乳头状癌:钼靶表现为不规则结节、肿块影,CT表现为等密度类圆形小结节、肿块影,边缘细小毛刺。超声表现为形态不规则、边缘尚清晰的低回声结节,内见点状强回声,CDFI结节内可见粗大血流。(5)浸润性微乳头状癌:钼靶、超声均表现为形态不规则高密度、低回声肿块影。1例CT上可见右乳多发结节,形态不规则,局部皮肤增厚;超声可见右乳多发结节,边缘不光整,形态不规则,周边见毛刺,内部回声不均CDFI可见血流,术后病理诊断为右乳浸润性微乳头状癌(占80%),伴部分浸润性导管癌(II级)。

3 讨论
多篇文献报道[2-4],国内乳腺癌最常见的病理类型是浸润性导管癌,但随着病理诊断水平的提高,一些少见的、特殊组织类型的乳腺癌逐渐被人们认识,本研究乳腺特殊组织类型肿瘤的发病率为17.8%,大部分发病年龄>40岁,且多以发现乳腺肿块而就诊。目前用于诊断乳腺疾病的影像学方法有钼靶、普通超声及ABVS、磁共振、CT等。乳腺钼靶X线具有简单、方便、费用低及无创性等优点,对乳腺肿块的位置、形态、大小、边缘、钙化的有无及钙化的良恶性判断能提供准确而直观的信息,并能发现早起无症状患者及临床触诊阴性的肿瘤[5],是目前乳腺癌首选的筛查方法,但乳腺钼靶摄影受限于乳腺的类型,致密型乳腺可能因腺体重叠疾病而导致假阴性,一些低于乳腺腺体密度的囊性病变可能会漏诊,对于一些早期病变,因病变钼靶表现不典型,有时不能提供准确定性诊断。常规乳腺超声不受腺体致密程度的限制[6],可以探测乳腺内的微细结构和微小乳腺癌,在判断病变的囊性、实性方面有独特的优势,CDFI可提供病变内部血流,可为乳腺癌的诊断提供病理学基础[7],而新近应用的ABVS能快速数据处理,可减少医师主观原因引起的误诊。本资料有1例导管内癌钼靶上仅见左乳内下密度稍高,诊断为BIRADS:0类,而超声表现为低回声结节,边缘不光整,形态不规则,成角,内部回声不均,可见簇状分布的点状强回声,CDFI内见血流,诊断为BI-RADS:5类,病理诊断为高级别导管内癌(粉刺型)。本组有1例病变钼靶表现为左乳类圆形肿块,边缘欠光滑,诊断为BI-RADS:3类,而CT图像上病变为分叶状肿块,局部囊性密度,临近皮肤增厚,考虑恶性,手术病理为黏液腺癌。因此,钼靶、超声和CT在诊断特殊类型乳腺癌时均有相应的优势和劣势,三者互相结合可提高其诊断正确率。虽说用CT来常规检查乳腺不能提倡,但因CT密度分辨率较高,能清晰显示乳腺结构,尤其是少量腺体型和退化型乳腺,所以在因各种临床需求进行胸部CT扫描时,应仔细观察乳腺,可从两侧乳腺是否对称、有无局限性密度增高、有无肿块、钙化、皮肤有无增厚、乳头有无回缩、腋下淋巴结有无肿大等几个方面进行观察,也许会发现一些超声或钼靶不易发现的或无症状的病变。
导管内癌是来源于乳腺导管系统上皮细胞的恶变,病变未突破基底膜,或突破范围<1 mm,转移能力较弱,本组9例导管内癌均未见前哨淋巴结节转移,与文献报道[8]一致。除1例钼靶上表现为片状稍高密度影外,其余都表现为形态规则、境界不清高密度肿块影,超声表现为低回声团块或厚壁囊性结节,CDFI可见血流。部分病变内的细小钙化及放射状的纤维增生反应,均得到病理诊断和证实。黏液癌是一种少见的特殊类型浸润性癌,发生率占全部乳腺癌的1%~5%[9],其生长缓慢,预后较好。本组黏液癌钼靶表现为分叶状、类圆形高密度肿块影,CT表现为分叶状等、低密度肿块影,超声表现为形态不规则的低回声肿块,部分肿块内见点状强回声光斑,CDFI可见丰富血流信号。1例因钼靶表现类圆形高密度影近似良性肿瘤而诊断为BI-RADS:3类,本病变的CT图像为分叶状、低密度囊性结节,其误诊原因作者认为可能是钼靶压迫导致肿块变形,而CT为断层检查,可显示病变的全貌及内部黏液所致的低密度区。浸润性小叶癌少见,当小叶原位癌细胞突破基底膜向间质浸润生长时即成为浸润性小叶癌,本组病变钼靶表现为形态不规则的肿块样、片样高密度影,超声表现为形态不规则,边缘不光整、分叶状的低回声肿块,部分病变内见点状强回声,CDFI可见血流,但这些影像学表现与其他病理类型的乳腺癌相比无明显特征。本组1例钼靶两乳均未见明显肿块影,CT表现为左乳外侧高密度影,边缘模糊不清,而超声表现为左乳外侧低回声团,边界不清,形态不规则,呈蟹足样,内见点状强回声,CDFI可见丰富血流,诊断为BI-RADS:4C类,病理结合免疫组化考虑为浸润性小叶癌。因此术前将浸润性小叶癌在影像学上与其他乳腺癌鉴别困难。
结合上述几种特殊组织类型乳腺癌的多种影像学表现分析:(1)钼靶上主要表现为形态不规则、境界不清晰、分叶状、放射状或类圆形的高密度肿块影或片状高密度影,部分患者伴细小钙化。超声上主要表现为不规则的低回声团块影,CDFI可见血流;CT表现为形态各异的等密度或低密度肿块影,周围模糊,邻近皮肤增厚。(2)对于一些类似良性病变的肿瘤,超声表现为囊实性伴壁结节的肿块,CT上表现为低密度的分叶状肿块,要考虑到导管内癌、黏液癌等特殊组织类型乳腺癌。(3)这些特殊组织类型乳腺癌用单一影像学检查方法可能很难诊断,但结合多影像学检查方法可提高其诊断准确率,并能详细显示病变的性质和特征。
