TEOA诱导急性髓系白血病细胞凋亡机制分析
2021-06-15解蓓李艳纯王莹杜璟陆晓雅王剑超
解蓓 李艳纯 王莹 杜璟 陆晓雅 王剑超*
急性髓系白血病(AML)是一种常见的血液恶性肿瘤,其特征在于原始或未成熟细胞的过度增殖以及对正常造血干细胞的抑制[1]。据报道,AML的5年生存率(OS)极低,在年轻患者和老年患者中分别为40%,10%~20%[2]。而达到完全缓解(CR)后复发的患者也大多存活不到5年[3]。AML的治疗方式主要包含诱导化疗,靶向治疗和同种异体造血干细胞移植(HSCT),其中阿糖胞苷和蒽环类药物的联合使用始终是AML诱导化疗的基础[4]。虽然诱导化疗能够部分改善年轻AML患者的预后,但大多数患者最终会出现复发或遭受化疗所带来的贫血、出血和感染等严重的毒副作用并最终死于该疾病[5]。而同种异体造血干细胞移植所带来的并发症,更是威胁患者的生命,整体预后较差[6]。2α,3α,24-三羟基-12-烯-28-乌苏酸(TEOA)具有抗肝炎、抗水肿、抗结核等多种功能[7]。目前已有研究发现TEOA在多种肿瘤细胞,包括SW620、BGC823、HepG、A549和PC-3等细胞中均表现出明显的抗肿瘤作用[8]。本文探讨TEOA对人急性髓系白血病(AML)细胞增殖和凋亡的影响。
1 材料与方法
1.1 试剂和仪器 RPMI 1640 、IMDM培养液购于美国Gibco公司,TEOA自制,抗P53、抗PARP、抗BaX、抗Bcl-2和抗c-Caspase3 抗体购自英国Abcam公司。碘化丙啶(批号ST511)、CCK-8试剂盒(批号C0043)、辣根过氧化物酶标记山羊抗小鼠IgG(批号A0216)和辣根过氧化物酶标记山羊抗兔IgG(批号A0208)均购于上海碧云天生物科技公司,二氯荧光素二乙酸酯(DCFH-DA)购于天津滨韵科技公司。ECL显影液(批号FD8020)购于杭州弗德生物科技有限公司,离心机购于美国Thermo公司,普通倒置显微镜、正置荧光显微镜购于日本尼康公司,酶标检测仪购于瑞士Tecan公司。凝胶成像仪购于美国Bio-Rad公司。
1.2 细胞培养 人急性髓系白血病Kasumi-1、KG-1α细胞株购于中国科学院上海细胞库,培养于10%胎牛血清、100 U/ml青霉素和100 µg/ml链霉素的 RPMI 1640和IMDM培养液,在37℃、含5% CO2培养箱中进行传代,选取对数生长期细胞进行后续实验。
1.3 CCK-8检测 选取对数生长期的Kasumi-1、KG-1α细胞,用无血清RPMI 1640和IMDM培养液配成4×104/ml悬液,吸取100 µl至96孔板中,然后放至37℃培养箱进行孵育,同时以10 mmol/L的TEOA为初始浓度,用无血清RPMI 1640和IMDM培养液进行稀释配制不同浓度的TEOA,然后等量加入96孔板中,每个浓度设置3个复孔,同时设置不加TEOA的对照组和只加培养液的空白组,继续于37℃培养箱孵育。经加药24 h后避光加入等量CCK-8试剂,充分摇荡混匀,继续孵育4 h后,用酶标仪测得各个孔在波长为450 nm处的吸光度值(OD)。然后分别计算出各组的细胞存活率和IC50值。细胞存活率(%)=(OD药物-OD空白)/(OD对照-OD空白)×100%。应用 Graphpad Prism 8.0软件将测得的数据整理绘制成细胞活力曲线。后续实验选取Kasumi-1细胞株为作用对象。
1.4 碘化丙啶(PI)染色 为了评估TEOA对Kasumi-1细胞凋亡的影响,应用PI染色法在荧光显微镜下观察细胞的死亡情况。按同样密度将Kasumi-1细胞接种到96孔板中,根据上述CCK-8检测结果将Kasumi-1细胞分为以下4组,对照、TEOA(20 µmol/L)组,TEOA(30 µmol/L)组、TEOA(40 µmol/L)组。在37 ℃培养箱孵育24 h后,向每孔添加终浓度为10 µg/ml的PI染色液,继续孵育10 min,然后置于荧光显微镜下观察细胞核释放的红色荧光,红色荧光的多少即代表细胞死亡量。
1.5 Western blot 检测 将Kasumi-1细胞分为对照组、TEOA(10 µmol/L)组、TEOA(20 µmol/L)组,处理24 h后低温提取细胞内蛋白,用二喹啉甲酸(BCA)法测定蛋白浓度,然后取等量蛋白上样至12%十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳,经转膜,5%脱脂奶粉室温封闭1 h后,用TBST缓冲液洗涤3次,然后根据Marker裁剪出目的蛋白相应大小的条带,并加入β-actin、P53、PARP、c-Caspase3、BaX、Bcl-2蛋白的抗体,于4 ℃ 摇床孵育过夜后将抗体回收,再次用TBST缓冲液洗涤条带3次,然后分别加入山羊抗兔二抗或山羊抗鼠二抗继续室温摇床孵育1 h,再次洗涤,加入ECL试剂显影,最后用凝胶成像仪曝光分析。
1.6 活性氧(ROS)水平的检测 以4×105细胞/ml的密度将Kasumi-1细胞接种于六孔板,然后加入配制好的20、30、40 µmol/L的TEOA药物,并设置对照组,处理24 h后,向每孔加入终浓度为2 µmol/L的DCFHDA,继续避光孵育30 min,采用流式细胞仪检测DCF荧光强度。细胞内ROS水平与DCF荧光强度呈正相关。
1.7 统计学分析 采用GraphPad Prism 8.0统计软件。计量资料用(±s)表示,采用独立样本t检验对两组数据进行分析,P<0.05为差异有统计学意义。
2 结果
2.1 TEOA对Kasumi-1、KG-1α细胞的增殖抑制作用 与对照组比较,随着TEOA浓度的增加,Kasumi-1和KG-1α细胞活力均逐渐下降(P<0.05),TEOA作用于Kasumi-1细胞在24 h的IC50值是26.71 µmol/L;同样浓度的TEOA作用于KG-1α细胞在24 h的IC50值是25.78 µmol/L(见图1)。

图1 不同质量浓度的TEOA对Kasumi-1和KG-1α细胞活力的影响
2.2 TEOA诱导Kasumi-1细胞凋亡 PI染色结果:分别以20、30、 40 µmol/L的TEOA作用Kasumi-1细胞24 h后,与0 µmol/L的TEOA组比较,随着浓度的增加,Kasumi-1细胞死亡数量也在逐渐增加(见图2A)。通过Western blot验证TEOA作用于Kasumi-1细胞后凋亡相关蛋白表达情况,结果显示:与0 µmol/L的TEOA组比较,不同浓度的TEOA处理Kasumi-1细胞后,抑癌基因P53和下游促凋亡蛋白c-Caspase3、Bax、Cleaved-PARP表达增加,抗凋亡蛋白Bcl-2蛋白表达下降(见图2B、2C)。

图2 A. PI染色观察Kasumi-1细胞死亡的特征;B. Western blot检测TEOA对Kasumi-1细胞凋亡蛋白表达的影响;C. Western blot检测凋亡蛋白在Kasumi-1细胞中的相对表达
2.3 TEOA对Kasumi-1细胞ROS生成影响 与0 µmol/L的TEOA组比较,20 µmol/L的TEOA作用于Ka sumi-1细胞时,ROS生成的相对量为(1.45±0.14)%;30 µmol/L的TEOA作用时,ROS生成的相对量为(1.9±0.07)%,而40 µm ol/L的TEOA作用时,ROS生成的相对量为(2.43±0.08)%(P<0.05)。见图3。
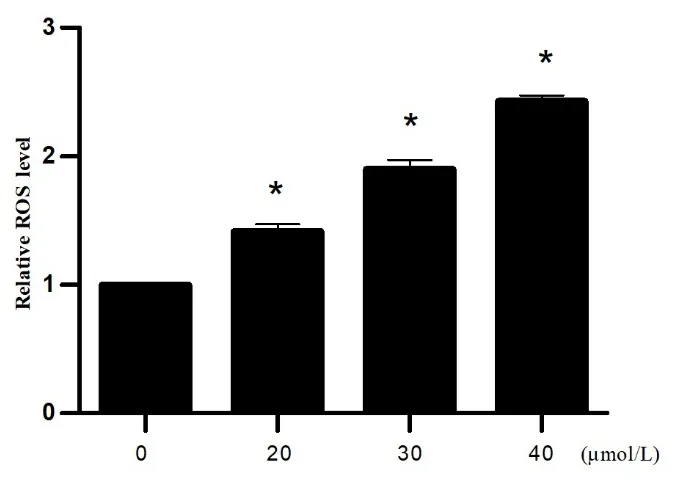
图3 流式细胞术检测TEOA诱导kassumi-1细胞产生的活性氧水平
3 讨论
TEOA是从中华猕猴桃的根中分离的一种熊果酸型五环三萜类化合物,含量最为丰富。据报道五环三萜类化合物及其衍生物具有多种生物学作用,如抗肿瘤,抗炎症,抗病毒和抗氧化等功能,其中抗肿瘤活性得到广泛认可[9]。如羽扇豆醇是常见的羽扇豆烷型五环三萜类化合物,张玲莉等[10]等研究发现羽扇豆醇能通过活化Caspase通路,上调P53表达,诱导细胞凋亡及周期改变,抑制高转移性肝细胞癌HCCLM3细胞的增殖。齐墩果酸(OA)是一种常见的果烷型五环三萜类化合物,有研究表明OA可以诱导胆囊癌GBC-SD和NOZ两种细胞线粒体依赖性凋亡和G0/G1周期阻滞[11]。ZHANG[8]等研究证实TEOA对人类结直肠癌SW620细胞具有抗肿瘤活性,其作用机制与ROS介导细胞凋亡和线粒体自噬相关。
细胞增殖和凋亡机制失衡导致的不可控的细胞生长是大多数癌症进展的原因,因此抑制细胞增殖和诱导细胞凋亡成为评估抗癌药物疗效的重要因素[12]。通过CCK-8检测发现,TEOA可明显抑制Kasumi-1和KG-1α细胞的增殖,且呈浓度依赖性。随后应用PI染色证实,与对照组相比,不同浓度的TEOA均可促进Kasumi-1细胞的死亡,且TEOA作用浓度在30 µmol/L时大量细胞出现死亡。本资料显示,通过Wesrern blot检测发现TEOA作用于Kasumi-1细胞后Caspase3活化片段C-Caspase3,C-PARP明显激活,Caspase激活被认为是凋亡发生的标志[13]。因此,TEOA能通过促进细胞凋亡抑制急性髓系白血病细胞增殖,且其凋亡信号通路可能与胱氨酸蛋白酶有关。YUXINGXING[14]研究发现TEOA通过促进弥漫大B细胞淋巴瘤细胞产生ROS从而诱导DNA损伤和P38活化而发挥抗肿瘤作用。在正常生理条件下,ROS在人体内以氧化代谢副产物的形式不断产生,且能被抗氧化剂清除[15]。但过量的ROS会对一些生物大分子造成损害,如DNA和蛋白质等[16]。越来越多的研究证实,ROS的过度积聚可通过内外凋亡途径诱导细胞凋亡[17]。本资料结果显示,TEOA以浓度依赖性的方式诱导Kasumi-1细胞产生ROS,提示ROS的产生可能是TEOA诱导的Kasumi-1细胞凋亡的原因。P53作为肿瘤抑制基因,在转录水平上调控着大量的靶基因,从而在不同的生物学过程中发挥关键的作用,包括DNA损伤修复、细胞周期阻滞、细胞衰老和细胞凋亡等[18]。据报道,在ROS诱导细胞凋亡过程中,P53作为下游调控因素发挥重要作用[19]。Bcl-2家族蛋白成员是线粒体依赖的内在凋亡途径的重要因子,包括促凋亡蛋白代表Bax和抗凋亡蛋白代表Bcl-2。本实验通过Wesrern blot检测发现TEOA诱导的kasumi-1细胞可明显促进P53和Bax基因的表达,降低Bcl-2的蛋白表达。此外ROS还被认为是通过与Bcl-2家族蛋白相互作用而激活多个氧化还原敏感信号级联的第二信使[20]。综上所述,TEOA可能通过上调ROS水平进而激活P53凋亡通路促进AML细胞凋亡。TEOA可能是治疗急性髓系细胞白血病的一种有前途的候选药物。
