白芍总苷对自身免疫性甲状腺炎大鼠肠黏膜屏障及肠道菌群的影响
2021-06-11牧亚峰左新河余欣然陈继东
牧亚峰,向 楠, ,左新河, ,余欣然,赵 勇,陈继东,
1.湖北中医药大学,湖北 武汉 430061
2.湖北省中医院 甲状腺疾病诊疗中心,湖北 武汉 430074
3.贵州中医药大学,贵州 贵阳 550025
自身免疫性甲状腺炎(autoimmune thyroiditis,AIT)又称桥本甲状腺炎,是最常见的自身免疫性甲状腺疾病。随着病情进展,20%~30%患者最终发展为甲状腺功能减退症,表现为畏寒、心动过缓、便秘、黏液性水肿等典型症状及体征[1]。AIT 的病因与发病机制尚未完全阐明,传统观点认为其发病是遗传、环境、免疫等多因素共同作用的结果[2]。肠道是人体重要的消化及免疫器官,AIT 患者肠道菌群物种组成发生改变且多样性增加[3-4]。肠黏膜屏障作为机体第一道防线,在免疫系统中发挥着重要作用。自身免疫性肝炎、糖尿病、炎症性肠病、慢性肾脏病等自身免疫性疾病均存在肠黏膜屏障损伤,损伤原因涉及细胞因子、肠道菌群、肠道免疫功能等多个方面[5]。研究发现AIT 患者的十二指肠远端肠上皮细胞超微结构形态发生变化[6]。肠道菌群与肠黏膜屏障相互作用,共同维持着肠道稳态,一旦两者之间平衡被打破,可能诱发自身免疫性疾病[7]。
白芍总苷是白芍PaeonialactifloraPall.的主要有效成分,具有抗炎、镇痛、保护血管、护肝、调节免疫、抗抑郁、改善学习记忆等作用,常用于治疗类风湿性关节炎、银屑病、白塞病、过敏性紫癜、变应性鼻炎、强直性脊柱炎等自身免疫性疾病[8]。课题组前期研究发现,白芍总苷能够降低AIT 大鼠甲状腺自身抗体水平,减轻甲状腺组织炎性反应,调节调节性T 细胞(regulatory T cell,Treg),从而起到治疗AIT 的作用[9-10]。本研究探讨白芍总苷对AIT 大鼠肠道菌群及肠黏膜屏障的影响,为其临床应用提供依据。
1 材料
1.1 动物
SPF 级雌性SD 大鼠,6 周龄,体质量(110±10)g,购自三峡大学,动物许可证号SCXK(鄂)2017-0012。动物饲养于湖北中医药大学实验动物中心,温度(23±2)℃、相对湿度(55±10)%、光照12 h/d,自由进食饮水。动物实验经湖北中医药大学实验动物中心批准(批准号 HUCMS 201909008)。
1.2 药品与试剂
白芍总苷胶囊(规格0.3 g/粒,每克含芍药苷347 mg,批号H20055058)购自宁波立华制药有限公司;硒酵母片(规格50 μg/片,批号H10940161)购自牡丹江灵泰药业有限公司;猪甲状腺球蛋白(批号180801)、完全弗氏佐剂(批号F5881)、不完全弗氏佐剂(批号F5506)购自美国Sigma 公司;甲状腺过氧化物酶抗体(thyroid peroxidase antibodies,TPOAb)ELISA 试剂盒(批号E11199r)购自武汉华美生物工程有限公司;甲状腺球蛋白抗体(thyroglobulin antibodies,TGAb)ELISA 试剂盒(批号R0551)购自南京森贝伽生物科技有限公司;肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-10(interleukin-10,IL-10)、分泌型免疫球蛋白A(secretory immunoglobulin A,sIgA)ELISA试剂盒(批号分别为R2856c、R0016c、R0875c)购自武汉伊莱瑞特生物公司;闭锁连接蛋白-1(zonula occludens-1,ZO-1)抗体(批号A0659)购自Abclonal 公司;闭合蛋白(Occludin)抗体(批号13409-1-AP)购自武汉三鹰生物技术有限公司;β-actin 抗体(批号BM0627)、山羊抗小鼠二抗(批号BA1051)、山羊抗兔二抗(批号BA1054)购自武汉博士德生物工程有限公司;DNA 提取试剂盒购自美国 Omega 公司;TransStart Fastpfu DNA Polymerase 购自北京TransGen 公司;DNA 凝胶回收试剂盒购自美国Axygen 公司。
1.3 仪器
H1650-W 离心机(湖南湘仪离心机仪器有限公司);Flexstation3 多功能酶标仪(美国MD 公司);RM2016 轮转式切片机(德国Leica 公司);DYCZ-40电转仪(北京六一仪器厂);BX53 型生物显微镜(日本Olympus 公司);HT7700-SS 透射电镜(TEM,日本HITACHI 公司);NanoDrop2000 分光光度计(美国赛默飞公司);QuantStudio6 PCR 仪(美国ABI公司);Miseq PE300 测序仪(美国Illumina 公司)。
2 方法
2.1 造模、分组与给药
大鼠适应性饲养1 周后,随机选取8 只作为对照组,其余大鼠采用猪甲状腺球蛋白与弗氏佐剂免疫注射联合高碘水喂养制备AIT 大鼠模型[11]。第2~7 周大鼠sc 100 μg 猪甲状腺球蛋白,1 次/周,进行2 次初次免疫和4 次加强免疫,同时给予碘化钠水(0.64 g/L)喂养,建立AIT 模型。造模大鼠随机分为模型组、硒酵母(36 μg/kg,相当于临床等效剂量)组及白芍总苷低、中、高剂量(160、320、640 mg/kg,分别相当于临床等效剂量的1、2、4 倍)组,每组8 只[12]。硒酵母片研磨至极细粉末,溶于生理盐水配制成质量浓度为3.6 μg/mL 的混悬液;白芍总苷胶囊溶于生理盐水,分别配制成质量浓度为16、32、64 mg/mL 的溶液。自第7 周开始,各给药组ig 相应药物,对照组和模型组ig 等体积生理盐水,1 次/周,连续6 周。
2.2 白芍总苷对AIT 大鼠血清TGAb、TPOAb、TNF-α 和IL-10 水平的影响
给药结束后,大鼠禁食不禁水12 h,ip 10%水合氯醛麻醉后取血,离心取血清,按试剂盒说明书测定血清中TGAb、TPOAb、TNF-α 和IL-10 水平。
2.3 白芍总苷对AIT 大鼠甲状腺和结肠病理变化的影响
大鼠取血完毕后,快速分离甲状腺和结肠组织,以生理盐水清洗,切成厚度为0.2~0.3 cm 的组织块,于4%多聚甲醛中固定24~48 h,梯度酒精脱水,常规石蜡包埋并制成厚度为4 μm 的切片,进行苏木素-伊红(HE)染色,于显微镜下观察并拍照。
2.4 白芍总苷对AIT 大鼠结肠黏膜紧密连接超微结构的影响
取各组结肠组织,于2.5%戊二醛中固定,用PBS 缓冲液反复冲洗,于1%锇酸室温固定2 h,常规梯度酒精脱水,丙酮渗透,环氧树脂包埋,60~80 nm 超薄切片,进行铀铅双染色,于TEM 下观察结肠组织紧密连接、上皮微绒毛等超微结构并拍照。
2.5 白芍总苷对AIT 大鼠结肠组织sIgA 水平的影响
取各组结肠组织,剪碎后用匀浆机制备匀浆液,3000 r/min 离心10 min,取上清液,按试剂盒说明书测定结肠组织中sIgA 水平。
2.6 白芍总苷对 AIT 大鼠结肠组织 ZO-1 和Occludin 蛋白表达的影响
取各组结肠组织,剪碎后加入磷酸酶抑制剂,裂解后匀浆,4 ℃、12 000 r/min 离心5 min,取上清液,采用BCA 蛋白定量试剂盒测定蛋白质量浓度。蛋白样品经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF 膜,于脱脂牛奶中封闭2 h,加入ZO-1 和Occludin 抗体(1∶1000),4 ℃孵育过夜;TBST 洗涤,加入山羊抗小鼠/兔二抗(1∶50 000),37 ℃孵育2 h;加入ECL 发光液显影曝光,扫描胶片,采用BandScan 软件分析。
2.7 粪便菌群DNA 的提取及测序
每组随机选取5 只大鼠,肛周消毒后固定并将其尾部提起,手指按压下腹部促使排便,收集粪便2~3 颗于灭菌冻存管。按试剂盒说明书进行微生物群落总DNA 抽提,利用1%琼脂糖凝胶电泳检测DNA 提取质量,使用NanoDrop2000 测定DNA 质量浓度和纯度。 使用扩增引物 338F(5’-ACTCCTACGGGAGGCAGCAG-3’)和 806R( 5’-GGACTACHVGGGTWTCTAAT-3’ ) 对 16S rRNA V3~4 可变区进行PCR 扩增,扩增程序:95 ℃预变性3 min,27 个循环(95 ℃变性30 s、55 ℃退火30 s、72 ℃延伸30 s),72 ℃稳定延伸10 min,4 ℃保存。扩增结果用2%琼脂糖凝胶回收,利用DNA 凝胶试剂盒对回收产物纯化,2%琼脂糖凝胶电泳检测,并对回收产物进行检测定量。使用NEXTFLEX Rapid DNA-Seq Kit 建库,利用MiSeq PE300 平台进行高通量测序。利用生物信息学方法进行分类操作单元(operational taxonomic units,OTUs)聚类(物种注释及丰度分析)、物种多样性、物种分类学组成等分析。
2.8 统计学方法
采用SPSS 25.0 软件进行数据分析,实验结果以±s表示,数据符合正态分布且方差齐。多组间比较采用单因素方差分析(One-Way ANOVA),事后多重比较用LSD 法。
3 结果
3.1 白芍总苷对AIT 大鼠血清中TGAb、TPOAb、TNF-α 和IL-10 水平的影响
如图1 所示,与对照组比较,模型组大鼠血清中TGAb、TPOAb 和TNF-α 水平均显著升高(P<0.001),IL-10 水平明显降低(P<0.001);与模型组比较,各给药组大鼠血清中TGAb、TPOAb、TNF-α 水平均明显降低(P<0.001),IL-10 水平均显著升高(P<0.001)。
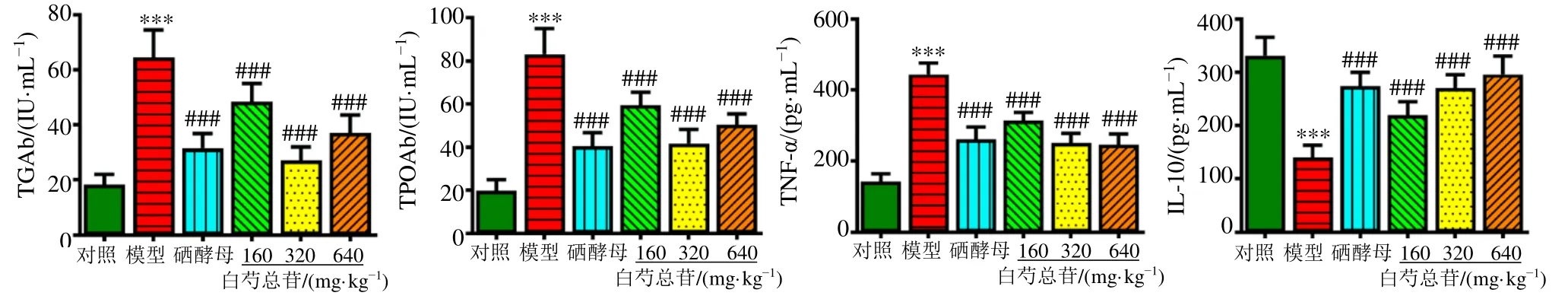
图1 白芍总苷对AIT 大鼠血清TGAb、TPOAb、TNF-α 和IL-10 水平的影响 ( ± s , n=8)Fig.1 Effect of total glucosides of P. lactiflora on TGAb, TPOAb, TNF-α and IL-10 levels in serum of AIT rats ( ± s , n=8)
3.2 白芍总苷对AIT 大鼠甲状腺和结肠组织病理变化的影响
如图2 所示,对照组大鼠甲状腺滤泡结构完整,形态规则,呈类圆形,滤泡上皮细胞呈单层立方形,排列整齐,滤泡腔内充满胶质,滤泡间隙未见淋巴细胞浸润;模型组大鼠甲状腺滤泡上皮细胞呈扁平状,大部分滤泡结构破坏萎缩,可见淋巴细胞浸润;硒酵母组大鼠甲状腺滤泡上皮细胞排列整齐,滤泡腔萎缩,胶质含量减少,可见吸收空泡;白芍总苷各剂量组大鼠甲状腺滤泡结构完整性改善,淋巴细胞浸润明显减少,病变程度有所减轻。
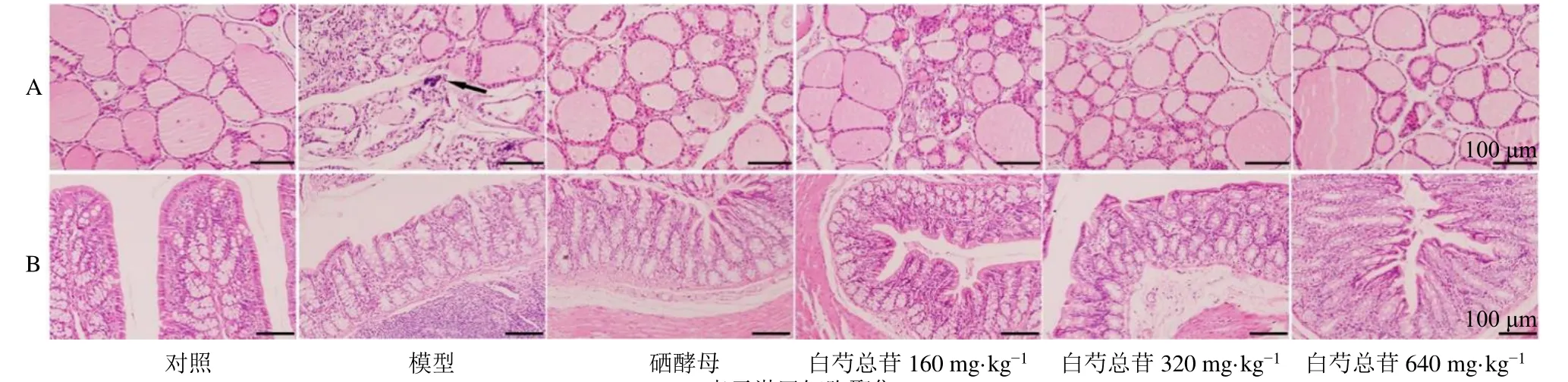
图2 白芍总苷对AIT 大鼠甲状腺 (A) 和结肠组织 (B) 病理变化的影响 (HE, ×100)Fig.2 Effect of total glucosides of P. lactiflora on pathological changes of thyroid tissues and colon tissues in AIT rats (HE, × 100)
对照组大鼠结肠黏膜完整,上皮细胞排列整齐,黏膜隐窝平行排列,杯状细胞丰富,无淋巴细胞浸润;模型组大鼠结肠黏膜上皮部分断裂、不完整,黏膜隐窝形态扭曲,伴有淋巴细胞浸润;各给药组结肠黏膜完整性有所恢复,淋巴细胞浸润明显减少。
3.3 白芍总苷对AIT 大鼠结肠黏膜紧密连接超微结构的影响
如图3 所示,对照组大鼠结肠黏膜细胞间紧密连接结构完整,连接致密、连续,桥粒密度较高,上皮细胞表面微绒毛正常;模型组结肠黏膜细胞间紧密连接出现部分断裂,连接开放、疏松,桥粒密度下降,微绒毛数量减少,且排列较紊乱;各给药组结肠黏膜细胞间紧密连接的连续性均有不同程度恢复,连接更加紧密,肠上皮微绒毛数量增加,排列较模型组整齐。

图3 白芍总苷对AIT 大鼠结肠黏膜紧密连接超微结构的影响 (×12 000)Fig.3 Effect of total glucosides of P. lactiflora on tight junction structure of colonic mucosa in AIT rats (× 12 000)
3.4 白芍总苷对AIT 大鼠结肠组织中sIgA 水平的影响
如图4 所示,与对照组比较,模型组大鼠结肠组织中sIgA 水平显著降低(P<0.001);与模型组比较,各给药组大鼠结肠组织sIgA 水平均显著升高(P<0.05、0.01、0.001)。
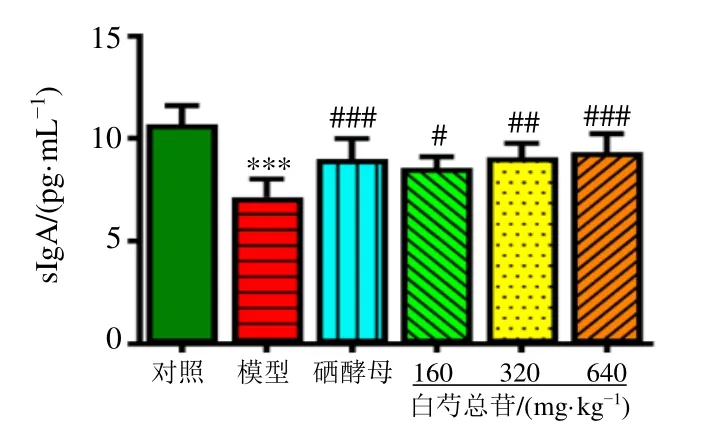
图4 白芍总苷对AIT 大鼠结肠组织sIgA 水平的影响 ( ± s , n=8)Fig.4 Effect of total glucosides of P. lactiflora on sIgA level in colon tissues of AIT rats ( ± s , n=8)
3.5 白芍总苷对 AIT 大鼠结肠组织 ZO-1 和Occludin 蛋白表达的影响
如图5 所示,与对照组比较,模型组大鼠结肠组织中ZO-1 和Occludin 蛋白表达水平均显著降低 (P<0.001);与模型组比较,各给药组大鼠结肠组织ZO-1 和Occludin 蛋白表达水平明显升高(P<0.01、0.001)。

图5 白芍总苷对AIT 大鼠结肠ZO-1 和Occludin 蛋白表达的影响 ( ± s , n=3)Fig.5 Effect of total glucosides of P. lactiflora on expressions of ZO-1 and Occludin in colon tissues of AIT rats ( ± s , n=3)
3.6 白芍总苷对AIT 大鼠肠道菌群的影响
3.6.1 物种多样性分析 本研究对大鼠粪便样品进行测序及分析后,共得到798 330 条有效序列。如图6 所示,当Shannon 指数达到3.5 时,各样本稀释曲线趋向平坦,表明测序数据足够大,能够反映样本中绝大多数的微生物多样性信息。α 多样性反映微生物群落的丰富度和多样性,如表1 所示,与对照组相比,模型组大鼠肠道菌群OTUs、Shannon、Simpson、Chao 和Ace 指数均呈上升趋势;与模型组比较,硒酵母组大鼠肠道菌群OTUs、Shannon、Chao 和Ace 指数均呈升高趋势,白芍总苷中、高剂量组大鼠肠道菌群OTUs、Chao 和Ace 指数均显著降低(P<0.05、0.001)。表明AIT 大鼠肠道菌群物种多样性增加、丰度升高,肠道菌群过度生长,白芍总苷能够降低大鼠肠道菌群多样性。

图6 各组大鼠肠道菌群稀释曲线分析 ( ± s , n=5)Fig.6 Rarefaction curve analysis on intestinal flora of rats in each group ( ± s , n=5)
β 多样性通过分析不同样本的物种多样性,探索不同组样本微生物群落的差异性。主坐标分析(principal coordinates analysis,PCoA)是β 多样性具有代表性的一种非约束性数据降维分析方法,样品间距离越近,表明物种组成结构越相似。如图7所示,对照组和模型组在PC1 水平上明显分开,表 明AIT 大鼠肠道菌群组成结构较对照组有明显改变;各给药组在PC1 水平上明显偏离模型组,表明各给药组大鼠肠道菌群组成结构发生明显变化。
表1 各组大鼠肠道菌群α 多样性指数 ( ± s , n=5)Table 1 Alpha diversity index of intestinal flora in rats of each group ( ± s , n=5)
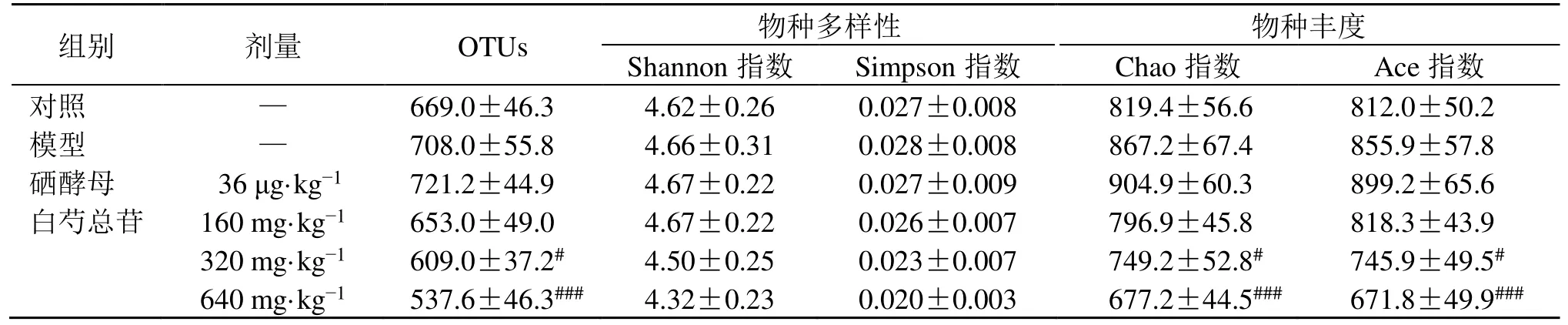
表1 各组大鼠肠道菌群α 多样性指数 ( ± s , n=5)Table 1 Alpha diversity index of intestinal flora in rats of each group ( ± s , n=5)
与模型组比较:#P<0.05 ###P<0.001#P <0.05 ###P <0.001 vs model group
剂量 OTUs Shannon 指物数种 多样Si性mp s on 指数 Chao 指数 物 种丰度 Ace 指数— 669.0±46.3 4.62±0.26 0.027±0.008 819.4±56.6 812.0±50.组别 对照 2 模型 — 708.0±55.8 4.66±0.31 0.028±0.008 867.2±67.4 855.9±57.8 硒酵母 036 μg·kg-1 721.2±44.9 4.67±0.22 0.027±0.009 904.9±60.3 899.2±65.6 白芍总苷 160 mg·kg-1 653.0±49.0 4.67±0.22 0.026±0.007 796.9±45.8 818.3±43.9 320 mg·kg-1 609.0±37.2# 4.50±0.25 0.023±0.007 749.2±52.8# 745.9±49.5# 640 mg·kg-1 537.6±46.3### 4.32±0.23 0.020±0.003 677.2±44.5### 671.8±49.9###

图7 各组大鼠肠道菌群PCoA 分析 ( ± s , n=5)Fig.7 PCoA analysis on intestinal flora of rats in each group ( ± s , n=5)
3.6.2 群落结构组成分析 如图8 所示,在门水平上,各组大鼠肠道菌群主要包括厚壁菌门、拟杆菌门、变形菌门、放线菌门等,对照组大鼠肠道菌群中厚壁菌门、拟杆菌门为优势菌门。与对照组相比,模型组厚壁菌门相对丰度显著升高(P<0.001),拟杆菌门相对丰度显著降低(P<0.001),厚壁菌门与拟杆菌门比值(F/B)显著升高(P<0.001);与模型组比较,各给药组厚壁菌门相对丰度显著降低(P<0.001),拟杆菌门相对丰度明显升高(P<0.001),F/B 显著降低(P<0.001)。
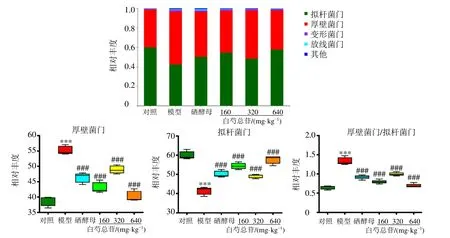
图8 门水平具有显著差异的肠道菌群相对丰度 ( ± s , n=5)Fig.8 Relative abundance of intestinal flora with significant differences at phylum level ( ± s , n=5)
如图9 所示,在属水平上,各组大鼠肠道菌群主要包括Muribaculaceae、毛螺菌属Lachnospiraceae、瘤胃球菌属Ruminococcaceae、拟杆菌属Bacteroides、乳酸杆菌属Lactobacillus、罗姆布茨菌属Romboutsia、Turicibacter、普雷沃氏菌属Prevotellaceae、克里斯滕森菌属Christensenellaceae等,其中乳酸杆菌属、普雷沃氏菌属与罗姆布茨菌属组间变化明显。与对照组相比,模型组乳酸杆菌属、普雷沃氏菌属和罗姆布茨菌属相对丰度显著降低(P<0.001);与模型组相比,硒酵母组及白芍总苷低、高剂量组乳酸杆菌属、普雷沃氏菌属和罗姆布茨菌属相对丰度均明显增加(P<0.05、0.001),白芍总苷中剂量组罗姆布茨菌属相对丰度显著升高(P<0.001)。
4 讨论
本研究采用高碘水喂养联合异原性抗原免疫法复制AIT 大鼠模型,模型组大鼠血清TGAb 和TPOAb 水平显著升高,且甲状腺组织滤泡结构破坏,表明造模成功。补硒治疗可以有效降低血清TPOAb 水平,由于硒酵母安全性高、临床使用范围广,本研究将其作为阳性对照药物[9]。结果显示,白芍总苷显著降低AIT 大鼠血清TGAb 和TPOAb水平,改善甲状腺组织病理形态,与前期研究结果基本一致[9];白芍总苷显著降低血清中促炎细胞因子TNF-α 水平,升高抗炎细胞因子IL-10 水平,纠正炎性反应稳态失衡;白芍总苷能够调节AIT 大鼠肠道菌群组成,升高结肠组织 sIgA、ZO-1 和Occludin 蛋白表达水平,改善结肠黏膜屏障中肠上皮结构及紧密连接超微结构。
多种自身免疫性疾病中肠道菌群组成与功能均发生变化,肠道菌群紊乱可加重免疫发病进程[13],疾病进展又可反向加剧肠道菌群紊乱程度[14]。甲状腺外周稳态对微生物变化敏感,自身免疫性甲状腺疾病的发生发展可能受到肠道菌群组成变化的影响[15]。厚壁菌和拟杆菌占肠道菌群的90%以上,是哺乳动物的优势菌群[16]。F/B 与某些病理状况相关,被认为是肠道菌群健康的重要指标[17]。本研究发现AIT 大鼠肠道厚壁菌门相对丰度显著升高,拟杆菌门相对丰度降低,F/B 上升,表明AIT 大鼠肠道菌群门水平物种比例失调,菌群呈紊乱态势,与文献报道一致[3];白芍总苷组大鼠肠道厚壁菌门相对丰度降低,拟杆菌门相对丰度升高,F/B 水平降低,门水平菌群紊乱被纠正。在属水平上,乳酸杆菌属、普雷沃氏菌属和罗姆布茨菌属相对丰度均下降,与AIT 患者肠道菌群分析结果一致[4]。乳酸杆菌是益生菌的重要来源,能够通过分泌乳酸、过氧化氢、细菌素等物质降低肠道pH,具有杀菌或抑制病原菌黏附、感染的作用[18]。乳酸杆菌能够降低TNF-α 水平,提高IL-10 水平,并参与调节sIgA 的分泌[19-20]。普雷沃氏菌具有定殖性和低致病性,在哮喘、慢性阻塞性肺疾病中相对丰度较低[21];普雷沃氏菌能够利用富含纤维的碳水化合物产生短链脂肪酸,从而发挥抗炎作用[22]。白芍总苷低剂量组大鼠肠道乳酸杆菌属相对丰度增加,但乳酸杆菌属对中、高剂量白芍总苷反应不敏感,可能由于随着肠道中药物的积累,肠道菌群生长受到抑制,导致菌群多样性及相对丰度下降。
肠黏膜屏障主要由机械屏障、免疫屏障、微生物屏障和化学屏障构成[23],是抵抗有害病原体的第一道防线,对维持机体内环境的稳定起着重要作用[24]。机械屏障由肠黏膜上皮细胞、紧密连接等组成,其中紧密连接是维持肠黏膜机械屏障功能完整的重要结构[25]。紧密连接蛋白主要包括以Occludin为代表的跨膜蛋白和以ZO-1 为代表的胞浆蛋白, Occludin 胞间两两相连形成吻合结构而封闭细胞间隙,ZO-1 与前者相互连接,使紧密连接形成网状结构而更加稳定。sIgA 是肠黏膜免疫屏障的重要组成部分,与体液及细胞免疫共同发挥局部免疫功能[26],具有增强肠道免疫、阻止条件致病菌增殖及病原菌入侵、恢复肠道微生态平衡的作用[27]。本研究结果显示,AIT 大鼠结肠组织sIgA、ZO-1 和Occludin 蛋白表达水平显著降低,结肠黏膜紧密连接超微结构部分断裂伴不连续,表明紧密连接完整性受损,肠黏膜屏障功能失常;白芍总苷组大鼠结肠组织sIgA、ZO-1 和Occludin 蛋白表达水平上调,结肠黏膜紧密连接超微结构有不同程度恢复,表明肠黏膜屏障功能损伤得到改善。肠道菌群中的正常菌群依靠定殖能力紧密黏附在肠黏膜上,构成了肠道的微生物屏障[28]。肠道菌群紊乱可直接损伤微生物屏障,稳态失衡的肠道菌群进而引起一系列复杂的病理反应。同时,肠道菌群的组成受到黏膜免疫系统的监视,细胞间紧密连接功能的强弱又可通过影响肠黏膜通透性决定菌群抗原是否暴露,肠道菌群、紧密连接、肠黏膜免疫屏障之间的相互协调作用有助于维持肠道稳态[29]。此外,短链脂肪酸、胆汁酸、吲哚等各类肠道菌群代谢产物在免疫调节和疾病发生中有着不可忽视的作用[30],因此,肠道菌群代谢产物的变化有待进一步研究。
综上所述,白芍总苷能够降低AIT 大鼠甲状腺自身抗体水平,调控炎性因子及sIgA,减轻甲状腺滤泡损伤及结肠黏膜病变程度,改善结肠紧密连接超微结构,增加结肠紧密连接蛋白表达水平,调节肠道菌群生物多样性及物种组成,改善肠黏膜屏障损伤,从而起到治疗AIT 的作用。课题组后续将深入探究乳杆菌等肠道优势菌对AIT 大鼠甲状腺自身抗体、细胞因子、肠黏膜屏障损伤的作用。
利益冲突所有作者均声明不存在利益冲突
