基于模式生物斑马鱼研究姜黄抗血管新生的作用及机制
2021-06-11朱宗萍王继森杨青松马云桐傅超美
朱宗萍,王继森,廖 婉*,陈 姣,陈 意,杨青松,李 锐*,马云桐,傅超美
1.成都中医药大学药学院,西南特色中药资源国家重点实验室,四川 成都 611137
2.成都市食品药品检验研究院,四川 成都 610045
血管新生是指在原有血管的基础上构建新血管的过程。在正常生理状况下,体内抗血管与促血管因子之间呈动态平衡;当机体受到过度促血管因子刺激时,会导致异常的过度的病理性血管新生。病理性血管新生是人类恶性肿瘤、心血管疾病和其他疾病发生发展的重要进程[1],癌症、糖尿病视网膜病变、动脉粥样硬化、类风湿性关节炎等70 余种疾病均与血管过度生成有关,因此抗血管新生的研究对于治疗血管新生依赖性疾病具有重要意义[2]。传统中医药理论虽无“血管新生”这一概念,但《素问·脉要精微论》提出“脉”为气血运行之通道,其中络脉主血、入血伤络,可见血管新生相关疾病与中医络脉的病变密切相关,中医临床上多选用活血化瘀类中药治疗络脉病变[3]。因此,中药治疗病理性血管新生具有一定的理论依据和优势。
姜黄为姜科植物姜黄Curcuma longaL.的干燥根茎。姜黄属植物的药用记载始于《唐本草》[4],姜黄性辛,味苦、温,入脾、肝经,可破血行气、通经止痛,用于治疗胸胁刺痛、胸搏心痛、痛经经闭、癥瘕、风湿肩臂疼痛、跌扑肿痛等症[5]。现代药理学研究表明,姜黄具有抗炎、调血脂、抗氧化、抗动脉粥样硬化、抗肿瘤等作用[6-7]。姜黄素和挥发油类成分为姜黄中的主要活性成分,姜黄素能够通过上调微小核糖核酸-126(microRNA-126,miR-126),负调控血管内皮生长因子(vascular endothelial growth factor,VEGF),抑制磷脂酰肌醇-3-激酶(phosphatidylinositide 3-kinases,PI3K)-丝氨酸/苏氨酸蛋白激酶(serine/threonine kinase,AKT)和酪氨酸激酶2/信号传导及转录激活因子5A(Janus kinase 2/signal transducer and activator of transcription 5,JAK2/STAT5)信号通路,从而发挥抗动脉粥样硬化作用[8],还能够通过影响miR-1275 及miR-1246 的靶基因VEGFB 和核转录因子-кB(nuclear factor-кB,NF-кB)表达,减少角膜内血管生成[9]。姜黄挥发油成分β-榄香烯能够下调原发性黑色素瘤中血管生成标志物CD34 表达,抑制肿瘤生长[10]。
斑马鱼是辐鳍亚纲鲤科的一种热带硬骨鱼,原产于南亚地区[11]。由于其基因组序列与人类具有87%的高度相似性,胚胎透明且实验周期短,被广泛应用于药物研究[12]。flk1-EGFP 转基因斑马鱼常用于心脏、节间血管、脑血管系统等研究,荧光显微镜下血管的内皮细胞呈绿色荧光,可以直接观察斑马鱼血管的生成情况,是一种便捷的抗血管新生的体内研究模型[13]。本研究以转基因荧光斑马鱼为模式生物,探究姜黄抑制斑马鱼胚胎血管新生的作用,并通过网络药理学构建“药物-成分-靶点”网络,结合分子对接技术,以整体性、系统性的角度阐释姜黄抗血管新生的作用机制,为姜黄防治血管新生依赖性疾病的药效物质基础提供科学依据。
1 材料
1.1 动物
转基因型flk1-EGFP 品系斑马鱼,购自国家斑马鱼资源中心,由成都中医药大学药学院斑马鱼实验平台培养和繁殖。
1.2 药材
姜黄饮片(批号20200225)购自成都荷花池中药材专业市场春宇药堂,经成都中医药大学马云桐教授鉴定为姜科植物姜黄C.longaL.的干燥根茎。
1.3 药品与试剂
姜黄素(批号wkq19012802)、去甲氧基姜黄素(批号 140815)、双去甲氧基姜黄素(批号wkq16090905)、芳姜黄酮(批号wkq20082006)、莪术醇(批号wkq16060204)购自四川省维克奇生物科技有限公司,质量分数均≥98%;二甲基亚砜(DMSO,批号C10843959)购自上海麦克林生化科技有限公司;链霉蛋白酶(批号306X014)购自北京索莱宝科技有限公司;VEGF 受体酪氨酸激酶亚群抑制剂PTK787(批号18805,质量分数为99.97%)购自美国MedChemExpres 公司;MS-222、甲基纤维素购自美国Sigma 公司。
1.4 仪器
斑马鱼培育与繁殖系统(北京爱生科技发展有限公司);恒温培养箱(上海一恒科技有限公司);SMZ-645 型体视显微镜、SMZ-1500 型荧光显微镜(日本Nikon 公司)。
2 方法
2.1 姜黄抗斑马鱼血管新生作用
2.1.1 供试品溶液的制备
(1)姜黄挥发油溶液的制备 取姜黄药材粉末(过2 号筛)100 g,采用水蒸气蒸馏法提取姜黄挥发油成分,以含0.1% DMSO 的胚胎培养水作为溶剂,分别配制成质量浓度为100、50、25、10、1 μg/mL的姜黄挥发油溶液。
(2)姜黄素溶液的制备 取姜黄素1 mg,以含0.1% DMSO 的胚胎培养水作为溶剂,分别配制成质量浓度为100、50、25、10、1 μg/mL 的姜黄素溶液。
(3)姜黄水提液的制备 取姜黄药材粉末(过5 号筛)1 mg,加10 倍量水,回流提取1 h,滤过,以含0.1% DMSO 的胚胎培养水作为溶剂,分别配制成质量浓度为100、50、25、10、1 μg/mL 的姜黄水提液。
(3)PTK787 溶液的制备 精密称定PTK787,以含0.1% DMSO 的胚胎培养水作为溶剂,分别配制成质量浓度为0.200、0.100、0.050、0.025 μg/mL的PTK787 溶液。
2.1.2 姜黄挥发油溶液和姜黄水提液的质量控制
(1)气相色谱-质谱联用(GC-MS)法测定姜黄挥发油成分 取姜黄药材的挥发油100 μL,用正己烷稀释50 倍,定容至5 mL 量瓶,经0.45 μm 微孔滤膜滤过,注入气相色谱仪进行测定[14]。
(2)混合对照品溶液的制备 精密称定姜黄素、去甲氧基姜黄素、双去甲氧基姜黄素、莪术醇、芳姜黄酮于5 mL 量瓶中,加甲醇振摇后定容,得到质量浓度为0.224、0.241、0.238、0.257、0.232 g/L的混合对照品溶液。
(3)超高效液相色谱(UPLC)双波长法(214 nm、430 nm)测定姜黄水提液成分 取姜黄药材粉末(过5 号筛)1 g,加10 倍量水,回流提取1 h,经0.45 μm 微孔滤膜滤过,注入超高效液相色谱仪进行测定[15]。
2.1.3 分组与给药 取受精后24 h 的斑马鱼胚胎,采用链霉蛋白酶(0.1 mg/mL)脱膜,随机分为对照组、姜黄挥发油组、姜黄素组、姜黄水提液组和PTK787 组,置于含药液的24 孔板中,每孔10~15粒胚胎,每孔终体积为1.5 mL,培养板于28 ℃恒温培养箱中培养24 h。
2.1.4 指标观察 采用0.016% MS-222 麻醉斑马鱼胚胎,调整斑马鱼姿势,使两侧眼、体节重合,采用体式荧光显微镜进行血管表型观察,然后于3%甲基纤维素中固定并拍照。观察完整体节间血管(intersegmental vessel,ISV)和缺陷ISV 的形态,以评估姜黄的抗血管生成活性,根据体节间血管生成数目计算抑制率。

2.1.5 数据处理 采用SPSS 23.0 软件进行单因素方差分析,结果以±s表示。
2.2 基于网络药理学和分子对接探究姜黄抗血管新生的作用机制
2.2.1 姜黄主要成分和靶点的筛选 基于中药系统药理学技术平台(TCMSP),以口服生物利用度>30%且类药性>0.10 为筛选条件,对姜黄的成分进行筛选,同时结合相关文献,确定姜黄的主要成分。采用 TCMSP 数据库及 PharmMapper 服务器(http://lilab-ecust.cn/pharmmapper/submitfile.html)检索获取活性成分对应的靶点并取合集,应用Uniprot(https://sparql.uniprot.org/)数据库,检索得到靶点名称对应的基因命名,用作后续研究。
2.2.2 抗血管新生靶点的预测与筛选 以“antiangiogenesis”“anti-angiogenesis”和“inhibits angiogenesis”为关键词,在Gene Cards 数据库(http://www.genecards.org/)和 OMIM 数据库(http://www.omim.org)中检索得到与抗血管新生相关的靶点,运用Venny 平台(https://bioinfogp.cnb.csic.es/tools/venny/)将姜黄主要成分对应的靶点与抗血管新生相关的靶点进行映射,得到姜黄抗血管新生的交集靶点。
2.2.3 “药物-成分-靶点”网络的构建 将姜黄的主要成分和抗血管新生作用靶点导入Cytoscape 3.7.1 软件,构建“药物-成分-靶点”网络。通过network analyzer 和cytoNCA 插件对网络结构进行分析,并计算网络参数,包括度值、介数以及紧密度,筛选出姜黄抗血管新生的主要活性成分及其主要靶点等信息。
2.2.4 蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络的构建 将姜黄抗血管新生的靶点导入String 数据库(https://string-db.org/),种属选择“Homo sapiens”,交互作用选择>0.4 的靶点,并隐藏游离的节点。采用R 语言计算PPI 网络中每个靶点的连接节点数量,输出可视化柱状图,用以确定PPI 网络中的核心基因,并导入Cytoscape 3.7.1 软件,构建姜黄抗血管新生的PPI 网络,按度值大小进行分类和排序。
2.2.5 基因本体(gene ontology,GO)功能富集分析及京都基因与基因组百科全书( Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析 将姜黄抗血管新生的靶点输入DAVID 数据库(https://david.ncifcrf.gov/summary.jsp),对姜黄抗血管新生的靶点进行GO 富集分析以及KEGG通路富集分析,设定阈值P<0.05,筛选排名靠前的生物过程和通路,采用R语言以及Cytoscape 3.7.1软件绘制可视化图形。
2.2.6 分子对接模拟 选择度值排名前8 的活性成分作为配体,“药物-成分-靶点”网络中度值排名前5 的核心靶点和PPI 网络中度值排名前5 的核心基因作为受体,采用AutoDock vina 软件进行分子对接,得到结合能和结合位点,并作热图分析。
3 结果
3.1 姜黄挥发油溶液和姜黄水提液的质量控制
姜黄挥发油GC-MS 总离子流色谱图见图1-A,定性分析结果见表1,芳姜黄酮是姜黄挥发油的主要成分,质量分数高达29.52%。采用UPLC 双波长法对姜黄水提液进行定性,如图1-B、C 所示,430 nm 处检测出姜黄素、去甲氧基姜黄素和双去甲氧基姜黄素,214 nm 处检测出芳姜黄酮和莪术醇。

图1 姜黄挥发油GC-MS 总离子流色谱图 (A)、姜黄水提液 (B) 及混合对照品溶液 (C) 色谱图Fig.1 GC-MS total ion flow chromatogram of volatile oil of C.longa (A), chromatography of decoction of C.longa (B), and mixed reference substances solution (C)
3.2 姜黄抗斑马鱼血管新生作用
如图2 和表2 所示,与对照组相比,各给药组斑马鱼节间血管生成缺失且杂乱,呈断裂趋势;各给药组均具有抑制斑马鱼血管新生的作用,且呈剂量相关性。当剂量为100、50、25、1 μg/mL 时,血管生成抑制率排序为姜黄素>姜黄挥发油>姜黄水提液;当剂量为10 μg/mL 时,血管生成抑制率排序为姜黄挥发油>姜黄素>姜黄水提液;当剂量为1 μg/mL 时,各给药组斑马鱼血管新生抑制率均较低,个别呈现无抑制作用。此外,各剂量给药组均无致胚胎死亡和致胚胎畸形的趋势。

表1 姜黄挥发油成分鉴定Table 1 Identification of ingredient in volatile oil of C.longa

图2 姜黄挥发油、姜黄素和姜黄水提液对斑马鱼血管新生的影响 (×100)Fig.2 Effect of volatile oil of C.longa, curcumin and decoction of C.longaon zebrafish angiogenesis (× 100)
3.3 基于网络药理学和分子对接探究姜黄抗血管新生的作用机制
3.3.1 姜黄主要成分的筛选 TCMSP 数据库检索出姜黄化学成分52 个,通过口服生物利用度>30%且类药性>0.10,共筛选得到活性成分14 个。通过查阅文献,发现姜黄素、β-榄香烯等成分虽然口服生物利用度差,但具有较好的生物活性和类药性,因此,整合数据后共得到活性成分21 个,见表3。
表2 姜黄挥发油、姜黄素和姜黄水提液对斑马鱼血管新生的影响 ( ± s , n=6)Table 2 Effect of volatile oil of C.longa, curcumin and decoction of C.longaon zebrafish angiogenesis ( ± s , n=6)

表2 姜黄挥发油、姜黄素和姜黄水提液对斑马鱼血管新生的影响 ( ± s , n=6)Table 2 Effect of volatile oil of C.longa, curcumin and decoction of C.longaon zebrafish angiogenesis ( ± s , n=6)
与对照组比较:*P<0.05*P< 0.05 vs control group
组别 质量浓度/(μg·mL-1) 血管生成数/条 血管生成抑制率/% 对照 — 22±2 — PTK787 0.025 12±3* 46.21±12.33 0.050 5±1* 77.27±4.06 0.100 2±1* 90.91±4.97 0.200 0±1* 99.24±1.85 姜黄挥发油 1 18±1* 18.18±5.74 10 16±1* 26.52±5.31 25 12±3* 43.94±11.73 50 10±2* 53.03±10.62 100 6±1* 73.48±6.04 姜黄素 1 19±2* 15.91±8.50 10 13±4* 40.15±20.41 25 8±2* 65.15±8.93 50 5±2* 77.27±9.53 100 3±1* 86.36±4.98 姜黄水提液 1 20±2 10.61±9.81 10 19±3* 15.91±12.44 25 16±2* 28.79±7.42 50 13±3* 41.67±11.99 100 10±2* 54.55±7.04

表3 姜黄主要活性成分Table 3 Main active ingredients of C.longa
3.3.2 潜在靶点的预测 采用TCMSP 数据库及PharmMapper 数据库得到姜黄21 个活性成分对应的靶点,删除重复靶点,得到靶点950 个。以相关性分数≥5 为筛选条件,删除重复靶点,得到与抗血管新生相关靶点1416 个。利用Venny 平台对其进行交集,得到106 个抗血管新生相关的潜在靶点。
3.3.3 “药物-成分-靶点”网络的构建 “药物-成分-靶点”网络如图3 所示,黄色代表姜黄,绿色代 表姜黄主要活性成分,粉色代表抗血管相关靶点,颜色越浅,节点越小,其度值越小。“药物-成分-靶点”网络图共有126 个节点,其中靶点106 个,姜黄主要活性成分19 个,通过CytoNCA 插件分析发现姜黄抗血管新生最主要的前8 种活性成分分别为姜黄素、去甲氧基姜黄素、莪术醇、双去甲氧基姜黄素、豆甾醇、吉马酮、β-榄香烯和芳姜黄酮。以2 倍中位数值共选取28 个靶点作为核心靶点,包括前列腺素G/H 合酶2/1(prostaglandin G/H synthase 2/1,(PTGS2/PTGS1)、维生素D3 受体(vitamin D3 receptor,VDR)、孕激素受体(progesterone receptor,PGR)、维甲酸受体-α(retinoic acid receptor-α,RXRA)等。
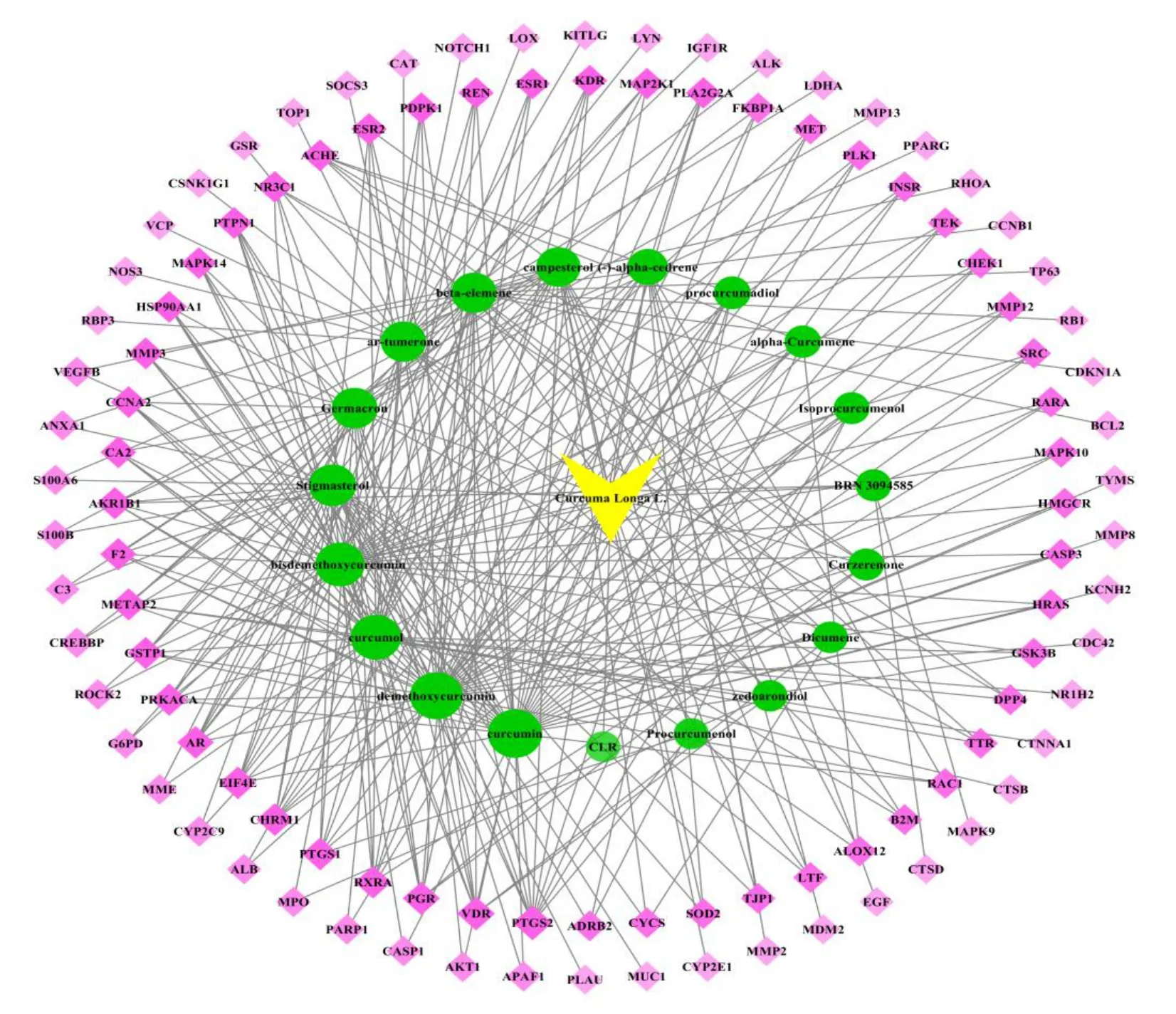
图3 姜黄“药物-成分-靶点”网络图Fig.3 “Drug-component-target” network of C.longa
3.3.4 PPI 网络的构建与分析 如图4 所示,PPI网络共有106 个节点、1181 条边,平均节点度为22.3,平均局部聚类系数为0.576。节点越大,颜色由浅黄到橙色,表明靶点度值越大,AKT1、血清白蛋白(albumin,ALB)、半胱氨酸蛋白酶-3(Caspase-3,CASP3)、表皮生长因子(epidermal growth factor,EGF)等靶点位于网络的核心位置,在PPI 网络中发挥关键调控作用。根据二倍中位数值进行筛选,得到PPI 网络核心基因21 个,采用R语言可视化为柱状图。

图4 姜黄抗血管新生PPI 网络图及核心基因柱状图Fig.4 PPI network of C.longa anti-angiogenesis and core gene column
3.3.5 GO 功能与KEGG 通路分析 借助DAVID数据平台对网络图中的28 个核心靶点以及21 个PPI 核心基因进行GO 富集分析,共得到226 个GO条目,其中生物过程条目159 个、细胞组成条目27个、分子功能条目40 个。根据P<0.01,取排名前10 的条目制作条形图见图5。姜黄抗血管生成涉及RNA 聚合酶II 启动子的转录起始、信号转导、受体酪氨酸蛋白激酶erbB-2(receptor tyrosine-protein kinase erbB-2,ERBB2)信号通路、细胞凋亡及增殖过程的调控、血管内皮生长因子受体信号通路等生物过程,细胞膜、细胞质、细胞核、高尔基体等细胞组成,酶结合、类固醇激素受体活性、蛋白质酪氨酸激酶活性、血红素结合、蛋白结合、胰岛素受体结合、锌离子结合等分子功能。
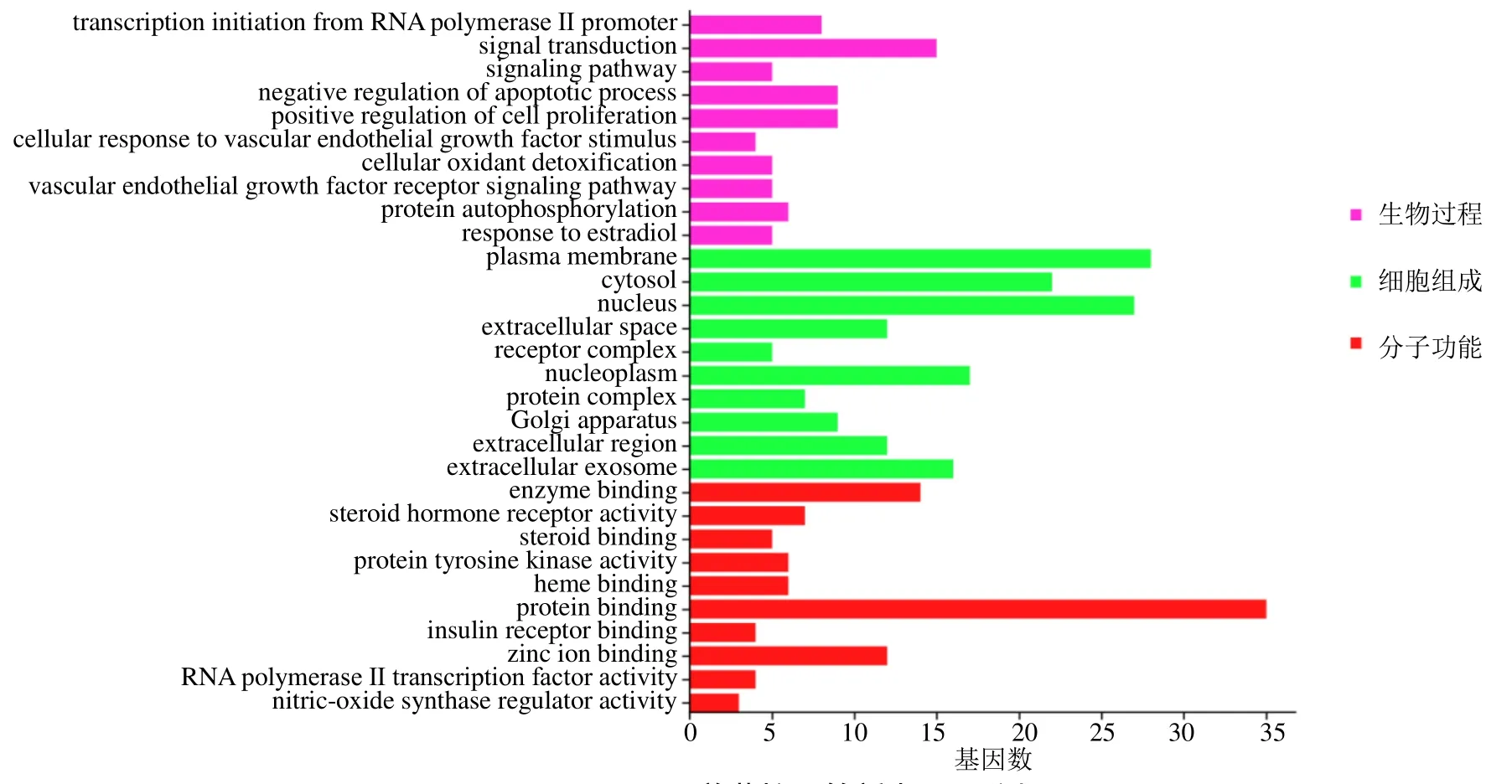
图5 姜黄抗血管新生GO 分析Fig.5 GO analysis of C.longa anti-angiogenesis
采用DAVID 数据平台进行KEGG 通路分析, 共富集到116 条通路,根据P<0.05,取P值最小的前20 条通路,采用R 语言绘制气泡图,Cytoscape 3.7.1 绘制“靶点-通路”图,如图6 所示,姜黄抗血管新生主要涉及VEGF 信号通路、PI3K-Akt 信号通路、FoxO 信号通路、雌激素信号通路、催乳素信号通路、甲状腺激素信号通路等,同时姜黄活性成分还参与了前列腺癌、EGFR 酪氨酸激酶抑制剂耐药、动脉粥样硬化、乳腺癌、膀胱癌、激活血小板、结直肠癌等信号通路,可见姜黄能够通过抗血管新生机制来改善动脉粥样硬化、肿瘤等疾病。

图6 姜黄抗血管新生KEGG 分析和“靶点-通路”图Fig.6 KEGG analysis of C.longa anti-angiogenesis and “target-pathway” network
3.3.6 分子对接验证 对度值排名前8 的活性成分与网络图中的核心靶点以及PPI 网络中的核心基因进行分子对接,最低结合能热图见图7,横坐标为核心靶点,纵坐标为姜黄的活性成分及抗血管新生临床常用药物索拉菲尼,颜色的深浅代表最低结合能大小,活性成分与靶点的最低结合能均小于0,表明配体与受体可以自发结合。吉马酮10 个核心靶点的结合能均小于-5.0 kJ/mol,豆甾醇与6 个核心靶点的结合能均小于-5.0 kJ/mol,β-榄香烯、芳姜黄酮与核心靶点的结合能力也较好,莪术醇与7 个核心靶点的结合能均小于-5.0 kJ/mol。各主要活性成分与关键靶点的分子对接模拟图见图8,莪术醇与VDR 的结合能力最好,对其做构象簇聚类分析见图9,莪术醇与VDR 在LYS-321 结合位点处形成 最优构象。簇分析发现,在-4.8 kJ/mol 处聚类最多,且所有构象结合能均小于0,表明莪术醇与VDR 结合较好。姜黄素、去甲氧基姜黄素和双去甲氧基姜黄素虽是姜黄抗血管新生度值较高的活性成分,但与核心靶点的结合能普遍较低,可能与其水溶性差、生物利用度较低有关。

图7 姜黄主要活性成分与关键靶点结合能热图Fig.7 Heat map of binding energy between major active components of C.longa and key targets

图8 姜黄主要活性成分与关键靶点分子对接模拟图Fig.8 Simulation diagram of docking between main active components of C.longa and key targets

图9 莪术醇-VDR 集成构象交互直方图与分子对接图Fig.9 Curcumol-VDR integrated conformation interaction histogram and molecular docking diagram
4 讨论
斑马鱼是研究血管生成的新型模式生物,其血管发育开始于原肠胚形成时期,与包括人类在内的高级脊椎动物非常相似,并贯穿于整个生命过程[16]。flk1-EGFP 转基因斑马鱼是一种在血管内皮细胞表面表达GFP 荧光信号的转基因动物,在蓝色荧光下其血管呈绿色。普通哺乳动物如鼠、家兔等的血管深藏体内不易观察,解剖行为会对血管造成一定的破坏;经典血管模型鸡胚绒毛尿囊膜模型虽具有一定的透明度,但其尿囊膜本身存在的血管会影响药物作用后新生血管计数,且鸡和人的种属差异也会使体外实验结果和临床试验结果存在较大差异[17]。斑马鱼因与人类基因的高度相似性及其胚胎独特的光学清晰度,成为了体内血管动态生成研究的高通量、高效率的优势模式生物。本研究基于模式生物斑马鱼比较姜黄挥发油、姜黄素和姜黄水提液对血管的抑制作用,预实验发现药物质量浓度为1000、500、100、1 μg/mL 时,各给药组均对斑马鱼血管生成有抑制作用;药物质量浓度为1000、500 μg/mL时具有明显的致畸作用,还有较强的胚胎致死作用,因此,本研究选取1~100 μg/mL 的质量浓度研究姜黄挥发油、姜黄素和姜黄水提液对斑马鱼血管新生的抑制作用。
本研究构建“药物-成分-靶点”网络,分析姜黄活性成分与靶点的相互作用关系,预测得到8 个姜黄抗血管新生关键活性成分,其中姜黄素、去甲氧基姜黄素、双去甲氧基姜黄素属于姜黄素类,芳姜黄酮、吉马酮、β-榄香烯、莪术醇为倍半萜类,豆甾醇为植物甾醇类[4]。研究发现,姜黄活性成分具有明显的血管新生调控作用。3 种姜黄色素类成分均能下调 VEGF、黏附分子-1(intercellular adhesion molecul-1,ICAM-1)[18]和基质金属蛋白酶(matrix metalloproteinases,MMPs)表达[19],抑制血管瘤内皮细胞 HemECs、人脐静脉内皮细胞HUVEC 的增殖[20]。姜黄挥发油组分能够明显抑制人肺微血管内皮细胞增殖,且明显对鸡胚绒毛尿囊膜血管生成抑制作用[21]。芳姜黄酮为姜黄挥发油中的特征性成分,其含量最高可达姜黄挥发油类成分的50%[22],能够抑制人微血管内皮细胞HMEC-1增殖及其成管萌芽管的形成,且对斑马鱼胚胎和C57BL/6 小鼠的血管形成均有明显的抑制作用[23]。吉马酮抑制血管新生研究多集中在肿瘤领域,能够通过降低 VEGF 表达,调控非小细胞肺癌NCI-H1770 细胞的增殖和凋亡[24]。莪术醇能够下调NF-κB 和VEGF 表达,从而抑制人肺癌A549 细胞增殖[25], 还可通过调控环氧合酶-2( cyclooxygenase-2 , COX-2 ) / 前列腺素E2(prostaglandin E2,PGE2)/VEGF 信号通路,抑制结直肠癌裸鼠移植瘤生长[26]。β-榄香烯能够明显抑制胃癌干细胞GCSCs 肿瘤微血管的生成[27]。豆甾醇能够下调肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)mRNA 表达水平,抑制小鼠肿瘤血管生成和胆管癌移植瘤生长[28]。
PTGS2 和VDR 是“药物-成分-靶点”网络中的关键靶点。PTGS2 是COX 的诱导型即刻反应基因,是花生四烯酸合成前列腺素类物质的关键性限速酶,主要参与炎性反应、动脉粥样硬化、肿瘤新生等多种信号转导[29]。研究发现,COX-2 可能以VEGF为重要介质诱导结直肠癌血管生成[30],目前虽有较多关于姜黄干预血管新生的研究,但姜黄通过PTGS 调控血管新生的报道较少,有待进一步验证。VDR 与RXR 形成异源二聚体,抑制人血管内皮细胞的凋亡,对糖尿病合并动脉粥样硬化具有一定的保护作用[31]。对姜黄的靶点进行PPI 映射并构建网络,发现AKT1 和ALB 是核心靶点,AKT1 负责调节代谢、细胞增殖和血管生成,姜黄素能够通过下调AKT 表达,抑制大鼠实验性脉络膜新生血管生成[32]。ALB 负责调节血液的胶体渗透压,目前有关ALB 直接调节血管新生的报道较少,但ALB 能够影响血管通透性,高通透性血管有利于肿瘤细胞和炎性细胞的浸润以及促血管生成因子的生成和局部聚集,提示后续可对此进行深入研究。
GO 功能和KEGG 通路富集分析发现,姜黄能够通过作用于PI3K-Akt信号通路、VEGF信号通路、乳腺癌、膀胱癌、结直肠癌等通路,调节蛋白质自身磷酸化、信号转导、细胞增殖、酶结合、血红素结合等功能。姜黄对癌症具有明显的改善作用,能够抑制肿瘤细胞的增殖、迁移,还能够延缓动脉粥样硬化进程,但其研究多集中在姜黄单一成分或单一通路上,忽略中药的多成分、多靶点以及中医整体观的理念,本研究从整体性及系统性的角度阐释姜黄抗血管生成的作用。
综上所述,姜黄挥发油、姜黄素和姜黄水提液均具有明显的抗斑马鱼血管新生的作用,姜黄素类、倍半萜类和植物甾醇类成分可能是姜黄抗血管生成的主要活性成分,可与AKT、ALB、CASP3、PEGS2、VDR、PGR 等靶点以氢键作用结合,通过RNA 调控、蛋白质自身磷酸化、细胞功能等调节PI3K-Akt信号通路、VEGF 信号通路以及癌症通路等,从而发挥抑制血管生成的作用。
利益冲突所有作者均声明不存在利益冲突
