基于指纹图谱及化学模式识别研究盐制对五子衍宗丸化学成分的影响
2021-06-11廖宇娇敖明月胡昌江陈志敏许润春
廖宇娇,敖明月,彭 颖,胡昌江,陈志敏,许润春
成都中医药大学药学院,四川 成都 611137
男性不育是困扰当代夫妇的一大难题,已成为全球社会性疾病[1]。据欧洲生殖学会统计,育龄夫妇1年内不能怀孕的占25%,其中男方因素占50%[2]。西医在治疗男性不育上缺乏特异性[3-4];而中医药在治疗男性不育方面理论基础丰富,具有独特的优势,针对不同病因病机的不育主要从益肾填精、健脾益气、养血活血等方面进行诊治[5]。近年来,中医及中西医结合在治疗男性不育方面愈发受重视。
五子衍宗丸(Wuzi Yanzong Pills,WYP)是中医补肾益精的经典名方,有“古今第一种子方”的美誉。现代研究表明,WYP 对生殖系统[6-8]、免疫系统[9]、神经系统[10-12]均有较好的保护作用;临床也多用WYP 及其加减方治疗不育、少弱精子、性功能障碍等男性生殖系统疾病[13-16],并且取得良好疗效。《中国药典》2020年版中WYP 由枸杞子、炒菟丝子、覆盆子、盐车前子、蒸五味子组成[17],中药炮制理论认为“盐,性味咸寒,盐制可引药下行,增强补肝肾作用”。《中药炮制学辞典》[18]指出菟丝子盐制后可去其温燥之性,平补肝肾,并可增强补肾固涩之功;在《中药制剂手册》[19]收载的WYP中菟丝子要求盐炙,以补肾填精;《得配本草》[20]中也要求菟丝子“淡盐水拌炒”。现代研究表明覆盆子盐制更适合于补肾益精[21],《外科证治全生集》[22]和《时方妙用·时方歌括》[23]中分别有五味子“盐水拌蒸”“盐水浸炒”的记载。另外,根据计算,此3味药盐制后组成WYP 其盐含量也不会给肾脏带来负担。WYP 中菟丝子、覆盆子、五味子是否也应该采用盐制,值得探讨。
本课题组在前期工作中已分别进行了处方中几味药盐制前后药效差异研究,结果显示盐覆盆子鞣花酸含量增加,对肾阳虚多尿大鼠的醛固酮、尿量和肾脏指数的改善作用优于生品[21];盐五味子在改善肾精亏虚大鼠卵泡刺激素、促黄体生成素等方面优于生五味子、蒸五味子;对比研究枸杞子生品及盐制品对肾阴虚大鼠的作用,差异不显著,故枸杞子仍使用生品;此外,以复方为研究对象,研究显示WYP 中药物盐制后组方可增强复方补肾生精的疗效[24-25]。在此基础上,本研究从指纹图谱变化入手,通过建立WYP 全生品组(5 味药均为生品)、药典组(按药典规定方法进行炮制)、盐制组(除枸杞子外,其余4 味药用盐水炮制)指纹图谱,对比分析不同组化学成分差异,以期为WYP 中如何选用药物炮制品提供一定的参考。
1 仪器与材料
1.1 仪器
UltiMate 3000 高效液相色谱仪,Thermo Fisher Scientific 公司;BP110S 十万分之一分析天平,德国Sartorius 公司;KQ-300E 超声波清洗器,昆山市超声仪器有限公司;TW-2000W 可控调温电炉,郫县永信电器厂。
1.2 药物及试剂
枸杞子(四川国强中药饮片有限公司,批号19030105;四川新荷花中药饮片有限公司,批号1907125、2008077)、菟丝子(四川新荷花中药饮片有限公司,批号1808099、1907075、D2007005)、覆盆子(成都市都江堰春盛中药饮片股份有限公司,批号170401;四川国强中药饮片有限公司,批号19030101、18070103)、车前子(四川国强中药饮片有限公司,批号18080104;四川新荷花中药饮片有限公司,批号1909008、2002042)、五味子(四川新荷花中药饮片有限公司,批号1810092、1907085、2008093),以上药材均经成都中医药大学胡昌江教授鉴定,分别为茄科枸杞属植物宁夏枸杞Lycium barbarumL.的干燥成熟果实、旋花科菟丝子属植物南方菟丝子Cuscuta australisR.Br.的干燥成熟种子、蔷薇科悬钩子属植物华东覆盆子Rubus chingiiHu 的干燥果实、车前科车前属植物车前Plantago asiaticaL.的干燥成熟种子、木兰科五味子属植物五味子Schisandra chinensis(Turcz.) Baill.的干燥成熟果实。
对照品绿原酸(批号110753-202018,质量分数≥96.1%)、金丝桃苷(批号111521-201809,质量分数≥94.9%)、五味子醇甲(批号 110857- 201815,质量分数≥99.7%)、山柰酚(批号110861- 202013,质量分数≥93.2%)、毛蕊花糖苷(批号111530-201914,质量分数≥95.2%)、异槲皮苷(批号111809-201804,质量分数≥97.2%)均购于中国食品药品检定研究院;对照品鞣花酸(批号CHB-R-039,质量分数≥98%)、紫云英苷(批号CHB-Z-050,质量分数≥98%)均购于成都克洛玛生物科技有限公司。乙腈,色谱纯,Fisher Scientific公司;甲醇,色谱纯,Sigma Aldrich 公司;甲醇、磷酸,分析纯,购于成都市科隆化工试剂厂。
2 方法与结果
2.1 色谱条件[26]
Agilent 5TC-C18(2)色谱柱(250 mm×4.6 mm,5 μm);流动相乙腈-0.4%磷酸水溶液,梯度洗脱:0~5 min,5%~15%乙腈;5~10 min,15%~17%乙腈;10~25 min,17%乙腈;25~35 min,17%~26%乙腈;35~60 min,26%~56%乙腈;柱温40 ℃;体积流量1.0 mL/min;检测波长254 nm;进样5 μL。
2.2 药物的炮制
菟丝子、覆盆子、车前子、五味子的炮制均按照文献方法进行[26]。
2.2.1 炒菟丝子 取净菟丝子,文火炒至微黄,取出,放凉。
2.2.2 盐菟丝子 取净菟丝子,加入盐水拌匀,待盐水吸尽后,至炒制容器内,文火炒至微鼓起,取出,放凉。每100 克菟丝子,用食盐2 g。
2.2.3 盐覆盆子 取净覆盆子,加入盐水拌匀,闷润,待盐水吸尽后,至蒸制容器内蒸至透心,取出,干燥。每100 克菟丝子,用食盐2 g。
2.2.4 盐车前子 取净车前子,置炒制容器内,文火炒至起爆裂声时,喷洒盐水,炒干,取出,放凉。每100 克菟丝子,用食盐2 g。
2.2.5 蒸五味子 取净五味子,至蒸锅内,用蒸汽加热至黑色,取出,干燥。
2.2.6 盐五味子 取净五味子,加入盐水拌匀,闷润,待盐水吸尽后,置炒制容器内,文火炒干,取出,放凉。每100 克菟丝子,用食盐2 g。
2.3 溶液的制备
2.3.1 对照品溶液的制备 分别精密称取绿原酸、鞣花酸、金丝桃苷、异槲皮苷、毛蕊花糖苷、紫云英苷、槲皮素、山柰酚、五味子醇甲对照品适量于5 mL 量瓶中,加入甲醇溶解定容,摇匀,即得质量浓度分别为0.410、0.436、0.480、0.400、0.458、0.412、0.526、0.408、0.432 mg/mL 对照品储备液。分别吸取上述对照品储备液240、300、240、80、240、130、50、80、80 μL 至5 mL 量瓶中,加甲醇定容至刻度,摇匀,即得混合对照品溶液。
2.3.2 WYP 供试品溶液的制备 将不同批号的5味药材随机组合成15 个不同批次的WYP(全生品组、药典组、盐制组同一批次为同一批号药物不同炮制品的组合),WYP 各组药物炮制情况及15 个批次的药物批号信息分别见表1、2。将枸杞子、菟丝子、覆盆子、车前子、五味子粉碎成细粉,过80目筛,按8∶8∶4∶2∶1 的比例混匀,备用;取2 g,精密称定,置干燥洁净的具塞锥形瓶中,加入70%甲醇50 mL,密塞,称定质量,回流提取60 min,取出,冷却至室温,用70%甲醇补足减失的质量,摇匀,滤过,续滤液经0.45 μm 微孔滤膜滤过,即得WYP 全生品组供试品溶液,记为S1~S15。同法制得15 个批次药典组(记为YD1~YD15)、盐制组(记为YZ1~YD15)供试品溶液。

表1 各组WYP 中药味炮制情况Table 1 Processing of WYP in each group

表2 15 批WYP 中药味组成批号信息Table 2 Batch number information of 15 batches of WYP
2.3.3 WYP 中单味药材及各缺药材阴性样品供试品溶液的制备 分别称取“2.3.2”项下比例的各单味药材以及缺药材阴性样品,置不同干燥洁净的具塞锥形瓶中,按“2.3.2”项下方法制备单味药材供试品溶液及缺药材阴性样品供试品溶液。
2.4 指纹图谱方法学考察
2.4.1 精密度试验 取同一WYP(S1)供试品溶液,按“2.1”项下色谱条件,每次进样5 μL,连续进样6 次,记录HPLC 图,以金丝桃苷为参照峰(为君药菟丝子中成分,且保留时间适中,峰面积较大,分离度良好),计算得到各共有色谱峰相对保留时间的RSD 值为0.011%~0.052%,相对峰面积的RSD值为1.02%~2.79%,表明该仪器精密度良好。
2.4.2 重复性试验 按“2.3.2”项下方法平行制备WYP(S1)供试品溶液6 份,按“2.1”项下色谱条件,分别进样5 μL,记录HPLC 图,以金丝桃苷为参照峰,计算得到各共有色谱峰相对保留时间的RSD 值为0.016%~0.100%,相对峰面积的RSD 值为0.45%~2.70%,表明该方法重复性良好。
2.4.3 稳定性试验 取同一WYP(S1)供试品溶液,按“2.1”项下色谱条件,依次于制备后0、2、4、8、12、24 h 进样5 μL,记录HPLC 图,以金丝桃苷为参照峰,计算得到各共有色谱峰相对保留时间的RSD 值为0.008%~0.024%,相对峰面积的RSD 值为0.31%~2.70%,表明供试品溶液在24 h内稳定。
2.5 WYP 中药物盐制前后组方的HPLC 指纹图谱的建立
2.5.1 HPLC 指纹图谱的建立 取“2.3.2”项下15个批次的全生品组、药典组、盐制组的WYP,按“2.1”项下色谱条件,分别进样5 μL,得到HPLC图,将所得图谱导入《中药色谱指纹图谱相似度评价系统》(2012.130723 版)软件,以S1 图谱为参照图谱,时间窗宽度设置为0.1 s,采用中位数生成方法,进行多点校正和全谱峰匹配,生成WYP 全生品组、药典组、盐制组指纹图谱及相应的对照图谱,共确定了18 个共有峰,见图1。
以对照指纹图谱为参照,计算得到15 批全生品组的WYP 样品指纹图谱相似度分别为0.959、0.949、0.972、0.963、0.936、0.966、0.939、0.962、0.956、0.954、0.943、0.954、0.910、0.963、0.950;15 批药典组的WYP 样品指纹图谱相似度分别为0.987、0.963、0.969、0.985、0.964、0.975、0.966、0.967、0.989、0.965、0.988、0.948、0.963、0.970、0.985;15 批盐制组的WYP 样品指纹图谱相似度分别为0.993、0.992、0.989、0.996、0.990、0.993、0.994、0.990、0.993、0.992、0.989、0.995、0.994、0.995、0.994;各组指纹图谱相似度均大于0.9,相似度良好,表明所建立的WYP 全生品组、药典组、盐制组指纹图谱质量稳定,可以反映其基本特征。
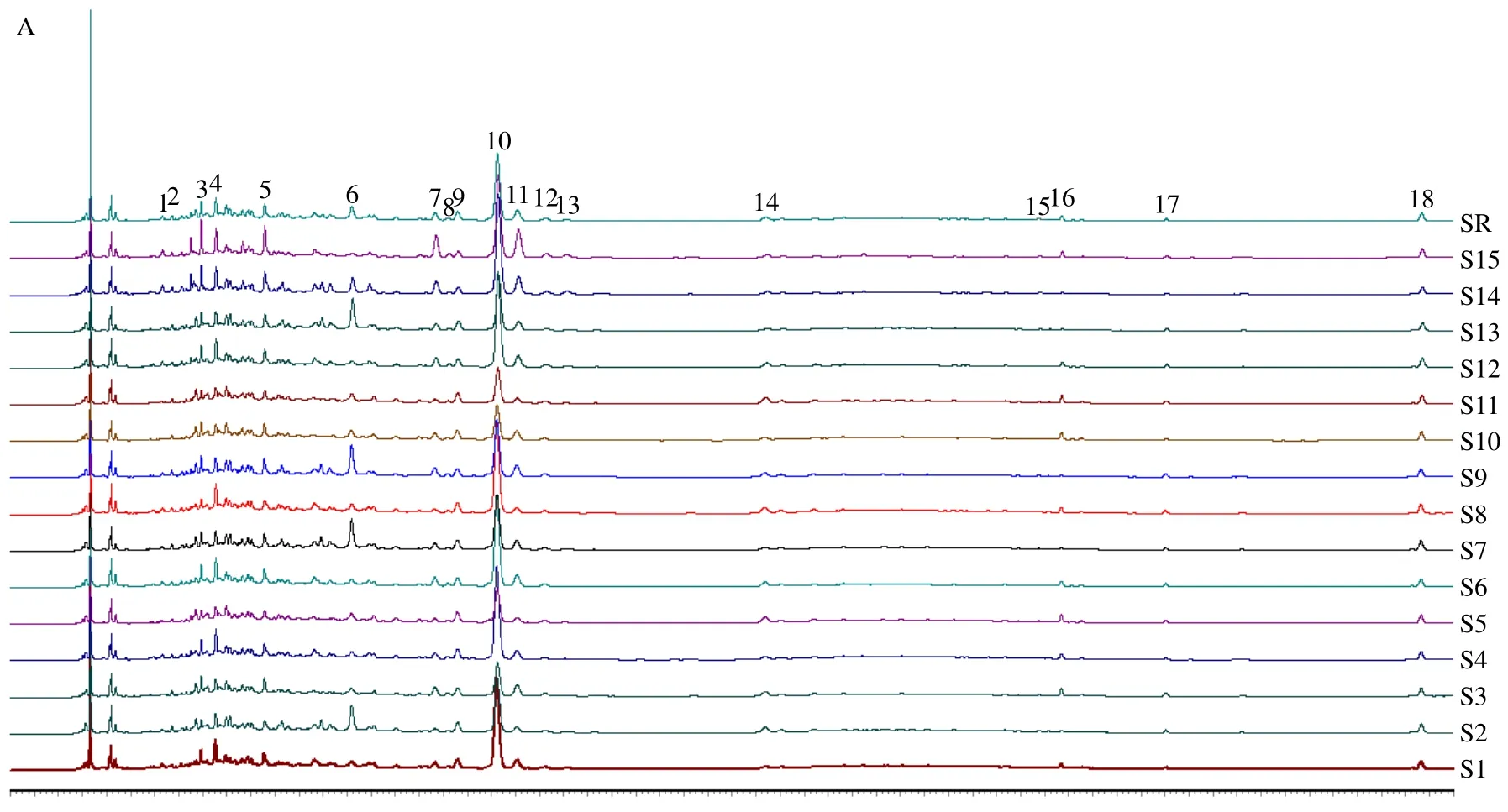

图1 WYP 全生品组 (A)、药典组 (B)、盐制组 (C) 指纹图谱及混合对照品色谱图 (D)Fig.1 Fingerprints of WYP of whole-raw group (A), pharmacopoeia group (B), salt-water processing group (C) and HPLC chart of mixed reference substances (D)
经对照品比较指认了其中9 个共有色谱峰,分别是绿原酸(5 号峰)、鞣花酸(10 号峰)、金丝桃苷(11 号峰)、异槲皮苷(12 号峰)、毛蕊花糖苷(13号峰)、紫云英苷(14 号峰)、槲皮素(15 号峰)、山柰酚(17 号峰)、五味子醇甲(18 号峰)。
2.5.2 共有色谱峰的指认与归属性分析 取“2.3.3”项下枸杞子、菟丝子、覆盆子、车前子、五味子单味药以及各缺药材阴性样品供试品溶液,按“2.1”项下色谱条件,分别进样5 μL,得到HPLC 图,WYP 样品、单味药材及缺药材阴性样品HPLC 图见图2。通过与WYP 全方HPLC 图进行比对,其中2 号峰归属于枸杞子,3、5(绿原酸)、7、9、11(金丝桃苷)、12(异槲皮苷)、14(紫云英苷)、15(槲皮素)、17(山柰酚)号峰归属于菟丝子,4、6、8、10(鞣花酸)、16 号峰归属于覆盆子,13(毛蕊花糖苷)号峰归属于车前子,18(五味子醇甲)号峰归属于五味子,1 号峰归属于覆盆子和五味子,4号峰归属于枸杞子和覆盆子。

图2 WYP 全生品组、药典组、盐制组样品 (E) 和各单味药及阴性样品 (F) 的HPLC 图Fig.2 HPLC chart of WYP sample of whole-raw product group, pharmacopoeia group, salt-water processing group (E) and each single herb and negative samples of WYP (F)
2.6 化学模式分析
2.6.1 方差分析 将15 批全生品组、药典组、盐制组WYP 样品18 个共有峰峰面积导入SPSS 19.0 数据分析软件,进行单因素方差分析[27],结果见表3。分析发现,药物炮制后组方WYP 大部分共有峰峰面积发生变化,其中药物盐制后组方变化更加明显;与全生品组比较,药典组除峰1、4、6、10、16 外均有显著性差异,盐制组除峰16 外均有显著性差异;与药典组比较,盐制组除峰2、4、13、14、16外均发生明显改变;综合比较,药物炮制前后组方WYP 峰3、5、7~9、11、12、17、18 差异较大。
2.6.2 聚类分析 采用SPSS 19.0 数据分析软件,以15 批全生品组、药典组、盐制组WYP 样品18个共有峰峰面积为变量,采用组间连接法,以平方欧氏距离为测度进行系统聚类,聚类结果见图3。从聚类结果来看,平方欧式距离为15 时,15 批全生品组样品(S1~S15)聚为一类,15 批药典组样品(YD1~YD15)聚为一类,15 批盐制组样品(YZ1~YZ15)聚为一类,表明不同炮制品组方WYP 在化学成分含量上差异较大。
表3 15 批不同炮制品组方WYP 中18 个共有峰峰面积方差分析结果 (± s, n = 15)Table 3 Results of variance analysis of common peak area shared by 15 batches of different processed products of WYP (± s, n = 15)

表3 15 批不同炮制品组方WYP 中18 个共有峰峰面积方差分析结果 (± s, n = 15)Table 3 Results of variance analysis of common peak area shared by 15 batches of different processed products of WYP (± s, n = 15)
与全生品组比较:*P<0.05 **P<0.01;与药典组比较:▲P<0.05 ▲▲P<0.01*P < 0.05 **P < 0.01 vs whole-raw product group; ▲P< 0.05 ▲▲P < 0.01 vs pharmacopoeia group
共有峰 全生品组共 有峰峰药面典积组/( m AU·min-1盐) 制组 共有峰 全生品组 共 有峰峰药面典积组/( m AU·min-1)盐 制组 1 0.48±0.24 0.59±0.33 1.33±0.18**▲▲ 10 24.02±9.55 20.89±4.91 38.36±5.65**▲▲ 2 0.88±0.21 1.18±0.29* 1.21±0.38** 11 3.65±1.04 18.18±0.94** 9.65±1.74**▲▲ 3 2.63±0.36 6.35±0.56** 4.53±0.53**▲▲ 12 1.31±0.29 3.04±0.21** 1.85±0.31**▲▲ 4 4.48±0.71 5.36±1.30 5.49±0.31** 13 0.64±0.20 1.77±0.26** 1.85±0.36** 5 4.28±0.89 7.37±0.82** 5.07±0.62**▲▲ 14 2.11±0.71 1.17±0.26** 1.34±0.34** 6 5.80±3.31 4.84±1.38 3.04±1.68*▲ 15 0.31±0.27 0.86±0.36** 0.39±0.02▲▲ 7 2.54±0.58 10.87±0.47** 5.85±1.24**▲▲ 16 0.89±0.46 0.94±0.48 0.85±0.40 8 0.94±0.26 1.82±0.30** 1.17±0.33*▲▲ 17 0.69±0.13 0.27±0.03** 0.43±0.09**▲▲ 9 3.48±0.51 2.09±0.25** 2.45±0.41**▲ 18 2.61±0.14 1.87±0.28** 2.33±0.30*▲▲
2.6.3 主成分分析(PCA) 以15 批全生品组、药典组、盐制组WYP 样品18 个共有峰峰面积为原始数据,采用SPSS 19.0 数据分析软件对共有峰峰面积进行标准化处理,再进行PCA,分析结果见表4、5 和图4。以特征值大于1 为提取原则,共提取到4个主成分,累积贡献率为83.51%,表明这4 个主成分包含了18 个共有成分83.51%的信息,可以反映样品的主要特征,具有较好的代表性,见表4。由表4、5 可知,主成分1 特征值为8.911,方差贡献率为49.508%,对应峰3、5(绿原酸)、7、8、11(金丝桃苷)、12(异槲皮苷)、17(山柰酚)、18(五味子醇甲)有较高载荷,说明这8 个成分对第1 主成分的影响较大;主成分2 特征值为3.199,方差贡献率为17.770%,对应峰1、10(鞣花酸)、4 有较高载荷,说明这2 个成分对第2 主成分的影响较大;主成分3 特征值1.695,方差贡献率为9.418%,对应峰16 有较高载荷;主成分4 特征值1.227,方差贡献率为6.814%,对应峰2 有较高载荷。将15 批全生品组、药典组、盐制组WYP 样品18 个共有峰峰面积导入SIMCA 14.1 软件,绘制主成分得分图,见图4,其分类结果与聚类分析结果一致。

图3 WYP 样品的聚类分析Fig.3 Cluster analysis chart of samples of WYP sample
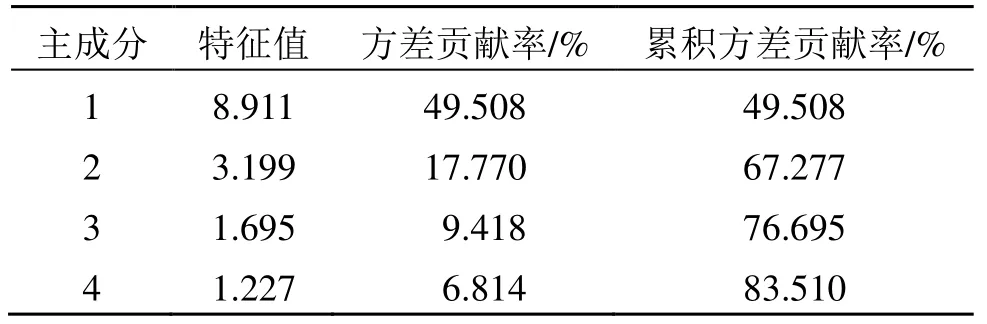
表4 特征值及方差贡献率Table 4 Eigenvalues and contribution rates of cumulative variance

表5 初始因子载荷矩阵Table 5 Initial factor loading matrix
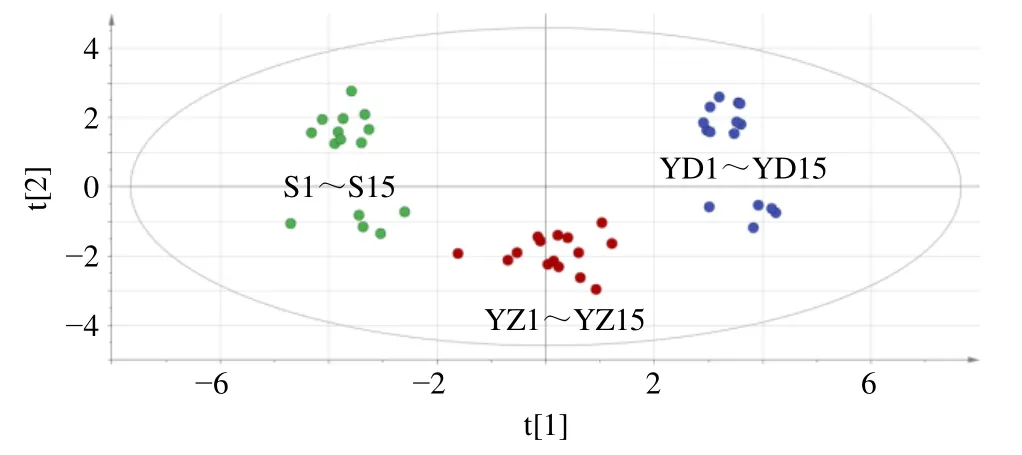
图4 WYP 样品的主成分得分图Fig.4 Principal component score chart of samples of WYP
2.6.4 偏最小二乘法-判别分析(PLS-DA) 以15 批全生品组、药典组、盐制组WYP 样品18 个共有峰峰面积为变量,导入SIMCA 14.1 软件,运行PLS- DA 程序。结果发现累积解释能力参数(R2X、R2Y)分别为0.714、0.898,预测能力参数(Q2)为0.836,均大于0.5,表明所建立的模型稳定可靠、预测能力强,可用于区分不同炮制品组方的WYP;从图5 可以看出15 批全生品组、药典组、盐制组WYP 样品中,18 个共有峰峰面积数据点均落在95%置信区间内,根据分布可分为3 类,与聚类分析、PCA 结果一致。

图5 WYP 样品的PLS-DA 得分图Fig.5 PLS-DA score plot chart of samples of WYP
对建立的PLS-DA 模型进行200 次置换检验,结果见图6。从图中可以看出,右边的R2和Q2值均大于0.9,均高于左边的值,Q2回归线的截距为负值,表明所构建的PLS-DA 模型未出现过度拟合,预测能力较好,可以用来判别分析不同炮制品组方的WYP。根据变量重要性投影(variable importance in projection,VIP)值筛选影响药物炮制前后组方WYP 化学成分差异的标志性成分,结果见图7,在95%置信区间内,VIP 值越大,差异越显著,对区别不同炮制品组方WYP 的贡献越大。以VIP>1 为标准,筛选出了9 个影响样品分组的关键成分,根据VIP 值大小依次为峰1、13(毛蕊花糖苷)、10(鞣花酸)、7、4、11(金丝桃苷)、12(异槲皮苷)、3、5(绿原酸),说明这9 个成分对炮制前后组方的WYP 分类具有显著影响,可作为WYP 炮制前后分别组方差异的主要潜在标志物。

图6 置换检验图Fig.6 Chart of permutation test

图7 WYP 样品的VIP 值图Fig.7 VIP values of samples of WYP
3 讨论
在实验条件摸索过程中,分别考察了提取溶剂 (甲醇、70%甲醇、50%甲醇、乙醇、70%乙醇、50%乙醇)、提取方法(超声法和回流提取法)对供试品色谱峰数量、峰形、分离度、峰面积的影响,最终确定70%甲醇回流提取1.0 h 效果最佳。考察不同流动相(甲醇-水、乙腈-水、乙腈-0.1%磷酸水溶液、乙腈-0.2%磷酸水溶液、乙腈-0.3%磷酸水溶液、乙腈-0.4%磷酸水溶液)、不同柱温(25、30、35、40 ℃)、不同体积流量(0.6、0.8、1.0 mL/min)对分离效果的影响,发现采用乙腈-0.4%磷酸水溶液、柱温40 ℃、体积流量为1.0 mL/min 时,分离效果更好。采用DAD 检测器对样品进行全波长扫描,并结合《中国药典》2020年版[17]波长条件,考察了样品在波长210、254、280、320、360 nm 下HPLC 图色谱峰分离度、峰形等的影响,最终检测波长选择254 nm。
本实验在现有文献研究的基础上,对实验方法进行了改良,建立了WYP 全生品组、药典组、盐制组指纹图谱,通过相似度评价得到相似度均大于0.9,表明各批次WYP 间整体质量较稳定,标记了18 个共有峰,通过对照品指认了其中9 个;比较全生品组、药典组、盐制组色谱峰数量及峰面积差异,未发现新的化学成分,但峰面积发生变化。结合课题组前期药理实验结果[24-25],提示药物炮制后组方WYP 可能通过改变复方中化学成分含量而增强补肾生精效果。
化学计量学在对大量样本进行处理时可快速、全面地鉴别归类,广泛应用于中药鉴别、中药炮制、组效关系等研究[28-31]。本实验对不同批次不同炮制品组方的WYP 指纹图谱共有峰峰面积进行方差分析,发现不同炮制品组方的WYP 在峰3、5、7~9、11、12、17、18 上差异较大;聚类分析发现WYP全生品组、药典组、盐制组各自聚为一类,说明不同炮制品组方的WYP 化学成分含量上差异较大,可初步推断WYP 中药物炮制后组方可影响复方的化学成分含量;PCA 筛选得到影响样品分类的4 个主成分,从载荷值可以看出,峰1、3~5、7、8、10~12、17、18 是影响不同炮制品组方WYP 分类的主要成分;PLS-DA 从18 个共有峰中筛选出9 个差异标志物,为峰1、3~5、7、10~13。综合实验结果,峰1、3~5、7、8、10~12、17、18 共11个成分可能是影响不同炮制品组方WYP 的差异性成分,明确了绿原酸、鞣花酸、金丝桃苷、异槲皮苷、山柰酚、五味子醇甲6 个成分,其余5 个成分还需要进一步借助LC-MS/MS、LC-Q-TOF-MS、NMR 等技术进行鉴别。
现代研究表明,金丝桃苷对精子活力有促进作用[32],鞣花酸可减轻睾丸损伤,提高精子质量[33-35],本研究提示鞣花酸、金丝桃苷是产生不同炮制品组方WYP 差异的标志性成分,从指纹图谱看,WYP药典组金丝桃苷峰面积增加,鞣花酸峰面积减少,盐制组鞣花酸、金丝桃苷峰面积均增加,且盐制组毛蕊花糖苷、紫云英苷、山柰酚、五味子醇甲的峰面积高于药典组,推测WYP 中药物炮制后组方可能通过促进复方化学成分的溶出,增强复方补肾益精作用,盐制对WYP 中化学成分的影响更大,盐制组可能更有优势。
综上,本研究建立了不同炮制品组方WYP 指纹图谱,通过化学识别初步分析了影响炮制前后组方化学成分的差异标志性成分,实验结果能够较为全面地探讨炮制对WYP 化学成分的影响。但复方化学成分复杂,本研究仅对炮制前后共有峰进行了分析,不够深入,后期可加强对WYP 中化学成分的研究,对筛选出的11 个差异标志物进行含量测定,并跟踪这些成分的体内过程,通过比较WYP中药物炮制前后组方有效成分血中移行量、组织分布、代谢排泄等情况,探讨炮制对复方化学成分体内体外的影响,以期为中药炮制理论“盐制入肾,肾主生殖”提供依据。
利益冲突所有作者均声明不存在利益冲突
