鱼酱酸调味料中氨基酸含量分析
2021-06-11杨坤吴凯仪张建炀顾阳刘桂琼管春成
杨坤,吴凯仪,张建炀,顾阳,刘桂琼,管春成
(黔东南州食品药品检验检测中心,贵州 凯里 556012)
鱼酱酸调味料是贵州省黔东南州苗族地区原生态饮食的一种传统发酵调味料食品,是以雷公山区域内溪流中鱼扇子、爬岩鱼等河鱼和当地种植的鲜辣椒为主要原料,配以食盐、生姜、白酒、醪糟、大米等辅料,采用传统密闭发酵工艺酿制而成的一种新型半固态调味料[1-3],其不仅富含大量人体必需的氨基酸、维生素等营养物质,而且具有提高食欲、健胃作用。氨基酸作为鱼酱酸的重要营养指标之一,其组成和含量能够在一定程度上反映鱼酱酸的原材料来源和发酵程度,目前很少有研究报道鱼酱酸调味料中氨基酸含量成分。因此,氨基酸含量成分的检测对鱼酱酸调味料的营养价值研究和质量控制具有十分重要的意义。
目前,氨基酸的分析方法包括柱后衍生-高效液相色谱法[4-9]、离子交换色谱法[10-11]和液相色谱串联质谱法等[12-15]。其中以柱后衍生-高效液相色谱法技术研制的氨基酸分析仪已被广泛应用于氨基酸分析,但其具有耗时长、检出限高等缺点,超高效液相色谱-串联质谱法因具有高灵敏度、高效快速和高通量等优点而成为最近几年国内外分析氨基酸含量的热点[16-18]。本研究基于UPLC-MS/MS技术,建立同时快速测定鱼酱酸调味料中17种氨基酸的检测方法。
1 材料与方法
1.1 试剂与仪器
1.1.1 试剂
17种氨基酸混合标准溶液(甘氨酸、丙氨酸、丝氨酸、脯氨酸、异亮氨酸、天冬氨酸、赖氨酸、谷氨酸、甲硫氨酸、组氨酸、精氨酸、苯丙氨酸、胱氨酸、亮氨酸、酪氨酸、苏氨酸、缬氨酸含量均为1.00 μmol/mL):坛墨质检科技股份有限公司。
甲醇(色谱纯):德国Merck公司;甲酸(色谱纯)、盐酸(优级纯):国药集团化学试剂有限公司;水为实验室自制超纯水;鱼酱酸样品:购于当地超市。
1.1.2 仪器
AB SCIEX API 4000+质谱联用系统 美国AB SCIEX公司;Agilent 1290 Infinity II型液相色谱仪 美国Agilent公司;Milli-Q纯水机 美国Millipore公司;ML104电子天平 瑞士梅特勒-托利多(上海)仪器公司;3-18k型高速冷冻离心机 德国Sigma公司; KQ-700DE型数控超声波清洗器 昆山市超声仪器公司。
1.2 标准系列工作溶液的配制
准确吸取1.00 μmol/mL氨基酸混合标准溶液1.00 mL于10 mL容量瓶中,用水定容至刻度,配制成浓度为100 nmol/mL的储备液溶液,保存于4 ℃冰箱中,备用。
分别精密吸取不同体积的氨基酸储备溶液,用水稀释成不同浓度系列的混合标准溶液(质量浓度见表2),然后进液相色谱-质谱仪分析测定,绘制峰面积与标准溶液浓度标准曲线。
1.3 方法
1.3.1 样品处理方法
水解氨基酸:称取1.00 g样品于50 mL离心管中,加30 mL水超声40 min溶解,冷却至室温后定容至刻度,在6000 r/min下离心10 min,然后取适当溶液于25 mL容量瓶中加水定容至刻度,过0.22 μm水相滤膜,取续滤液上机。
酸水解氨基酸:称取1.00 g样品于20 mL水解管中,加入10 mL 6 mol/L盐酸,充氮气后盖紧旋盖,于110 ℃下酸解22 h后取出冷却至室温。转移水解液至50 mL离心管中并用水多次冲洗水解管,用水定容至刻度,振荡混匀,在6000 r/min下离心10 min,然后取适当溶液于25 mL容量瓶中加水定容至刻度,过0.22 μm水相滤膜,取续滤液上机。
1.3.2 分析条件
色谱条件:Waters ACQUITY UPLC HSS T3色谱柱(100 mm×2.1 mm,1.8 μm),流动相A为水溶液(含0.1%甲酸),B为乙腈(含0.1%甲酸)。梯度洗脱程序:0~1.50 min,1.0% B;1.50~2.00 min,20% B;2.00~3.00 min,80% B,3.00~4.90 min,80% B,4.90~5.00 min,1.0% B。后运行2.50 min,流速0.2 mL/min;进样量2 μL;柱温:30 ℃。
质谱条件:电喷雾离子源,正离子电离模式,去溶剂温度:500 ℃;气帘气压力:172 kPa;碰撞气压力:41 kPa;离子气1压力:414 kPa;离子气2压力:379 kPa;离子喷射电压:5500 V;扫描方式:多反应监测(MRM)模式,其他质谱参数条件见表1。
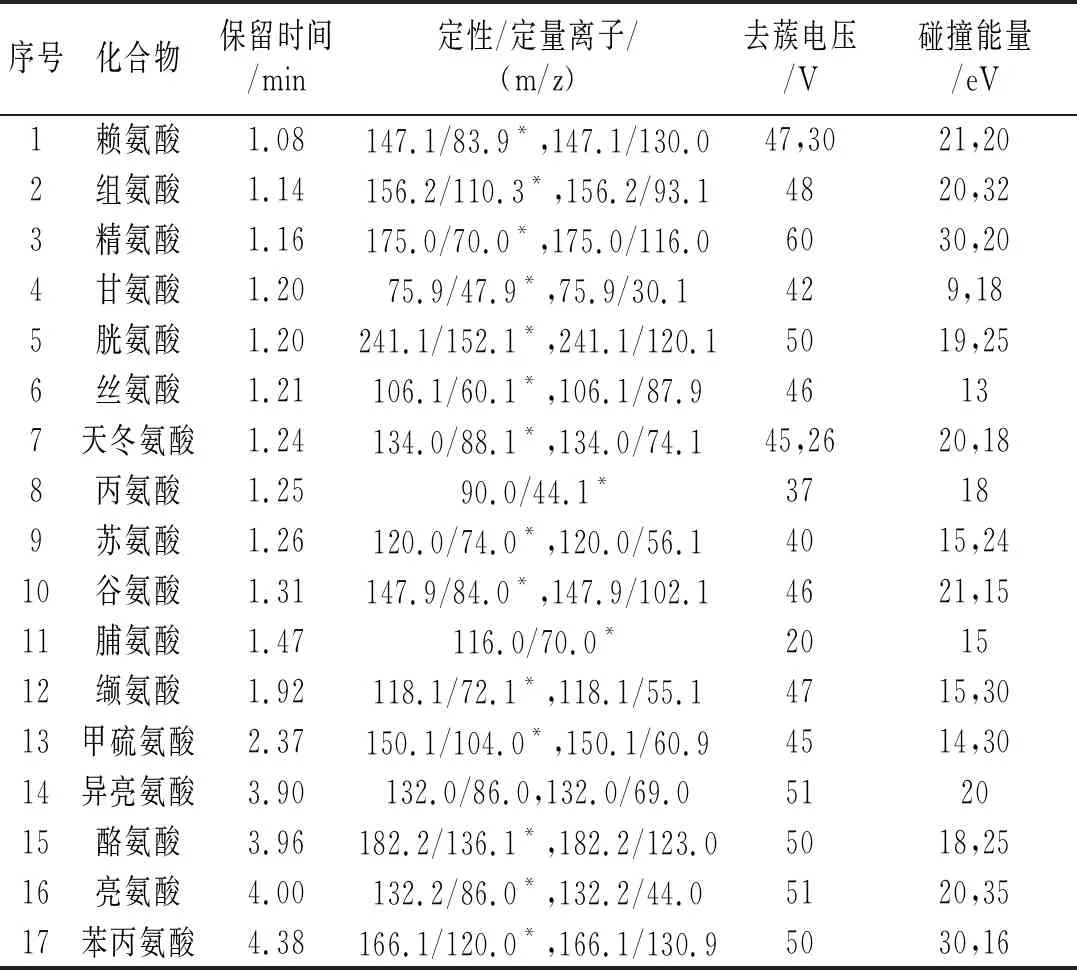
表1 氨基酸的质谱分析参数
1.3.3 计算公式
采用标准曲线法计算氨基酸含量:
式中:X为式样中氨基酸的含量,%;c为待测样品各氨基酸的含量,nmol/mL;F为试样稀释倍数;V为试样定容体积,mL;M为氨基酸分子质量;m为试样质量,g;109为样品含量换算系数。
2 结果与分析
2.1 色谱条件优化
由于氨基酸分子含有氨基和羧基两种官能团,其极性较大,本研究首先选择了Waters ACQUITY UPLC BEH Hilic(100 mm×2.1 mm,1.7 μm)和Waters ACQUITY UPLC BEH Amide(100 mm×2.1 mm,1.8 μm)两根亲水色谱柱考察其保留效果,研究发现部分氨基酸出现拖尾和分叉现象,原因可能是样品溶液用水溶解导致在Hilic亲水色谱模式下出现溶剂扩散效应。而大部分氨基酸在普通C18色谱柱上保留效果较差,样品中大量的强极性干扰物质会干扰目标化合物,导致一定的基质效应。因此,本研究选择对亲水有较大保留效果的T3色谱柱(Waters ACQUITY UPLC HSS T3,100 mm×2.1 mm,1.7 μm)进行分离,达到了较好的分离效果,其正离子多反应监测色谱图见图1。

图1 17种氨基酸的MRM色谱图
进一步对流动性的种类进行考察,当选择乙腈作为有机相时,亮氨酸和异亮氨酸无法实现基线分离,甲醇为流动相时,亮氨酸和异亮氨酸能达到较好的分离,并且保留效果增强。选择甲酸铵和乙酸铵作为水相时,部分氨基酸出现信号抑制现象。因此,选择0.1%甲酸水溶液作为水相能确保17种氨基酸的灵敏度。
2.2 质谱条件优化
在离子源正离子模式下以流动注射方式对17种氨基酸进行母离子(Q1)全扫描,确定各目标化合物的母离子,再对母离子进行二级质谱扫描(MS2),对锥孔电压、碰撞能量等参数进行优化,每个化合物选择2对响应值高的特征离子对作为定量及定性离子,丙氨酸和脯氨酸没有找到合适的第2对特征离子,优化后的质谱参数见表1。
2.3 方法学评价
在优化的UPLC-MS/MS分析条件下,17种氨基酸在一定质量浓度范围内与对应的峰面积呈良好的线性关系,相关系数为0.9982~0.9999,以定量离子3倍信噪比(S/N=3)得到检出限(LOD),以定量离子10倍信噪比(S/N=10)得到定量下限(LOQ),17种氨基酸的标准曲线和相关系数见表2。
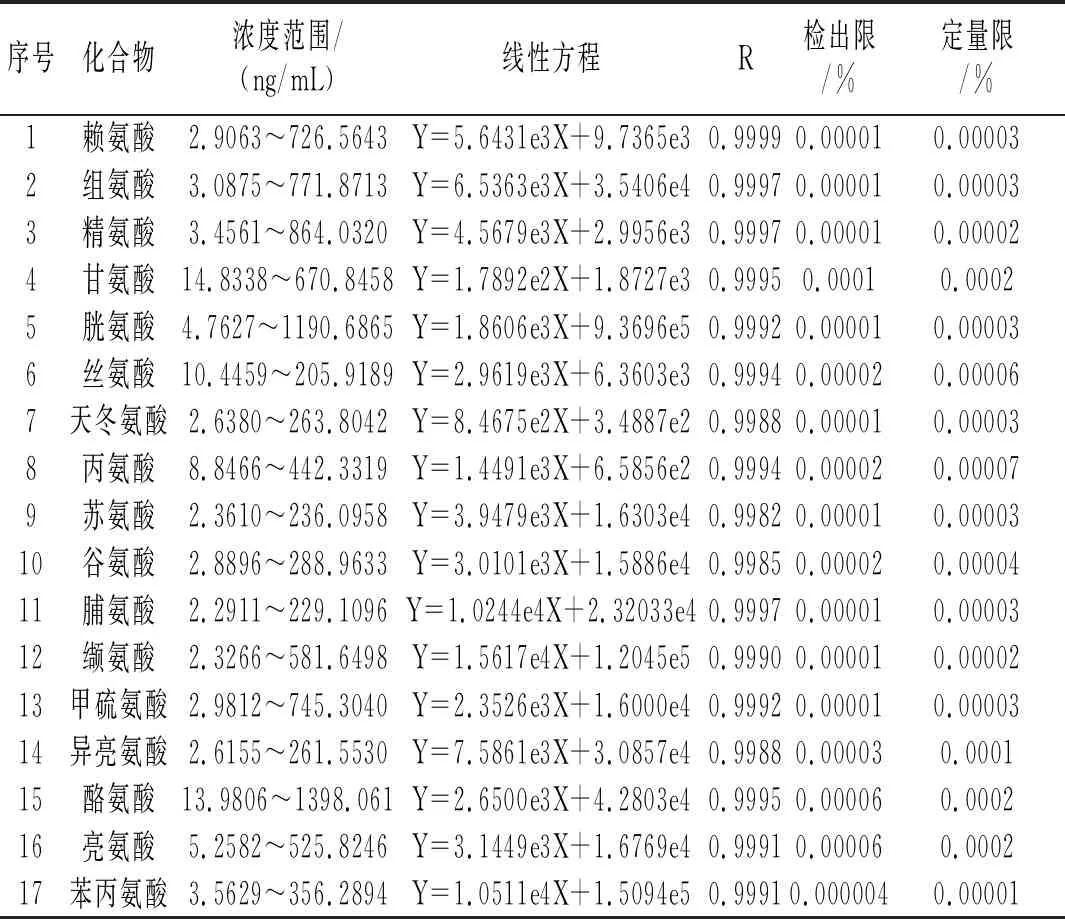
表2 17种氨基酸的线性方程、检出限和定量限
2.4 游离氨基酸和酸化后氨基酸的含量
按照1.3.1对7批次鱼酱酸样品进行处理,17种氨基酸水解总含量为0.520%~3.335%,其中胱氨酸、脯氨酸、甘氨酸和组氨酸含量低于0.03%,丙氨酸和亮氨酸含量高于0.15%。17种氨基酸酸水解总含量为1.807%~3.889%,其中氨酸、胱氨酸、酪氨酸和苏氨酸含量低于0.10%,其中一批次鱼酱酸调味料的水解和酸水解的17种氨基酸含量成分变化见图2。

图2 鱼酱酸调味料中水解和酸水解的氨基酸含量
由图2可知,酸水解后的鱼酱酸中鱼肉蛋白质转变氨基酸,其中和甘氨酸、缬氨酸和脯氨酸变化最大。
2.5 鱼酱酸中各类氨基酸的含量分布
同时,对7批次鱼酱酸调味料中17种氨基酸进行含量分析,结果见图3。
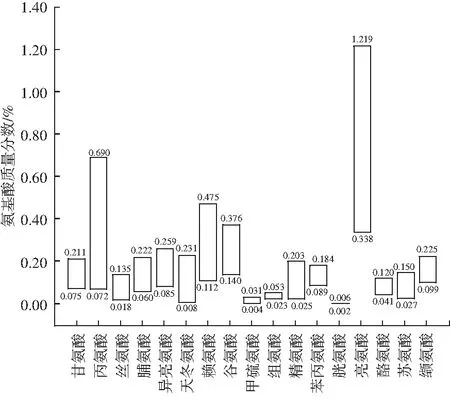
图3 鱼酱酸调味料中各氨基酸含量
由图3可知,7批次鱼酱酸调味料中亮氨酸的含量较高,质量分数为0.338%~1.219%,甘氨酸、丙氨酸、脯氨酸、异亮氨酸、天冬氨酸、赖氨酸、谷氨酸、精氨酸、酪氨酸、苏氨酸和缬氨酸的含量处于同一水平,质量分数为0.008%~0.690%,丝氨酸、甲硫氨酸、组氨酸含量处于同一水平,质量分数为0.004%~0.203%,胱氨酸含量最低,低于0.006%。
3 结论
本文采用超高效液相色谱-串联质谱法同时测定鱼酱酸调味料中17种氨基酸含量,使用两种不同的样品前处理方式对鱼酱酸调味料中氨基酸进行分析,确定了鱼酱酸调味料中17种氨基酸的含量。本方法极大缩短了分析时间,在分析复杂样品时可以获得较高的选择性和灵敏度,适用于食品中快速测定氨基酸的定性和定量分析。
