5种食用菌多糖及复配多糖对RAW264.7细胞的免疫调节作用
2021-06-11董楠李明智徐德昌陈晓敏谌淑平潘世杰王玉箫刘文婷胡婕伦钟虹光尧梅香谢明勇聂少平
董楠,李明智,徐德昌,陈晓敏,谌淑平,潘世杰,王玉箫,刘文婷,胡婕伦,钟虹光,尧梅香,谢明勇,聂少平*
(1.南昌大学食品科学与技术国家重点实验室,中加食品科学技术联合实验室(南昌),江西 南昌 330047;2.江中食疗科技有限公司,江西 九江 330000)
“药食同源”食材因具有食养特性受到广泛关注[1]。在“药食同源”食材中,食用菌因具有许多保健功能,成为食疗的瞩目对象[2]。多糖是食用菌中发挥功效的重要活性物质,其中,银耳多糖(Tremella fuciformis polysaccharide)具有抗衰老、降血糖、降血脂的作用[3-4];茯苓多糖(Poria cocos polysaccharide)具有抗氧化、抗炎、抗肿瘤等作用[5];香菇多糖(lentinan)具有抗氧化、抗病毒、抗炎性损伤等作用,被广泛应用于临床辅助治疗肿瘤[6];猴头菇多糖(Hericium erinaceus polysaccharide)具有改善胃肠道功能、抗肿瘤、抗衰老、降血脂等生理功能[7]。竹荪多糖(Dictyophora indusiata polysaccharide)在抗炎[8]、抗氧化[9-10]、抗肿瘤[11-14]等方面都有一定的效果。机体的免疫调节活性与这些生理功能息息相关,这是因为免疫系统的正常运行与否与机体各种生理和病理功能密切相关,例如炎症、癌症和肿瘤等的发生皆是机体免疫系统紊乱的结果[15]。然而,由于多糖的结构复杂,不同来源的多糖对不同类型免疫细胞的刺激程度可能有所差别。因此,通过调节不同来源多糖的配比,复配多糖将能发挥出更显著的免疫调节作用[16]。
机体免疫系统包括特异性免疫和非特异性免疫,巨噬细胞在其中起到桥梁连接作用,生理功能广泛。因此,巨噬细胞在机体免疫系统中占据重要地位。当抗原入侵人体时,作为重要防御之一的巨噬细胞释放的免疫介质发挥重要作用。同理,当人体受到机械损伤或病理刺激时,巨噬细胞被激活,吞噬能力增强,并分泌各种细胞因子[17-21]。因此,若要对某一功能成分进行免疫调节作用体外研究,小鼠巨噬细胞RAW264.7是理想模型。本试验以RAW264.7细胞为研究对象,构建非炎症模型,脂多糖(lipopolysaccharides,LPS)为阳性对照,银耳多糖、茯苓多糖、香菇多糖、猴头菇多糖、竹荪多糖及其复配多糖为样品对照,探究这5种多糖及复配多糖对巨噬细胞的细胞活力、吞噬能力、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)分泌水平的影响,评价这5种多糖及复配多糖的免疫调节活性,以期为后续进一步的深入研究及产品研发提供数据支持。
1 材料与方法
1.1 材料与试剂
银耳多糖、猴头菇多糖:江中食疗科技有限公司哆糖君研究组提供;茯苓多糖、香菇多糖、竹荪多糖:南昌大学食品科学与技术国家重点实验室制备。
小鼠巨噬细胞系RAW264.7:中国科学院上海生命科学研究院细胞资源中心;DMEM(Dulbecco's modified Eagle Medium)培养基:中国北京Solarbio公司;胎牛血清:Biological Industries公司;脂多糖(lipopolysaccharide,LPS):中国上海碧云天生物技术有限公司;FITC-葡聚糖(FITC-Dextran):美国 Sigma公司;细胞计数试剂盒(Cell Counting Kit-8,CCK-8):日本同仁化学研究所;小鼠TNF-α ELISA试剂盒:中国武汉博士德生物工程有限公司。
1.2 仪器与设备
3110 Series II细胞培养箱、Varioskan Flash多功能酶标仪:美国Thermo公司;ZDX-35B高压灭菌锅:上海申安医疗器械厂 ;CKX41倒置显微镜:日本Olympus公司;3K15冷冻离心机:德国Sigma公司;Milli-Q50超纯水净化系统:Millipore公司;CytoFLEX S流式细胞仪:美国Beckman Coulter公司。
1.3 方法
1.3.1 多糖及其复配多糖溶液的配制
称取一定量的银耳多糖、茯苓多糖、香菇多糖、猴头菇多糖和竹荪多糖干燥粉末,用加入了10%胎牛血清的DMEM培养基配制为质量浓度为320 μg/mL的母液;任意2种多糖母液按1∶1体积比复配成质量浓度为320 μg/mL的复配多糖培养基溶液,然后以加入了10%胎牛血清的DMEM培养基作稀释液,将多糖及复配多糖母液分别稀释为 160、80、40、20、10、5 μg/mL的溶液备用。复配方式及命名如表1所示。

表1 食用菌多糖复配方式及命名Table 1 The compounding method and naming of edible fungi polysaccharides
1.3.2 5种食用菌多糖总糖含量的测定
总糖含量利用苯酚硫酸法测定[22],稍作修改,具体操作如下:配制0.25 mg/mL的葡萄糖标准溶液,分别吸取 0.1、0.2、0.3、0.4、0.5 mL,各用水补足至 1.0 mL,加入3%苯酚0.5 mL,混匀,最后缓慢加入浓硫酸5.0 mL,混合均匀后(21±2)℃反应30 min于490 nm处测定吸光度,以1.0 mL水按同样操作作为空白,并绘制标准曲线。
各取1 mL浓度为0.1 mg/mL的多糖待测样品溶液,根据上述标准曲线的测定方法测定其吸光度,并根据标准曲线求得样品总糖含量。
1.3.3 RAW264.7细胞培养与传代
小鼠巨噬细胞系RAW264.7于DMEM完全培养基(含10%胎牛血清、100 U/mL链霉素和100 U/mL青霉素)中培养,细胞培养瓶置于37℃、5% CO2恒温培养箱中培养。当细胞铺满培养瓶底部约80%时进行传代,取对数生长期的细胞用于后续试验[23]。
1.3.4 CCK-8检测细胞活力
取对数生长期的RAW264.7细胞接种于96孔板中,接种密度为 105个/mL,每孔 100 μL,37℃培养 4 h~12 h待细胞贴壁后弃去培养液。将细胞分为正常对照组、样品组和阳性组,正常对照组加入100 μL培养基,样品组加入100 μL用培养基配制的多糖或复配多糖培养基溶液,多糖和复配多糖的浓度均为5、10、20、40、80、160、320 μg/mL,阳性组加入 100 μL、浓度为1 μg/mL的LPS培养基溶液。另设置只含培养基不含细胞的阴性对照组,培养24 h后弃去培养基,每孔加入100 μL含10% CCK-8的培养基,培养箱中培养1 h~4 h后用酶标仪在450 nm处测定吸光度。根据吸光度值,对不同浓度样品处理后RAW264.7细胞的细胞活力进行比较分析,并确定后续试验中样品的浓度范围,细胞活力用以下公式计算。
细胞活力/%=(A2-A0)/(A1-A0)×100
式中:A0为阴性对照组吸光度;A1为正常对照组吸光度;A2为样品组或阳性组吸光度。
1.3.5 TNF-α浓度测定
取对数生长期的RAW264.7细胞按每孔5×105个/mL接种于24孔板中,贴壁4 h,各组分别加入500 μL培养基或者样品培养基溶液,样品组多糖及复配多糖浓度为 5、10、20、40、80、160 μg/mL,培养 12 h 后,收集上清液进行测定[24]。TNF-α分泌水平的测定按照酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒说明书进行。
1.3.6 流式细胞仪检测吞噬能力
取对数生长期的细胞按106个/孔接种于6孔细胞培养板中,培养箱中培养4 h,分别加入不同浓度的各多糖及复配多糖(40、80、160 μg/mL)培养基溶液,同时另设置2个对照组,分别为正常对照组和LPS阳性组(1 μg/mL)。培养24 h后弃上清,将细胞用磷酸缓冲盐溶液(phosphate buffer saline,PBS)清洗 2次,然后再分别加入1 mL 1 mg/mL FITC-Dextran的PBS,37℃避光孵育1 h,用冷PBS中止反应,再用PBS清洗2次,离心,收集细胞,用0.5 mL PBS重悬,用流式细胞仪检测分析[24]。
1.4 数据处理
数据分析使用SPSS 20.0软件进行单因素方差分析,试验结果用平均值±标准差表示,且P<0.05表示数据有显著差异,P<0.01表示数据有极显著差异。
2 结果与分析
2.1 5种食用菌多糖的总糖含量
食用菌多糖总糖含量见表2。

表2 食用菌多糖总糖含量Table 2 The content of total polysaccharides in edible fungi polysaccharides
如表2所示,测得银耳多糖总糖含量为77.29%;茯苓多糖、香菇多糖、猴头菇多糖和竹荪多糖的总糖含量分别为88.77%、71.00%、92.96%和95.25%。
2.2 5种食用菌多糖单独作用于RAW264.7的免疫调节作用
2.2.1 5种食用菌多糖对RAW264.7细胞活力的影响
5种食用菌多糖对RAW264.7细胞活力的影响见图1。


图1 5种多糖对RAW264.7细胞活力影响Fig.1 Effects of five kinds of polysaccharides on RAW264.7 cell viability
巨噬细胞体外增殖能力可作为一项评价其免疫调节活性的指标[25]。如图1所示,与正常对照组相比,不同浓度的5种食用菌多糖都对RAW264.7细胞的细胞活力产生影响,且细胞活力普遍显著高于正常对照组,说明多糖促进了细胞的增殖。银耳多糖、茯苓多糖和香菇多糖在检测浓度(5 μg/mL~320 μg/mL)范围内均显著增强细胞活力,而猴头菇多糖仅在高浓度(160 μg/mL 和 320 μg/mL)时表现出促进效果,竹荪多糖在浓度为10 μg/mL~160 μg/mL范围内显著增强细胞活力,在浓度为5 μg/mL和320 μg/mL时能促进RAW264.7细胞的细胞活力,但与正常对照组无显著性差异。结果表明,在合适的浓度时,5种食用菌多糖均可显著增强RAW264.7的细胞活力,即显著增强其增殖能力,从而提高免疫调节活性。结果显示5种食用菌多糖在320 μg/mL时的细胞活力皆呈现下降趋势,推测可能是多糖刺激巨噬细胞过度活化,使其发生紊乱。综合5种食用菌多糖对RAW264.7细胞的细胞活力影响的结果,选择 5、10、20、40、80、160 μg/mL这6个剂量来检测细胞因子分泌水平情况,另外选择40、80、160 μg/mL这3个剂量来检测其吞噬能力。
2.2.2 5种食用菌多糖对RAW264.7细胞分泌的TNF-α的影响
5种多糖对TNF-α的分泌的影响见图2。


图2 5种多糖对TNF-α的分泌的影响Fig.2 Effects of five kinds of polysaccharides on levels of TNF-α
TNF-α是一种主要由巨噬细胞和淋巴细胞分泌的细胞因子,在宿主防御机制中发挥重要作用,对肿瘤具有直接溶解和抑制增殖的作用[26]。在非炎症巨噬细胞模型中,细胞因子的分泌水平可以作为评估免疫激活和调节能力的指标[27]。从图2可以看出,除了浓度为10 μg/mL和40 μg/mL的猴头菇多糖,其他浓度的各多糖刺激后,RAW264.7细胞分泌TNF-α水平明显增强。其中,银耳多糖的增强作用效果不如其他4种多糖。在5 μg/mL~80 μg/mL的浓度范围内,香菇多糖刺激后的细胞分泌TNF-α水平较稳定,且在160μg/mL时效果最好,茯苓多糖在80 μg/mL和160 μg/mL时,细胞分泌TNF-α水平仅次于160 μg/mL的香菇多糖。综合考虑多糖在不同剂量下效果,茯苓多糖和香菇多糖促进TNF-α分泌的效果最好,竹荪多糖次之,然后是猴头菇多糖和银耳多糖。
2.2.3 5种食用菌多糖对RAW264.7吞噬能力的影响
5种食用菌多糖对RAW264.7吞噬能力的影响见图3。
爱“嚼舌根”有三个原因:①被人关注的需要。“嚼舌根”的基本特征是过度分享第三者秘密。②释放压力的需要。掌握了别人秘密的人,不说出来难受,所以便采用了“嚼舌根”的方式来倾诉秘密。③亲密交往的需要。“嚼舌根”者本质上是希望获得友谊、促进关系。

图3 5种多糖对RAW264.7吞噬FITC-Dextran的影响Fig.3 Effects of five kinds of polysaccharides on phagocytosis of FITC-Dextran by RAW264.7
巨噬细胞是非特异性免疫的组成部分,可吞噬外来病原体和自身异变细胞,其吞噬能力可直接反映机体免疫功能[25]。图3表明5种食用菌多糖均极显著地增强了RAW264.7细胞的吞噬能力。茯苓多糖、香菇多糖和猴头菇多糖剂量依赖性增强RAW264.7细胞的吞噬能力,而竹荪多糖剂量依赖性减弱吞噬能力。从平均荧光强度来看,银耳多糖的增强吞噬能力效果不如其他4种多糖,香菇多糖的效果优于其他4种食用菌多糖。
2.3 复配多糖对RAW264.7的免疫调节作用
2.3.1 10种复配多糖对RAW264.7细胞活力的影响
10种复配多糖对RAW264.7细胞活力的影响见图4。

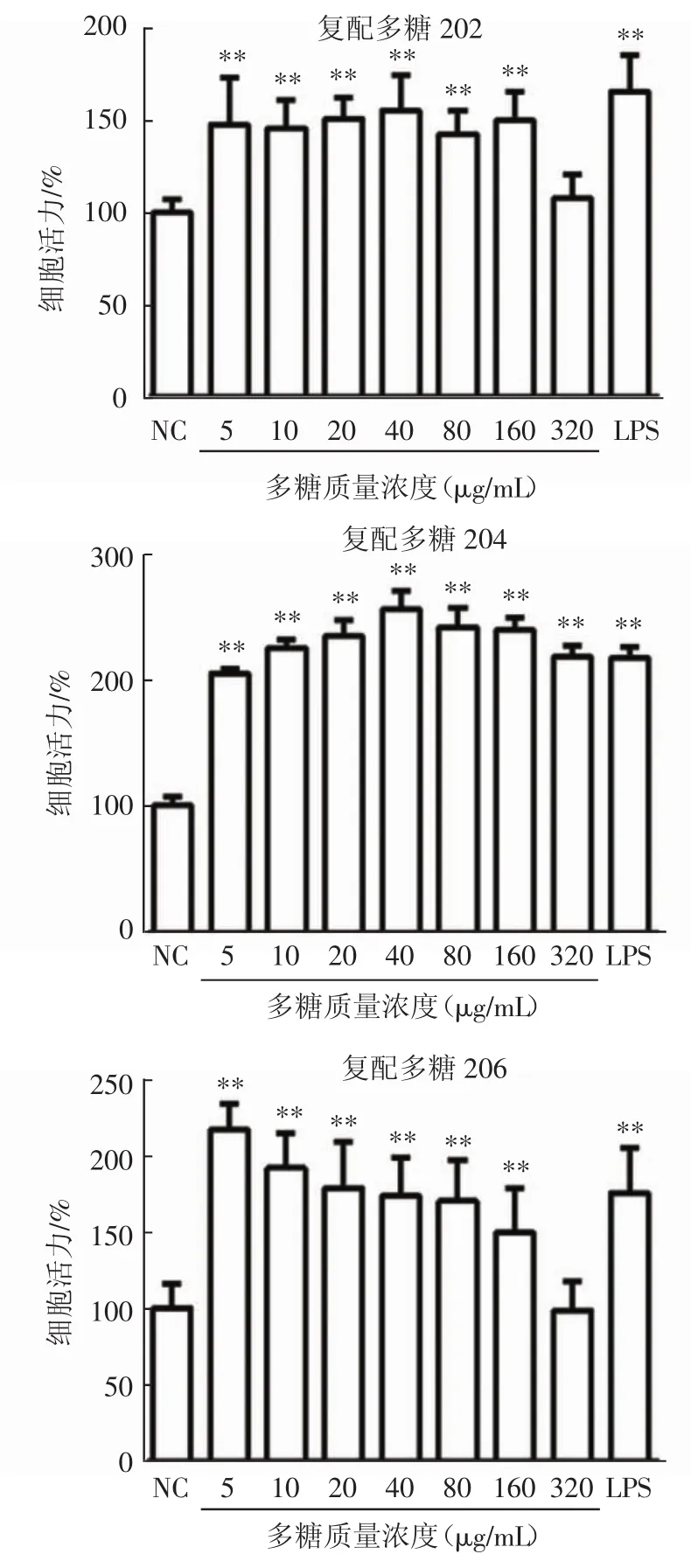

图4 不同复配食用菌多糖对RAW264.7细胞活力的影响Fig.4 The effects of different compound edible fungi polysaccharides on RAW264.7 cell viability
如图4所示,与正常对照组相比,除复配多糖201外,其余9种复配多糖在浓度为5 μg/mL~160 μg/mL皆可显著提高RAW264.7的细胞活力。促进效果较好的为银耳多糖-竹荪多糖的复配多糖204和茯苓多糖-竹荪多糖的复配多糖207,且复配多糖207在浓度为5 μg/mL时,促进细胞增殖作用最强。
复配多糖201只有在10 μg/mL时显著性增强RAW264.7的细胞活力,复配多糖203剂量依赖性显著增强RAW264.7的细胞活力,复配多糖206和209剂量依赖性减弱RAW264.7的细胞活力,除在浓度320 μg/mL时,细胞活力与正常对照组相比,没有显著性差异,其他浓度均显著性增强细胞活力。
2.3.2 10种复配多糖对RAW264.7细胞分泌的TNF-α的影响
10种复配多糖对RAW264.7细胞分泌的TNF-α的影响见表3。

表3 不同复配食用菌多糖对巨噬细胞株RAW264.7细胞因子分泌的影响Table 3 The effect of different compound polysaccharides on cytokine secretion of macrophage cell line RAW264.7
2.3.3 10种复配多糖对RAW264.7吞噬能力的影响
10种复配多糖对RAW264.7吞噬能力的影响见图5。

图5 复配多糖对RAW264.7吞噬FITC-Dextran的影响Fig.5 Effects of compound polysaccharides on phagocytosis of FITC-Dextran by RAW264.7
如图5所示,与正常对照组相比,10种复配多糖均能够显著增强巨噬细胞RAW264.7的吞噬能力。在10种复配多糖中,基于茯苓多糖和香菇多糖的复配多糖在40 μg/mL~160 μg/mL时,其吞噬效果均优于其它9种复配多糖。同时,发现效果较好是基于银耳多糖-香菇多糖的复配多糖202、基于茯苓多糖-香菇多糖的复配多糖205、基于茯苓多糖-猴头菇多糖的复配多糖206和基于茯苓多糖-竹荪多糖的复配多糖207,结合图3中5种多糖单独作用于RW264.7时对吞噬能力的增强效果,发现茯苓多糖和香菇多糖的增强吞噬能力也是更优的,说明可能还是某一类效果更好的多糖在发挥作用,后续可以进行更深入研究。
2.4 复配多糖与其组成多糖对RAW264.7的免疫调节作用的比较
2.4.1 对RAW264.7细胞分泌的TNF-α的影响的比较复配多糖与单独多糖对TNF-α的分泌的影响见图6。
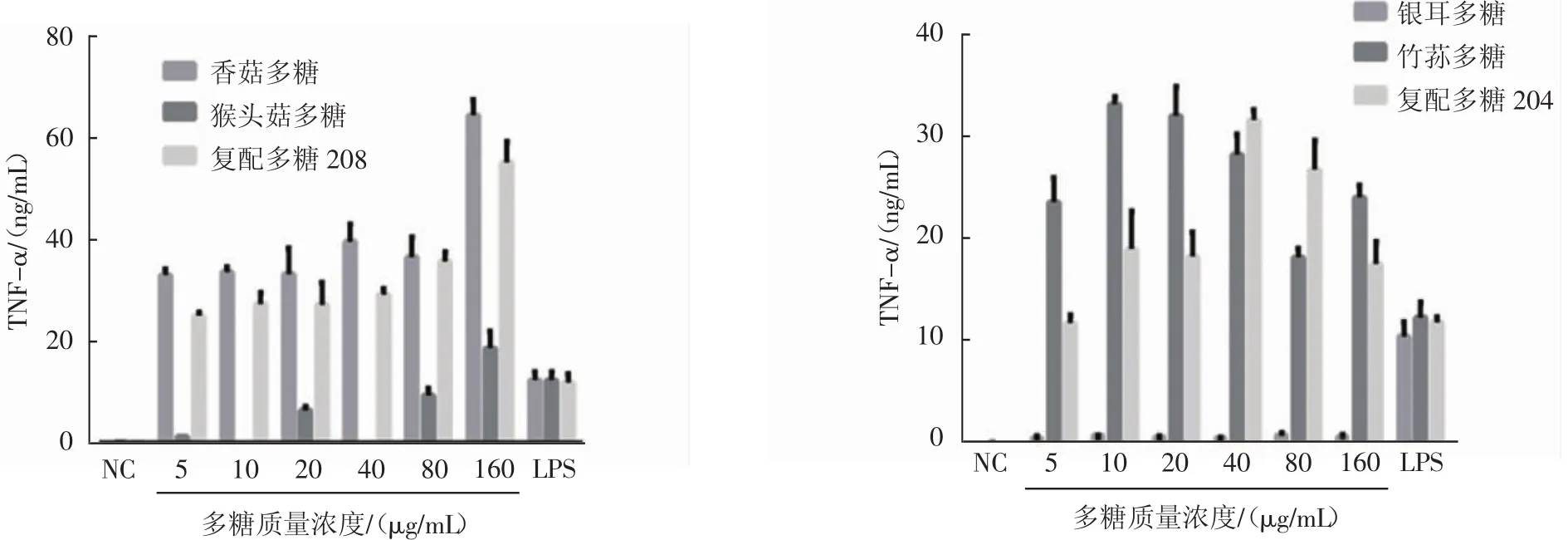
图6 复配多糖与单独多糖对TNF-α的分泌的影响Fig.6 Effects of compound polysaccharides and single polysaccharides on levels of TNF-α
由2.3.2中结果可知,复配多糖中对RAW264.7细胞提高TNF-α分泌水平影响较大的是复配多糖208,将复配多糖208及其组成多糖单独作用时对RAW264.7分泌TNF-α的影响进行比较。从图6可以得出,基于香菇多糖和猴头菇多糖复配而成的复配多糖208提高TNF-α分泌水平的效果优于猴头菇多糖,但并未优于香菇多糖。分析可能是香菇多糖单独作用时提高TNF-α分泌水平效果就已经达到最优,复配后的效果也不能超越,与2.2.2中结果香菇多糖单独作用时提高TNF-α分泌水平效果的结果一致。结合表3可知,复配多糖205、208、209的效果在10种复配多糖中表现较优,这3种复配多糖中均含香菇多糖,应该是香菇多糖在其中发挥作用。同时比较了其余9种复配多糖与其组成多糖单独作用时提高TNF-α分泌水平效果,发现复配多糖204在多糖浓度为80 μg/mL时提高TNF-α分泌水平效果优于其组成多糖银耳多糖和竹荪多糖。
2.4.2 对RAW264.7吞噬能力的影响的比较
由2.3.3中结果可知,复配多糖中对RAW264.7吞噬能力影响较大的是复配多糖205,图7展示了茯苓多糖、香菇多糖及其复配得到的复配多糖205的吞噬能力比较结果。

图7 复配多糖与单独多糖对RAW264.7吞噬FITC-Dextran的影响Fig.7 Effects of compound polysaccharides and single polysaccharides on phagocytosis of FITC-Dextran by RAW264.7
由图7可知复配多糖205对RAW264.7的吞噬能力的增强效果优于茯苓多糖和香菇多糖单独作用时的效果。由此推测,多糖间可能会存在一定相互作用,使其作用效果更好。同时,也比较其余9种复配多糖与其组成多糖单独作用时对RAW264.7细胞增强吞噬能力效果,其中复配多糖204在多糖浓度为160 μg/mL时增强效果优于单独作用时的银耳多糖和竹荪多糖。
3 结论
5种食用菌多糖单独作用及其两两复配得到的复配多糖都可通过增强细胞活力,提升吞噬能力,促进TNF-α的分泌来发挥积极的免疫调节作用。同时,10种复配多糖中,复配多糖204和复配多糖207的促进细胞增殖效果较好;复配多糖208的提高TNF-α分泌水平效果较优;复配多糖205的增强吞噬能力的效果最好,且优于其组成多糖茯苓多糖和香菇多糖单独作用时效果;复配多糖204在多糖浓度为80 μg/mL时提高TNF-α分泌水平效果优于其组成多糖银耳多糖和竹荪多糖,在多糖浓度为160 μg/mL时增强效果优于单独作用时的银耳多糖和竹荪多糖。综合以上结果,不同多糖经两两复配后,复配多糖对RAW264.7的免疫调节效果可能会优于其多糖单独作用时效果。本研究结果可为食用菌多糖的免疫调节相关功能产品开发提供新思路。
