腱糖蛋白C在脑胶质瘤中的表达及临床意义
2021-06-11王旻凯于斐魏新亭
王旻凯,于斐,魏新亭
(1.郑州大学第一附属医院 神经外科,河南 郑州 450052;2.郑州大学 公共卫生学院,河南 郑州 450001)
脑胶质瘤是中枢神经系统中最常见的恶性肿瘤,目前脑胶质瘤的治疗多在安全范围内采用最大限度手术切除结合术后放化疗,但经积极治疗后脑胶质瘤患者的预后仍不理想,特别是胶质母细胞瘤患者的平均生存期不足2 a[1-2]。研究胶质瘤发生、发展过程中关键因子水平的变化,为胶质瘤诊治提供新思路,成为了近年来的研究热点[3-4]。腱糖蛋白C(tenascin C,TNC)是一种多结构域细胞外基质糖蛋白,在神经细胞迁移和轴突发育中发挥作用,在肿瘤中可通过促进血管内皮细胞延伸、迁移等影响血管生成。TNC高表达于原发性肝细胞癌[5]、食管鳞癌[6]、乳腺癌[7]、前列腺癌[8],但TNC在脑胶质瘤中的表达特征及临床意义报道较少。本研究回顾性分析中国脑胶质瘤基因组图谱(Chinese Glioma Genome Atlas,CGGA)数据库中1 018例脑胶质瘤患者肿瘤组织及20例非胶质瘤患者正常对照脑组织的测序数据及相应临床资料,探讨TNC在脑胶质瘤中的表达特征及临床意义。
1 资料与方法
1.1 数据获取及处理从CGGA数据库纳入的 1 018例脑胶质瘤患者及20例非胶质瘤患者中,获得脑胶质瘤患者的肿瘤组织以及非胶质瘤患者正常脑组织的测序数据,并获得脑胶质瘤患者年龄、性别、世界卫生组织(World Health Organization,WHO)病理分级、组织病理学分类、异柠檬酸脱氢酶(isocitrate dehydrogenase,IDH)基因突变状态、O6-甲基鸟嘌呤DNA甲基转移酶(O6-methylguanine-DNA methyltransferase,MGMT)基因启动子甲基化状态、1p/19q染色体共缺失情况以及是否接受放化疗等临床数据及随访信息。
2 结果
2.1 TNC的表达水平从CGGA数据库中获得格式为每千个碱基转录每百万映射读取的片段数(fragments per kilobase million,FPKM)的1 018例脑胶质瘤组织及20例正常对照脑组织的TNC表达量。1 018例患者中共740例患者临床资料完整,其组织病理学诊断为少突细胞瘤84例,少突星形细胞瘤63例,星形细胞瘤291例,胶质母细胞瘤302例;病理分级Ⅱ级197例,Ⅲ级241例,Ⅳ级302例。TNC中位表达水平在胶质瘤组织和正常对照脑组织中分别为25.65和4.54,差异有统计学意义(Z=4.728,P<0.001); TNC中位表达水平在少突细胞瘤、少突星型细胞瘤、星形细胞瘤及胶质母细胞瘤中分别为10.14、7.45、23.91、52.72,差异有统计学意义(F=180.805,P<0.001);TNC中位表达水平在Ⅱ、Ⅲ、Ⅳ级胶质瘤中分别为11.41、21.51、56.19,差异有统计学意义(F=134.411,P<0.001)。
2.2 TNC表达水平与患者临床特征的关系740例临床资料完整的患者TNC表达量中位数为28.96,根据各患者胶质瘤组织中TNC表达量与中位数的关系将患者分为高表达组(370例)和低表达组(370例)。结果显示,年龄、病理分级、IDH基因突变状态、MGMT基因启动子甲基化状态均与脑胶质瘤组织TNC表达水平有关(P<0.05),性别与胶质瘤组织TNC表达水平无关(P>0.05)。见表1。
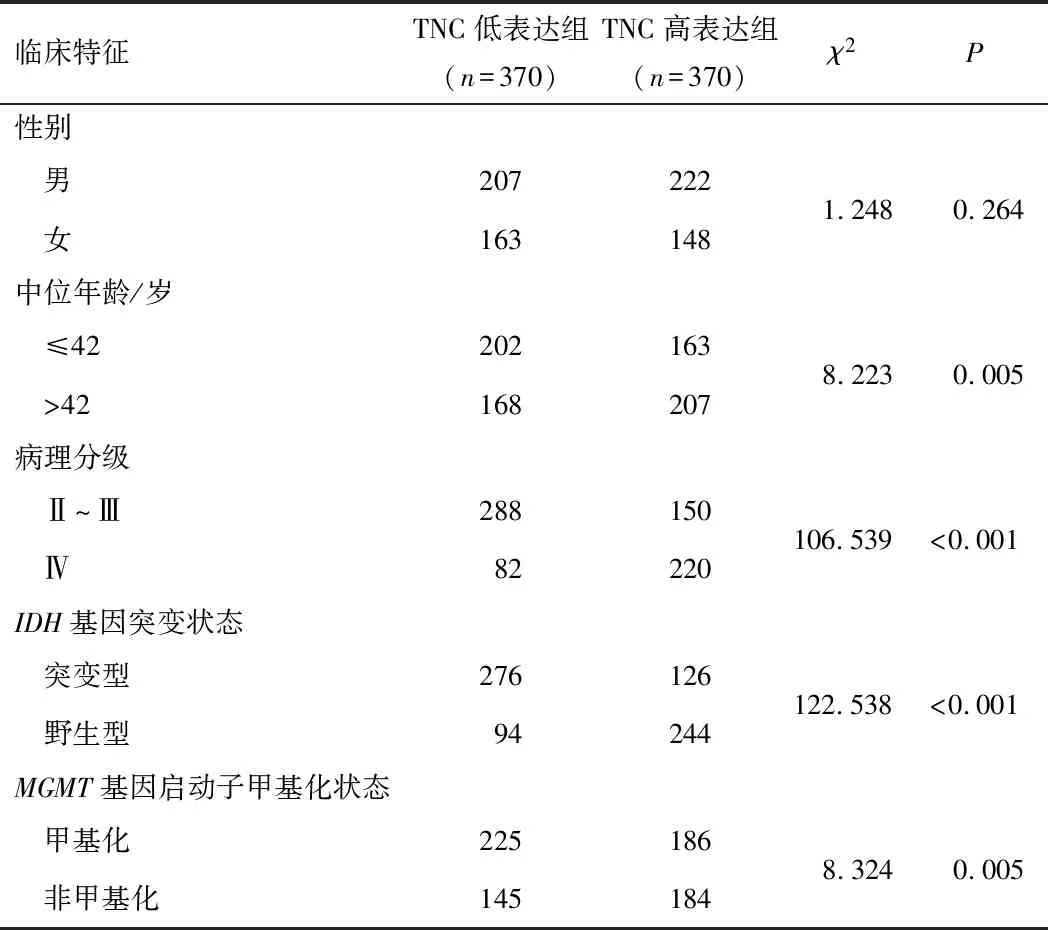
表1 TNC表达水平与患者临床特征的关系
2.3 TNC表达水平与患者生存期的关系共937例患者获得随访,在全部组织病理分级(Ⅱ~Ⅳ级)胶质瘤患者、低级别(Ⅱ~Ⅲ级)胶质瘤患者、高级别(Ⅳ级)胶质瘤患者中,TNC高表达组患者总生存期均短于TNC低表达组患者(P<0.05)。见图1、2、3。对获得随访信息且临床资料完整的686例患者进行单因素及多因素Cox回归分析结果显示,病理分级、术后化疗、1p/19q染色体共缺失和TNC表达水平是脑胶质瘤患者生存期的影响独立因素(P<0.05)。见表2、3。
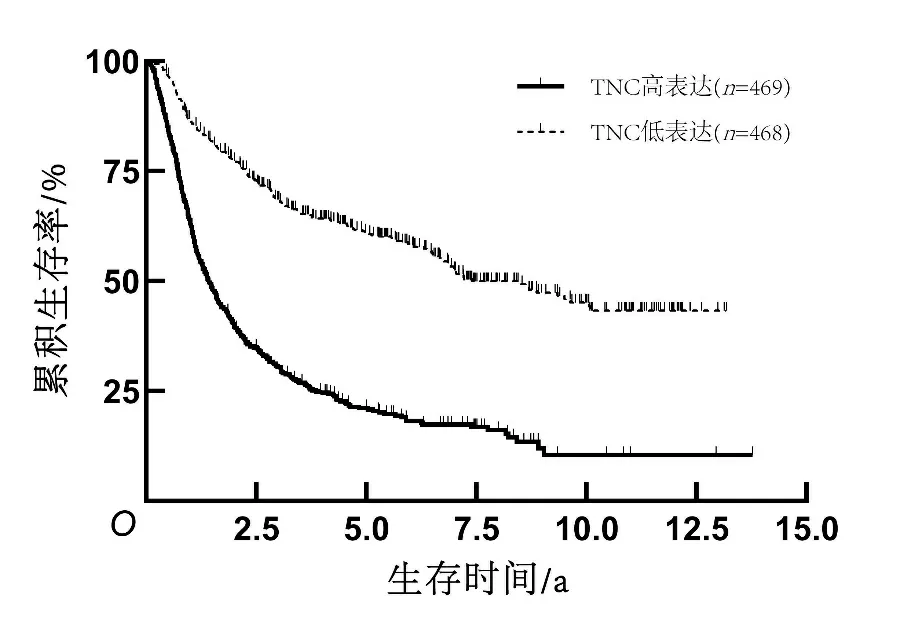
图1 Ⅱ~Ⅳ级胶质瘤患者生存曲线
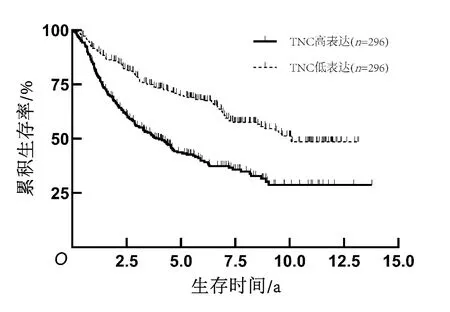
图2 Ⅱ~Ⅲ级胶质瘤患者生存曲线
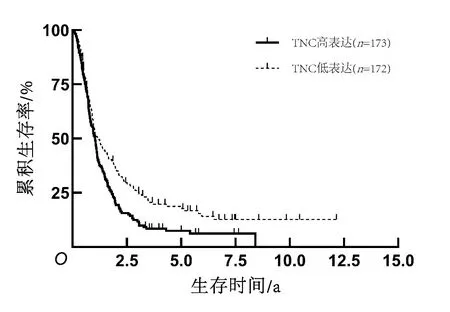
图3 Ⅳ级胶质母细胞瘤患者生存曲线
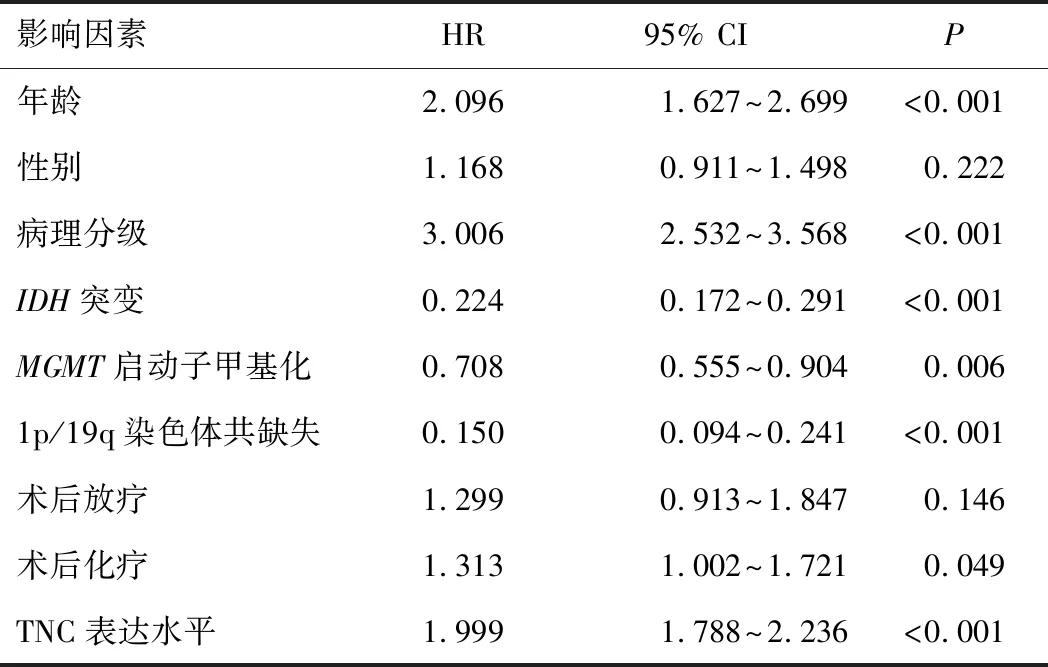
表2 影响CGGA数据库686例脑胶质瘤患者预后的 单因素Cox回归分析
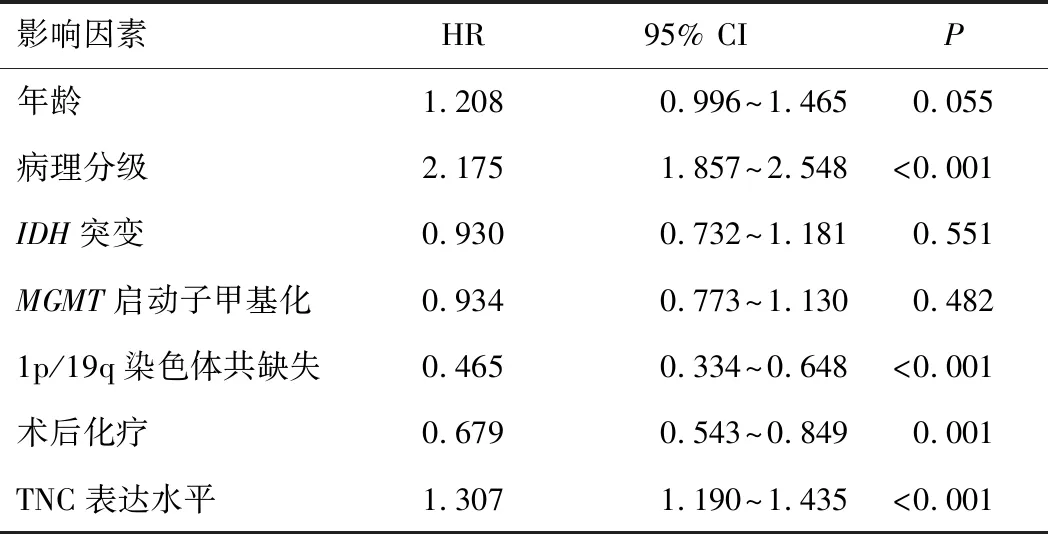
表3 影响CGGA数据库686例脑胶质瘤患者预后的 多因素Cox回归分析
3 讨论
脑胶质瘤无明确的边界,肿瘤细胞具有较高的侵袭性,经过标准治疗后大多数脑胶质瘤会在手术部位复发,且难以通过二次手术实现根治,致使脑胶质瘤患者生存期较短。中国脑胶质瘤分子诊疗指南(2014)和WHO中枢神经系统肿瘤分类(2016)已应用一些分子标志物预测胶质瘤预后和指导治疗,如IDH突变、TERT启动子突变、MGMT启动子甲基化等,染色体1p/19q联合缺失也有助于少突细胞瘤、少突星形细胞瘤的诊治。
本研究对CGGA数据库1 018例脑胶质瘤患者临床资料及转录组数据进行分析,并与20例非胶质瘤患者正常对照脑组织的转录组数据对比,发现胶质瘤组织中TNC的表达水平高于正常对照脑组织,且TNC的表达水平随着胶质瘤WHO病理分级的增高而升高。IDH基因突变多见于预后相对较好的低级别胶质瘤和继发性胶质母细胞瘤[2]。本研究结果显示,TNC在IDH突变型胶质瘤中表达水平较低,但在预后较差的IDH野生型胶质瘤中高表达。MGMT启动子甲基化可导致MGMT基因沉默,MGMT启动子甲基化的胶质瘤患者接受替莫唑胺等烷化剂药物治疗效果较好[9],本研究中TNC于烷化剂疗效较差的MGMT非甲基化患者中高表达。结合单因素及多因素Cox回归分析结果,TNC高表达的脑胶质瘤患者预后更差且肿瘤恶性程度更高,因此认为TNC表达水平在预测脑胶质瘤恶性程度及患者预后方面具有重要价值。
TNC于20世纪80年代被发现,可对肿瘤细胞的黏附、迁移、血管生成等过程产生作用。TNC可作为toll样受体4的内源性激活剂,通过影响小胶质细胞及巨噬细胞多种细胞因子的表达,促进炎症反应[10], TNC能促进肝组织中的细胞由上皮型向间质型转化并增强细胞迁移能力[5]。在食管鳞状细胞癌中,TNC通过Akt/HIF1α轴促进上皮型向间质型转化并增强癌细胞的干细胞样特征[6];在乳腺癌和前列腺癌组织中,TNC高表达与更高的临床分期及淋巴结转移相关[7-8]。TNC还可作为结肠癌的诊断标志物[11]。
使用GEPIA(http://gepia.cancer-pku.cn/)在线筛选出脑胶质瘤中与TNC表达相关系数|r|≥0.6的382个基因并使用DAVID(https://david.ncifcrf.gov)对这些基因进行京都百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)信号通路分析,发现其主要参与PI3K-Akt信号通路和NF-κB信号通路。近期有研究发现,TNC在具有高NF-κB信号活性的间质亚型胶质母细胞瘤中高表达,且TNC可以促进肿瘤细胞向肿瘤干细胞转化[12]。间质型胶质瘤在胶质瘤4种分子亚型中恶性程度最高且预后最差,而肿瘤细胞向肿瘤干细胞的转化表明了其恶性程度的增高,这都提示TNC在胶质瘤恶性进展过程中发挥重要作用。
综上,TNC在恶性程度较高的多种胶质瘤亚型中高表达,高级别和低级别胶质瘤患者中TNC基因高表达者预后均较差,提示TNC在脑胶质瘤恶性进展中发挥作用,可作为脑胶质瘤诊断标志物和预后指标,具有成为潜在治疗靶点的潜质。
