慢性鼻窦炎中与鼻息肉相关的关键炎症因子的免疫学分析
2021-06-11王奕鸿顾俊怡黄海平刘济生
王奕鸿,顾俊怡,黄海平,刘济生
(1.苏州大学附属第一医院耳鼻喉科,江苏 苏州 215006;2.苏州大学附属第一医院神经外科,江苏 苏州 215006)
慢性鼻-鼻窦炎(CRS)是一种上呼吸道炎症性疾病,累及鼻腔和副鼻窦,影响多达15%的人口[1]。它会导致一些慢性病症状包括鼻塞,面部疼痛,鼻分泌物,嗅觉下降,严重影响生活质量。慢性鼻-鼻窦炎可大致分为两大类,鼻-鼻窦炎伴息肉(CRSwNP)或慢性鼻窦炎不伴息肉(CRSsNP)。鼻息肉影响高达4%的人群,高达20%的CRS患者将在其一生中的某个阶段发展成鼻息肉。CRS的病理生理机制包括超抗原[2]、异常细胞介导的免疫反应[3]、重塑[4]、上皮缺陷[5]、窦壁骨炎[6]、病毒[7]、细菌物质[8]和真菌因子[9]。然而,尽管存在许多病因机制的理论,但病因仍不清楚。本研究通过同一患者的鼻息肉及息肉邻接区的非息肉鼻腔黏膜以及正常黏膜的免疫学比较,旨在探讨鼻息肉形成和生长的潜在病因。涉及到研究细胞因子和转录因子相关的主要的T细胞途径:Th1(T-bet)、Th2(IL-5)。此外,对细菌相关的Toll 样受体(TLR)4和细菌相关细胞因子(IL-8,IL-6)进行研究,以寻找对细菌的紊乱免疫反应的证据。
1 资料和方法
1.1 临床资料 选取共60 例受试者(30 例CRSwNP患者和30 例对照组受试者),实验组为2019年6月—2020年6月本科住院治疗的CRSwNP患者30例,其中男18 例,女12 例;年龄(46±6.7)岁,均符合关于2012年欧洲鼻-鼻窦炎和鼻息肉意见书,所有患者均经术后病理证实为炎性息肉组织。依照临床症状、体征、鼻内镜检查及术中所见,按照真菌性鼻-鼻窦炎诊断标准,排除真菌性鼻-鼻窦炎,所有患者均无哮喘病史,并排除心、肺、肝、肾等全身系统性疾病及结核、肝炎等传染性疾病;患者在入院前1 个月内未全身使用糖皮质激素。对照组为2019年1月—2020年6月在我院神经外科接受内镜下经蝶窦垂体切除术,没有鼻窦炎的临床病史或放射学证据的患者。其中男17 例,女13 例;年龄(54±8.9)岁,均无变应性疾病史。
1.2 三组鼻黏膜组织中IL-5、T-bet、TLR-4、IL-8和IL-6 mRNA表达的检测 共收集了三种类型的组织,取自CRSwNP患者中鼻道的鼻息肉和邻近的非息肉样鼻窦黏膜以及对照组患者中鼻道的鼻窦黏膜,组织大小约3 mm3,将组织标本置于RNA样本保存液中,在液氮中快速冷冻并在-80 ℃下实时储存。定期将收集的组织研磨后,用细胞裂解液裂解,利用TRIzol 总RNA提取试剂盒(美国Invitrogen公司)提取总RNA。所有提取的RNA进行质量检测并将其浓度调至同一水平,用逆转录试剂盒(苏州吉玛基因)将总RNA逆转录为第一模板链cDNA,并置于-80 ℃保存,为行定量聚合酶链反应(RT-qPCR)。以cDNA为模板用PCR试剂盒在PCR仪上进行RT-qPCR检测,引物序列由吉玛基因(苏州)股份有限公司设计合成,IL-5引物序列:5'ATGAGGATGCTTCTGCATTTG,3'T C A A C T T T C T A T T A T C C A C T C G G T G T T C A T T A C;T-b e t引物序列:5'CAGAATTCTCGACGGCTACGGGAAGGTG,3'G A G G AT C C C AT G T C AT C T G C T C A G T T G G G A A A A T;T L R 4引物序列:5'T G T C C T C C C A C T C C A G G TA A G T,3'GATTGCTCAGACCTGGCAGTT;IL-6引物序列:5'ATGAACTCCTTCTCCACAAGC,3'CTACA TTTGCCGAAGAGCCCTCAGGCTGGACTG;IL-8引物序列:5'ATGACTTCCAAGCTGGCCGTG,3'TTATGAATTCTCAGCCCTCTTCAAAAACTTC TC。PCR放大方案包括95 ℃ 2 min,95 ℃ 15 s共40次循环,60 ℃ 1 min,然后进行溶解曲线分析(95℃ 15 s,60 ℃ 15 s,95 ℃ 15 s)。反应结束后,采用2-△△CT方法分析各炎症因子的相对表达量。每个样本每个基因三次重复。
1.3 统计学方法 使用Graph Pad Prism 8.0软件,采用Wilcoxon检验进行统计分析,P<0.05为差异有统计学意义。
2 结果
实验结果表明,与对照组相比,鼻息肉和非息肉状鼻腔黏膜中存在Th2介导的促炎症反应(图1A和1B),IL-5基因表达上调,T-bet表达下调。IL-5 mRNA在鼻息肉中的表达量为(5.90±1.94),在非息肉状鼻腔黏膜中的表达量为(6.21±1.95),在对照组黏膜中的表达量为(1.64±0.38)。T-bet mRNA在鼻息肉中的表达量为(0.30±0.12),在非息肉状鼻腔黏膜中的表达量为(0.32±0.12),在对照组黏膜中的表达量为(1.27±0.04)。与对照组相比,鼻息肉和非息肉状鼻腔黏膜中IL-6基因表达均显著下调(图1C),IL-6 mRNA在鼻息肉中的表达量为(0.27±0.21),在非息肉状鼻腔黏膜中的表达量为(0.23±0.12),在对照组黏膜中的表达量为(1.03±0.09)。与对照组相比,IL-8和TLR-4在鼻息肉和非息肉状鼻窦黏膜中显著上调(图1D和1E),IL-8 mRNA在鼻息肉中的表达量为(4.03±2.09),在非息肉状鼻腔黏膜中的表达量为(4.25±1.63),在对照组黏膜中的表达量为(1.35±0.23)。TLR-4 mRNA在鼻息肉中的表达量为(6.12±3.02),在非息肉状鼻腔黏膜中的表达量为(7.64±4.48),在对照组黏膜中的表达量为(1.66±0.29)。鼻息肉和非息肉状鼻腔黏膜分别与对照组相比,差异具有统计学意义(P<0.05)。鼻息肉和非息肉状鼻腔黏膜相比,差异无统计学意义(P>0.05)。
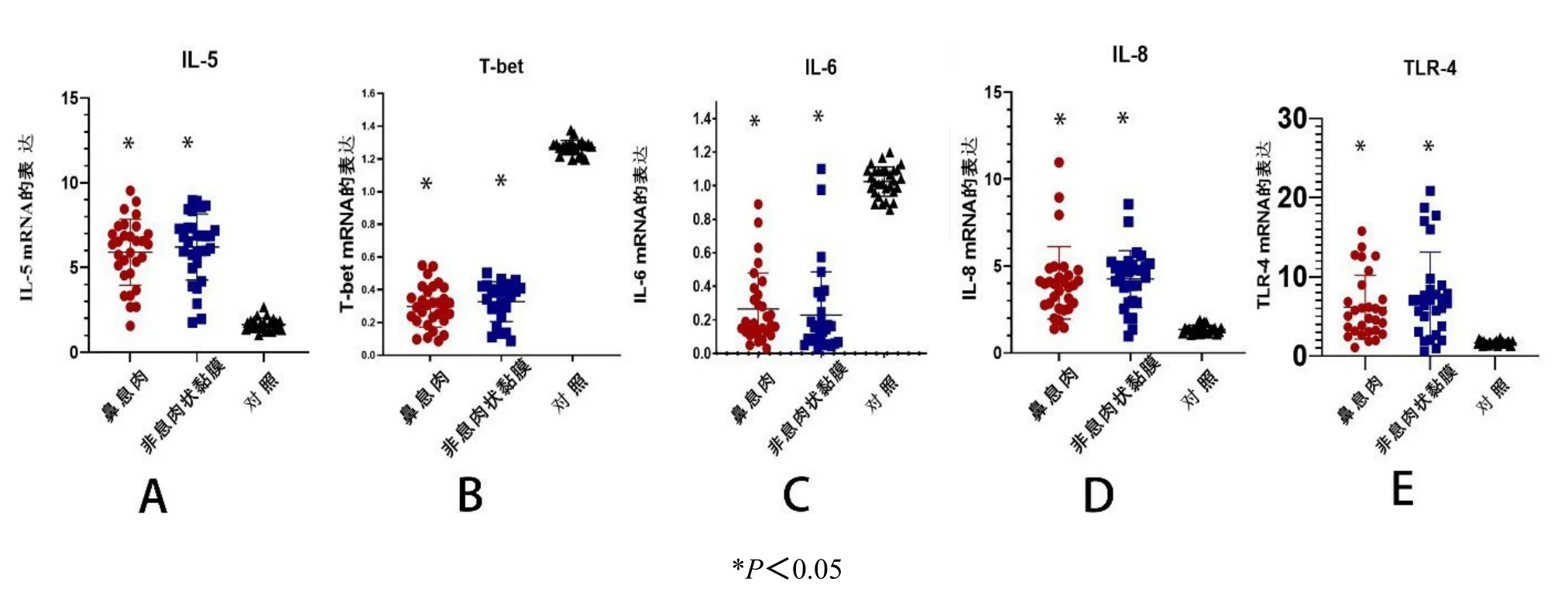
图1 RT-qPCR检测IL-5(A)、T-bet(B)、IL-6(C)、IL-8(D)和 TLR-4(E)在鼻腔黏膜组织样本中的标准化相对基因表达率
3 讨论
本研究旨在探讨鼻息肉形成和生长的潜在病因,之前有一些研究[10-11]主要使用流式细胞仪检查了CRSwNP组织中关键免疫细胞的细胞特征,从而确定了活跃的Th2促炎反应。本研究通过RT-qPCR检测组织中炎症因子的RNA的表达水平,侧重于基因表达水平的研究,有一些新的发现,对以前的研究提供一些补充。本研究的实验结果再次证实鼻息肉和非息肉状鼻腔黏膜中存在Th2介导的促炎症反应。另外,和肉眼观察到的外观不同,CRSwNP患者的非息肉状鼻窦黏膜和鼻息肉组织显示出惊人的相似免疫特征。实验的结果表明,非息肉状鼻窦黏膜与鼻息肉相比,促炎症基因表达水平差异无统计学意义,这可能会帮助解释为什么一些CRS患者表面上正常的非息肉状鼻腔黏膜随着时间的推移会发展为肉眼可见的鼻息肉。这些区域的黏膜需要术后使用局部类固醇激素来减少转化为鼻息肉及预防术后复发。
IL-6基因参与吞噬细胞活化和感染的急性期反应,在免疫介导的细菌清除中起重要作用。IL-6在鼻息肉和非息肉状鼻腔黏膜表达下调,可导致对病毒、寄生虫和细菌感染的免疫力受损[12]。IL-8是一种促炎症性细胞因子,对中性粒细胞和肥大细胞有强烈的趋化作用,把它们吸引到感染部位。TLR在细菌的免疫应答系统中起重要作用,识别微生物表面的病原体相关分子模式(PAMPs)并激活对它们的先天免疫反应。TLR4作为重要的受体家族成员,可识别革兰阴性菌胞壁成分脂多糖的主要受体,参与炎症反应[13]。结合IL-8和TLR-4的鼻息肉和非息肉状鼻腔黏膜表达上调,这些结果表明细菌相关细胞因子和TLR上调参与细菌的发现和防御细胞类型的募集。这可能代表细菌通过招募细胞(如肥大细胞)来破坏局部免疫反应的机制使它们能够寄生,逃避免疫系统从而提高了它们的生存能力。
通过对鼻息肉病因研究,我们对其有了更多的认识,将有助于发展针对其形成和生长为目标的新的治疗策略,从而减少对抗生素、皮质类固醇激素的依赖以及手术切除的需求。具体的策略包括有靶向细胞内细菌的策略,或免疫治疗,如抗IL-5单抗[14],目的是调节强极化的T细胞反应。
