纳米银对小麦秸秆还田土壤中酶活性及微生物群落功能多样性的影响
2021-06-10曹鑫磊姜浩杨宝山焦克芹王惠
曹鑫磊,姜浩,2,杨宝山,焦克芹,王惠*
(1.济南大学 水利与环境学院,山东 济南 250022;2.山东省生态环境规划研究院,山东 济南 250101)
纳米银(AgNPs)作为使用广泛的纳米材料之一,因其优良的抑菌性能而被广泛应用于纺织品、个人护理品、医疗器械、食品包装材料等各类产品中[1-2]。据统计,全球AgNPs用量占纳米材料总用量的50%[3],每年超过400 t的AgNPs被用于各种行业。AgNPs可通过多种途径(污泥回田、喷洒杀虫剂、污水灌溉等)进入农田土壤中,在欧美国家约有60%包含人工纳米材料的污泥通过农业施肥进入农田,长期施用这些污泥必然导致农田土壤中人工纳米材料的积累[4]。而作为一种新型污染物,AgNPs在土壤中的积累可改变土壤的pH、有机碳含量及矿质氮的含量[5],并且释放到环境中的AgNPs可通过微生物对环境营养循环过程产生影响,进而影响生态系统的稳定性[6]。AgNPs对微生物的抑制作用主要归因于其释放的Ag+及其诱导产生的活性氧自由基所引发的蛋白失活、细胞膜破损、能量代谢受阻、DNA损伤等毒理效应。但在实际环境暴露过程中,AgNPs易受到天然有机物质、pH、溶解氧、阴/阳离子、光照等环境因素以及自身形貌、表面包埋剂等理化性质的影响,导致其出现溶解、团聚、沉淀等赋存状态的改变,进而影响其微生物毒性[7]。因此,AgNPs在土壤中的积累与迁移转化及其对土壤微生物的毒性影响已引起国内外学者的普遍关注。
土壤呼吸作用和酶活性作为土壤毒理学研究的重要参考指标,可以快速指示土壤系统中微生物活性和功能的变化趋势。Shin等[8]发现,不同浓度的AgNPs处理土壤后,6种土壤酶(脱氢酶、FDA水解酶、脲酶、酸性磷酸酶、芳基硫酸酯酶和β-葡萄糖苷酶)活性均受到不同程度的抑制。Rahmatpour等[9]和王秋双等[10]研究表明,中高浓度的AgNPs显著抑制了土壤的呼吸作用。有关AgNPs对土壤微生物影响的研究指出,AgNPs可以显著抑制土壤微生物的生长,改变土壤细菌和真菌的群落组成,并降低土壤微生物的多样性[10-14]。Grün等[15]研究发现AgNPs对土壤中氨氧化菌和固氮菌会产生长期抑制作用,进而对土壤氮的循环过程造成不利影响。Samarajeewa等[12]和Sillen等[14]通过研究发现AgNPs会造成微生物活性和多样性下降,导致微生物对不同碳源的利用效率下降。而且AgNPs对土壤微生物的作用也受其浓度、粒径大小以及土壤性质的影响[16]。
最新的研究发现,土壤中添加有机改良剂可使土壤中腐殖酸含量升高,导致AgNPs对土壤微生物生物量的抑制作用增强[17]。而秸秆还田作为一种常见的农业土壤改良措施,能提高土壤肥力、增加土壤腐殖酸含量,使土壤性质发生改变[18-19]。考虑到AgNPs对土壤微生物的作用会随着秸秆还田对土壤性质的改变而发生变化,因此,探讨其如何影响秸秆还田土壤中的土壤酶活性及微生物群落功能多样性,对AgNPs的毒性管理具有重要意义。
基于此,本文采用室内模拟培养实验,研究AgNPs对秸秆还田农田土壤中碳循环相关生态过程及微生物群落功能多样性的影响。通过测试土壤呼吸作用,观察纤维素酶、多酚氧化酶、过氧化物酶活性及微生物群落功能多样性的变化,为AgNPs毒性影响评价提供基础数据和实践参考,丰富AgNPs对土壤微生物影响的基础理论。
1 材料与方法
1.1 材料
1.1.1 供试材料
AGS-WM1000 AgNPs溶液(上海沪正纳米科技有限公司),黄褐色液体,平均粒径<15 nm,银纯度为99.99%,溶液pH (7.0 ± 0.5)。采集济南地区小麦收割后的秸秆,带回实验室风干,粉碎并过2 mm筛网。实验所使用的药品纯度均为分析纯(国药集团化学试剂有限公司)。
UV-5200紫外可见分光光度计(上海元析);HBS-1096A Biolog Eco微孔板吸光值测定使用酶标仪(南京德铁)。
1.1.2 土壤采集
土壤样品采集自山东省济南市长清区冬小麦-夏玉米轮作的农田,取样深度为0~20 cm。使用容重盒采集土壤计算含水率及田间最大持水量,土壤样品采集完成后迅速带回实验室,除去可见的植物根系、有机碎屑和石块等杂质,充分混匀后过2 mm筛网,取样测定土壤基础理化性质,见表1。

表1 土壤理化性质
1.2 样品制备
过筛混匀后的土壤在(25±3) ℃,黑暗条件下预培养2周以稳定微生物活性。2周后添加小麦秸秆和AgNPs。实验样品设置为空白对照组(无添加,CK)、土壤+小麦秸秆组(SW)、土壤+小麦秸秆+AgNPs组(AgSW),供试土壤中小麦秸秆的添加量为5 g/kg[20],AgNPs添加量为100 mg/kg[10,12,14],调节土壤含水量至田间最大持水量的45%,每种实验组设置3份。每份试样中装有相当于1 kg干重的土壤。
1.3 指标测定
1.3.1 土壤呼吸作用测定
通过检测土壤呼吸速率与CO2累积释放量来检测人工化学材料对土壤生物学活动的影响,已被广泛应用于土壤污染的研究中[10]。
将3种处理的土壤(50 g干重)分装于广口瓶底部,保持土壤含水量为田间最大持水量的45%,放入装有20 mL NaOH溶液(0.1 mol/L)的烧杯,旋紧瓶塞,用真空硅脂密封。广口瓶置于(25±3)℃,黑暗条件的温室中培养28 d,分别在第2、4、7、14、21、28 d取出NaOH溶液,用0.05 mol/L HCl进行反滴定,计算CO2释放量和释放速率,每次取样后重新补充NaOH溶液[21]。
1.3.2 土壤酶活性测定
土壤微生物和土壤酶是影响土壤有机质分解和腐殖质形成的重要调节剂,土壤微生物为了满足其生长过程中对碳的需求,会分泌大量具有碳转化功能的酶来分解秸秆中的碳水化合物[22]。酶活性的变化可用来表征微生物对AgNPs的响应程度。
本文对土壤中的过氧化物酶、多酚氧化酶及纤维素酶活性进行测定。土壤过氧化物酶能氧化土壤有机质,其在土壤腐殖质形成过程中具有重要作用[23]。多酚氧化酶能够把土壤腐殖质组分中芳香族化合物氧化成醌,醌与土壤中蛋白质、氨基酸、矿物等物质反应生成有机质,完成土壤芳香族化合物循环,促进土壤有机碳的累积及土壤腐殖化进程[23]。纤维素酶分解纤维素形成纤维二糖,最后形成葡萄糖,是外源有机质进入土壤碳循环的重要过程[24]。
3种处理的土壤在(25±3) ℃,黑暗条件下培养28 d,并于实验的第1、7、28 d取样测定土壤过氧化物酶、多酚氧化酶及纤维素酶活性。土壤多酚氧化酶和过氧化物酶活性采用邻苯三酚比色法测定,其活性以2 h后1 g土壤中紫色没食子素的质量表示。纤维素酶活性采用硝基水杨酸比色法测定,以72 h内10 g土壤生成葡萄糖的质量表示[24]。
1.3.3 微生物群落水平生理分析
微生物是土壤物质循环及能量流动的主要参与者。因此,研究AgNPs对土壤微生物群落功能变化的影响,对于了解AgNPs对土壤生态系统结构和功能的影响具有十分重要的意义。本研究采用微生物群落水平生理分析(microbial community level physiological profiling,CLPP)探究了AgNPs对土壤微生物群落功能多样性的影响。
使用Biolog Eco微孔板,每块微孔板有96个孔,包含有3种处理的试样,每种实验组有32孔(包括1个对照组孔和31个单一碳源孔),除对照组孔仅有水与指示剂以外,其余31孔均装有单一碳源和四唑氮蓝染料。微生物利用单一碳源进行代谢发生氧化还原反应,使四唑氮蓝染料变成紫色,根据每孔颜色变化程度可检测微生物的代谢能力。每个混合土样称取相当于10 g烘干质量的新鲜土,加入含90 mL 0.85% NaCl无菌溶液的三角瓶中,封口后在摇床上震荡(200 r/min)30 min,按10倍稀释法用0.85% NaCl无菌溶液将其稀释至原来的1/1000,稀释液经离心去除土壤后,上清液用于接种。接种悬浮液于Biolog Eco微孔板中,每孔150 μL,置于25 ℃暗箱培养,连续培养240 h,期间每24 h用酶标仪在590 nm处读取吸光值。
土壤微生物群落Biolog Eco微孔板在培育过程中的整体变化过程使用平均孔颜色变化率(average well color development,AWCD)表示,其计算方法如式(1)[25-26]:
(1)
式中,I为平均孔颜色变化率;C为各反应孔的吸光值,R为对照孔的吸光值。
采用Biolog Eco微孔板培养120 h的数据进行统计分析,采用Shannon-Weiner多样性指数(香农指数)H表征土壤微生物群落多样性,其计算如式(2)[25-26]:
(2)

丰富度指被微生物群落利用的基质的数量,若微孔的光密度值(O)大于0.25,则认为是阳性值,并计入微生物群落的丰富度S(即此类光密度值大于0.25的微孔个数总和)计算如式(3)[25-26]:
S=Oi≥0.25。
(3)
2 结果与分析
2.1 AgNPs对土壤呼吸的影响
本实验利用土壤CO2释放速率和总释放量表征AgNPs对土壤微生物活性的影响,如图1所示。结果表明AgNPs处理对土壤呼吸速率与CO2总释放量产生抑制作用,表明100 mg/kg AgNPs可使土壤微生物活性降低。从第7 d开始,SW处理组的土壤呼吸速率均显著高于CK处理组,这表明添加小麦秸秆增强了土壤的呼吸作用,第21 d两者CO2释放速率差值最大,SW组相比于CK组提升了9.9%。而与SW处理组相比,添加AgNPs显著降低了土壤CO2释放速率,这表明AgNPs抑制了土壤呼吸过程,且这种抑制作用在CO2总释放量中体现更加明显。在整个实验周期内,AgSW处理组中CO2释放总量相比于SW处理组降低了36.8%(图1(b))。

图1 AgNPs对秸秆还田土壤呼吸作用的影响Fig.1 Effect of AgNPs on respiration in wheat-straw-returned soil
Samarajeewa等[12]研究了AgNPs对沙壤土微生物呼吸作用的影响,发现AgNPs(> 49 mg/kg)抑制了土壤呼吸作用。Rahmatpour等[27]研究发现,当土壤中AgNPs含量较高(> 20 mg/kg)时,土壤呼吸作用也被明显抑制,且剂量越高抑制作用越大,这些结果与本实验结果一致。AgNPs对土壤呼吸的抑制作用可能归因于AgNPs对微生物酶促过程、细胞功能和细胞核形成的负面影响[28-29]。土壤微生物可能表现出代谢功能障碍或者群落改变,导致微生物的繁殖降低、活性下降、呼吸作用减弱[30]。
2.2 AgNPs对土壤酶活性的影响
在添加小麦秸秆和AgNPs的条件下,土壤中过氧化物酶、多酚氧化酶及纤维素酶活性产生了不同的变化(图2)。
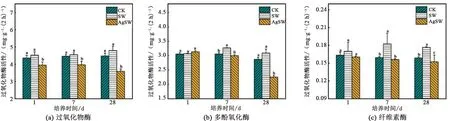
注:a、b、c表示< 0.05水平的显著性,字母不同表示显著。图2 AgNPs对秸秆还田土壤中过氧化物酶、多酚氧化酶及纤维素酶活性的影响Fig.2 Effect of AgNPs on peroxidase, polyphenol oxidase, and cellulase activities in wheat-straw-returned soil
SW处理中,由于添加了小麦秸秆,3种土壤酶活性均出现了不同程度的升高,其中纤维素酶活性受到的影响最大。相比于CK组,培养第7 d、第28 d,SW处理组的纤维素酶均显著升高(图2(c))。多酚氧化酶仅在第7 d受小麦秸秆影响活性显著升高(图2(b)),而在第1 d和28 d SW处理中,其活性虽有所升高但并未达到统计学显著水平。过氧化物酶在3个取样点的SW处理组中升高程度均未达到显著水平。
AgSW处理组3种碳转化酶的活性均较低,其中过氧化物酶对AgNPs影响最为敏感。实验第1 d和第28 d,AgSW处理组的过氧化物酶活性相比SW组显著降低了12.7%和25.1%(图2(a)),这表明过氧化物酶对AgNPs较敏感,且AgNPs可以在短时间内对土壤有机质的氧化过程产生抑制,进而可能对土壤腐殖质形成过程产生负面影响。AgNPs对多酚氧化酶的影响出现在第7 d以后,酶活性相较于SW组,在第7 d和第28 d分别降低了8.0%和27.1%(图2(b))。过氧化物酶和多酚氧化酶活性变化表明,AgNPs可抑制土壤有机质转化和腐殖质的形成。纤维素酶活性受AgNPs的影响最小,在3个取样时间点相较于SW组,活性分别降低了5.6%、14.3%和13.7%(图2(c))。而纤维素酶活性的结果也表明AgNPs对纤维素分解过程产生了抑制。
Shin等[8]发现,在短期AgNPs暴露实验中,不同浓度的AgNPs处理土壤后,参与土壤碳循环的β-葡萄糖苷酶活性受到抑制。彭程等[31]研究结果也表明,AgNPs抑制了β-葡萄糖苷酶和纤维二糖水解酶两种参与碳循环酶的活性。本研究中对3种酶的研究结果同样表明AgNPs抑制了土壤有机质转化和腐殖质形成以及纤维素的分解过程,对土壤碳循环产生了抑制作用。有关纳米金属颗粒对分子生物学影响的研究表明,AgNPs对土壤酶产生抑制作用的原因可能是AgNPs通过灭活蛋白质或阻断酶上的结合位点来抑制酶活性,也可能是由于其粒径小,易进入微生物内部产生氧化应激,导致微生物死亡从而抑制酶的产生和释放,进而对土壤中某些酶的活性产生影响[32]。
2.3 AgNPs对土壤微生物群落功能多样性的影响
平均孔颜色变化率(AWCD)的测试结果表明(图3),暴露于AgNPs的样品总是比CK组和SW组值更低。培养240 h后,与CK相比,SW处理组的AWCD增加了13.6%,AgSW处理组相比SW组则减少了73.8%。
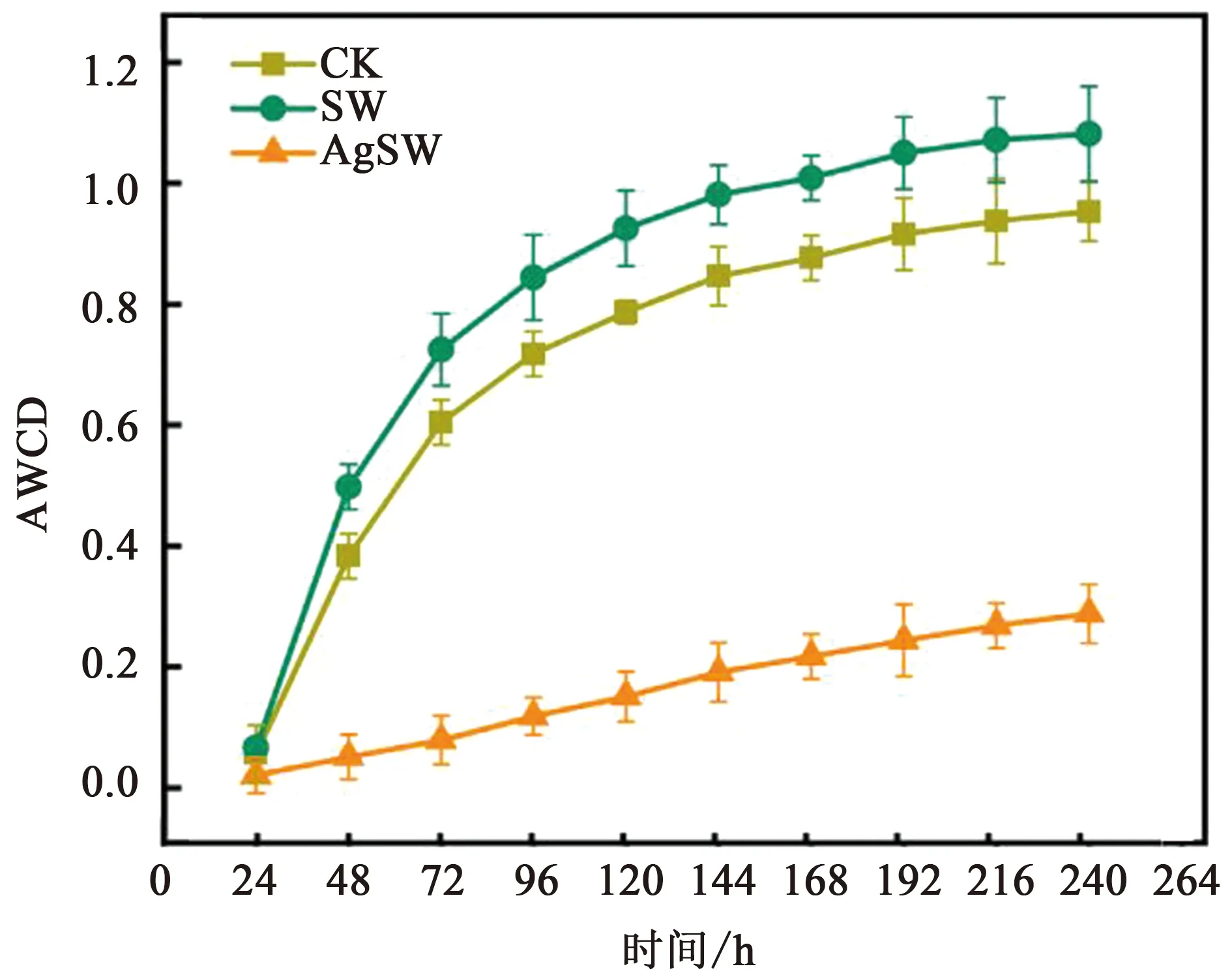
图3 3种不同处理土壤微生物群落AWCD随时间的变化Fig.3 Changes in average well color development (AWCD) of the soil microbial community under three different treatments over time
从AWCD随时间变化趋势上可以发现,AgSW处理的AWCD值增长具有明显的滞后性。而AWCD能够表征微生物群落对不同碳源的利用能力,其值增长缓慢表明AgNPs导致土壤微生物群落功能多样性发生了改变。这与Sillen等[12]的研究结果相同,其研究利用CLPP技术分析添加AgNPs后土壤中根际和非根际微生物群落的变化,发现含有AgNPs的样品相较于对照组,AWCD升高缓慢,并且培养结束时AWCD值显著低于对照组,表明AgNPs使土壤中根际和非根际微生物功能多样性(碳源利用方式)发生了变化,导致土壤微生物群落功能多样性和微生物的活性降低,这也解释了本研究AWCD的变化结果。
由表2可知,AgSW处理组与SW处理组相比,微生物香农指数和群落丰富度显著降低。虽然添加小麦秸秆使AWCD、香农指数和群落丰富度出现升高,但均未达到统计学显著水平(表2)。

表2 不同处理土壤微生物群落多样性指数
总体而言,CLPP的结果表明AgNPs使微生物多样性与群落丰富度下降,土壤微生物群落功能多样性显著降低。该结果与Samarajeewa等[12]的研究结果一致,其研究发现AgNPs在49~1815 mg/kg的浓度范围内对微生物生长、活性和多样性产生负面影响。产生负面影响的原因可能与AgNPs引起的活性氧(ROS)氧化应激有关[33],且AgNPs还可以通过与生物大分子反应或释放Ag+等有毒成分来产生抑制作用。一般认为,AgNPs可通过直接接触、诱导活性氧产生和释放毒性离子等方式,造成膜损伤、DNA损伤和细胞信号受阻,进而影响微生物活性,对微生物群落功能多样性产生影响[34]。
2.4 AgNPs对所测土壤指标影响的冗余分析
为了更加直观地表达AgNPs对土壤呼吸作用、酶活性以及微生物的影响,采用Canoco 5.0对以上指标进行了冗余分析(redundancy analysis,RDA),结果如图4所示。RDA分析显示第一和第二坐标轴累计贡献率达到96.37%,且AgNPs与所测试的土壤指标均呈现明显的负相关。受AgNPs负面影响最小的是土壤纤维素酶活性,而土壤呼吸速率、香农指数以及群落丰富度与AgNPs的负相关性最强。土壤呼吸速率、土壤酶活性均与微生物多样性和群落丰富存在正相关关系。
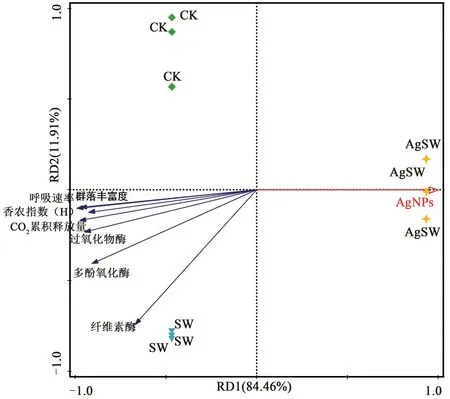
图4 AgNPs与测试指标间的冗余分析Fig.4 Comparative redundancy analysis of AgNPs and test indicators
3 结论
由于AgNPs在环境中排放持续增加,对土壤生态系统的影响必然是一个长期且复杂的过程。本研究初步阐释了100 mg/kg AgNPs短期内对秸秆还田土壤呼吸速率、土壤酶活性及微生物群落功能多样性的影响。
(1)在短期培养中AgNPs抑制秸秆还田土壤的呼吸作用,具体表现为土壤CO2释放速率降低以及累积CO2释放量减少(36.8%)。
(2)AgNPs污染土壤后,3种碳循环相关土壤酶活性出现了不同程度的降低,其中过氧化物酶活性受AgNPs影响最大,多酚氧化酶次之,而纤维素酶活性受影响最小。
(3)CLPP分析的结果显示,AgSW处理组AWCD值、香农指数及微生物群落丰富度显著降低。AgNPs减少了土壤中微生物多样性和群落丰富度,降低了微生物群落功能多样性。
虽然CLPP技术可以准确、可靠地反映和比较微生物群落对AgNPs的响应,可用于研究不同环境条件下微生物群落功能的变化,但不能全面评价土壤微生物在不同分类单元上的差异,之后需要通过更加全面的土壤微生物分析技术,例如高通量测序和土壤官能团分析技术进行更深入、更有针对性的研究。
