氧化石墨/壳聚糖复合水凝胶的制备及其对锌铅离子吸附性能的研究
2021-06-10胡章记王彦娜梁慧锋王晓楠
胡章记,王彦娜,梁慧锋,王晓楠
(1.邢台学院化学与化工学院,河北 邢台 054001;2.新疆科技学院化学化工学院,新疆 巴州 841000)
锌和铅是污染环境的主要重金属,对水体和生态系统的影响较大,是处理废水中的重金属离子的重点研究内容。吸附法具有操作简单、成本低、效果突出、无二次污染的优点,是处理废水中的锌和铅离子的重要方法[1-2]。壳聚糖(CS)具有来源广、价格低,环境友好、常温下不分解、生物易降解及抑菌作用等优良性能。将氧化石墨(GO)与壳聚糖水凝胶结合,可以赋予水凝胶许多优异性能,大大提高水凝胶的吸附性能,已成为天然高分子水处理絮凝剂的研究热点[3-5]。本文以氧化石墨和壳聚糖为原料制备水凝胶,探究溶液pH、吸附时间、吸附温度和氧化石墨含量对Zn2+和Pb2+吸附的影响以及吸附动力学模型。
1 实验部分
1. 1 仪器及试剂
XRD-6100型X射线粉末衍射仪,WQF-510型傅里叶红外变换光谱仪,TAS-990Super AFG型原子吸收分光光度计,ASAP-2460型比表面积孔径分析仪,TGA-4000型热重分析仪,VEGA TS5136XM型扫描电子显微镜,LGJ-10型冷冻干燥机,数显恒温水浴锅,超声波清洗器,低速离心机,数显恒温振荡培养箱。
石墨、双氧水(分析纯),浓硫酸、盐酸、高锰酸钾、冰乙酸(分析纯)、硝酸钾、硝酸铅(分析纯)、锌粉(优级纯)、壳聚糖(分析纯)。
1.2 实验过程
1.2.1 氧化石墨的制备
本文采用安全高产的改进Hummers法制备氧化石墨,制备过程见图1。

图1 氧化石墨(GO)制备过程
1.2.2 GO/CS水凝胶的制备
向三颈烧瓶中加入10mL去离子水,再加入一定量的氧化石墨,超声使其均匀分散。边机械搅拌边加入0.25 g壳聚糖粉末,继续搅拌使两者混合均匀。取出混合物铺到培养皿上,向密闭容器中加入少量冰醋酸,将盛有混合物的培养皿放入其中,静置12h。充分酸化后取出,用蒸馏水洗去表面的冰醋酸后,真空冷冻干燥处理。
按比例制备氧化石墨质量分数分别为1wt%、2wt%、3wt%、4wt%、5wt%、8wt%的水凝胶。
1.2.3 水凝胶的冷冻干燥
将装有水凝胶的玻璃瓶放到-40℃冷阱中冷冻60min,使其温度低于水凝胶的结晶点,再放到仪器中进行升华操作(压力低于10Pa)。
1.2.4 标准溶液配制及标准曲线的绘制
用硝酸铅按比例配制浓度为0.1、0.2、0.3、0.4、0.5 mg·L-1的铅标液,用锌粉和盐酸按比例配制浓度为2、4、6、8、10、12mg·L-1的锌标液。用原子吸收分光光度法分别测出Pb2+和Zn2+的标准曲线。
1.3 结构表征
1.3.1 红外光谱(IR)表征
将样品与光谱纯溴化钾按1∶100比例混合均匀,压成薄片,放入样品仓内,在4000cm-1~400 cm-1范围内进行IR表征。
1.3.2 X射线粉末衍射(XRD)
将干燥后的5 wt%水凝胶研成粉末,放到铝片上压平,用XRD在5°~80°范围内以10°·min-1的速度进行测试。
1.3.3 热重分析(TG)
称取制备的样品3.2590 mg,以5℃·min-1的升温速率,在0~900℃范围内进行TG分析。
1.3.4 比表面积孔径分析(BET)
测试前将样品放到110℃的烘箱中静置12h,再在160℃下抽真空处理7h后,用自动比表面积分析仪,在77 K下测试样品的氮气吸附-脱附曲线,排气温度为423K,在此条件下进行BET测定。
1.3.5 扫描电镜(SEM)
将制备的样品在液氮中浸泡一段时间,使其完全冷冻干燥,将样品击断,在干燥好的水凝胶四周贴好导电胶,喷金处理后进行SEM观察。
1.4 吸附实验
1.4.1 氧化石墨含量对吸附的影响
称取GO含量分别为1 wt%、2 wt%、3 wt%、4 wt%、5 wt%、8 wt%的6种水凝胶各2份,分别加入盛有50mL、pH=4的15mg·L-1(0.015 mg·g-1)铅离子模拟废水和锌离子模拟废水的碘量瓶中,25℃下震荡4h,减压过滤得澄清溶液并测试其吸光度。
1.4.2 pH对吸附的影响
分别配制pH=1、2、3、4、5、6、7的15 mg·min-1铅离子模拟废水和15 mg·min-1锌离子模拟废水50mL于碘量瓶中,向其中加入5 wt%水凝胶0.02g,25℃下震荡2h,减压过滤得澄清溶液并测试其吸光度。
1.4.3 温度对吸附的影响
分别配制7份50 mL的15 mg·L-1、pH=4铅离子模拟废水和锌离子模拟废水,加入5 wt%水凝胶0.02 g。选择温度为10℃、15℃、25℃、35℃、45℃,震荡2h后减压过滤,得澄清溶液并测试其吸光度。
1.4.4 时间对吸附的影响
配制12份10mL、15 mg·L-1、pH=4的铅离子模拟废水和锌离子模拟废水,分别置于25 ℃和15℃下,加入5 wt%水凝胶0.004 g,静置,分别在20min、40min、60min、90min、120min、240min、480min、720min、1020min、1320min、1440min、1800min各取1份吸附后的溶液减压过滤,得澄清溶液后测试其吸光度。
2 结果与讨论
2.1 标准曲线绘制
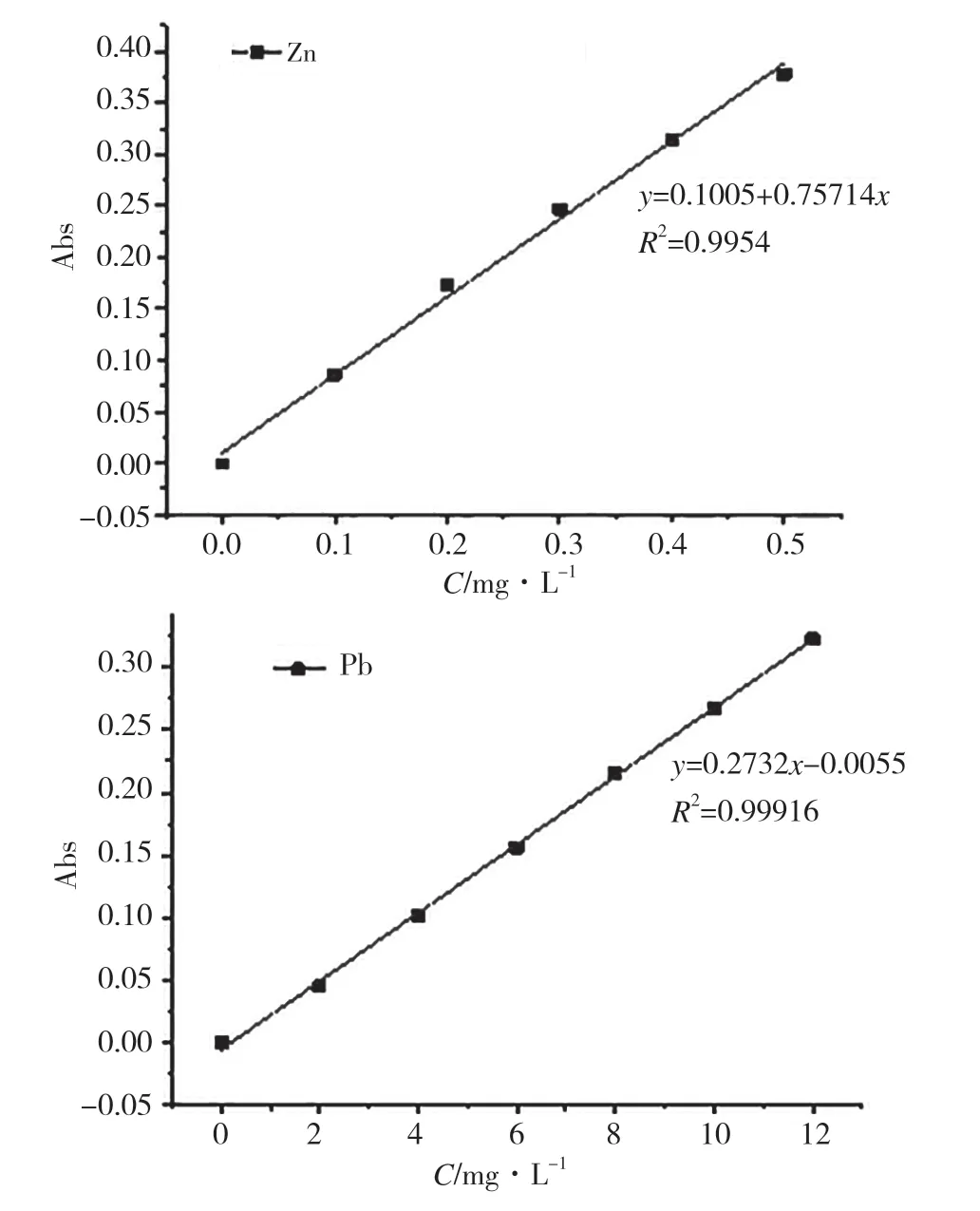
图2 Zn2+和Pb2+的标准曲线
图2是Zn2+和Pb2+的标准曲线。Zn2+满足y=0.1005+0.75714x的数学回归模型,R2=0.9954;Pb2+满足y=0.2732x-0.0055的数学回归模型,R2=0.99916。由R2可知,2种金属离子在其实验范围内的线性关系良好。
2.2 复合材料的结构分析
2.2.1 IR分析
氧化石墨和壳聚糖的特征峰如图3所示。从图3可以看到,氧化石墨上,3276 cm-1是-OH的伸缩振动峰,1716cm-1是羧基上C=O的伸缩振动峰,1619cm-1是羧基上C=O的伸缩振动峰和C=C的伸缩振动峰。壳聚糖上,3415 cm-1是-OH的伸缩振动峰,1641cm-1是乙酰基中C=O的伸缩振动峰,1439 cm-1是酰胺的伸缩振动峰。通过对比可知,复合水凝胶的特征峰与氧化石墨和壳聚糖的特征峰相互对应[6-7]。
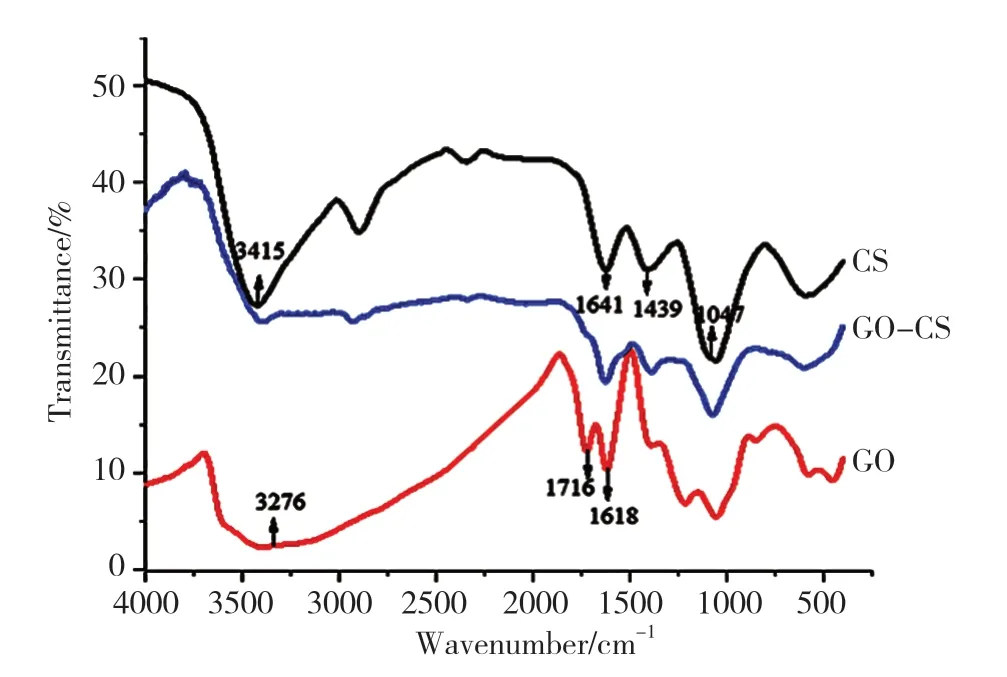
图3 壳聚糖(CS)、氧化石墨(GO)和复合水凝胶(GO-SC)的红外光谱图
2.2.2 XRD分析
图4是壳聚糖CS、氧化石墨GO和复合水凝胶GO-CS的X射线粉末衍射图。壳聚糖的曲线显示,2个特征峰分别位于2θ=11°和20.1°,分别对应着水合结晶和无水结晶两种晶态。复合水凝胶的曲线显示,2θ=11°处的峰已消失,2θ=20.1°处的衍射峰强度减弱,说明氧化石墨的加入,对壳聚糖的2种结晶结构有很大的破坏作用[8]。2θ=10°是GO的一个典型的特征峰,复合水凝胶GO-CS同样在2θ=11°也出现了衍射峰,说明GO和CS有良好的复合。
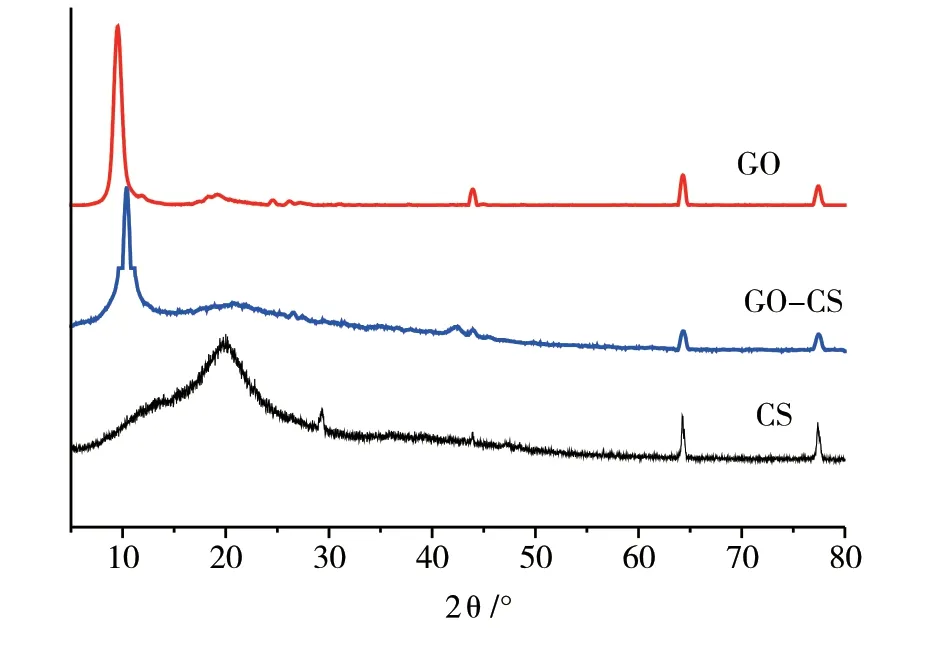
图4 壳聚糖、氧化石墨和复合水凝胶的X射线衍射图
2.2.3 TG分析
由图5可知,GO-CS复合水凝胶有3个明显的热失重过程。首先在40~160℃出现了明显的失重,是干燥水凝胶时表面遗留的醋酸及水分的失去; 160~400℃的失重是复合水凝胶中官能团的分解; 400~800℃的失重缓慢,表明复合水凝胶的骨架继续坍塌。800℃趋于平衡,热分解剩余量为21.50 %。
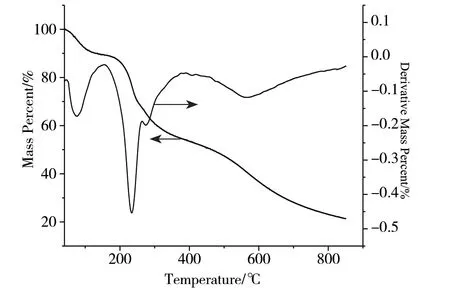
图5 水凝胶的热重分析图
2.2.4 BET分析
从比表面积分析仪可知,该复合水凝胶的BET比表面积为41.9333 m2·g-1,BET平均孔径为4.1394 nm。分析数据后可知,该水凝胶属于纳米级材料,具有较大的比表面积和较小的孔径,更有利于对金属离子的吸附。
2.2.5 SEM扫描
从图6可看出,氧化石墨以片层形状存在,片层之间有间距,且其表面和边缘均有褶皱存在。图7是氧化石墨和壳聚糖复合形成的水凝胶,与图6相比,水凝胶较密实且其表面出现了大量的小孔,增加了水凝胶的吸附性能[9]。

图6 氧化石墨的SEM图

图7 水凝胶的SEM图
2.3 复合材料吸附性能的研究
2.3.1 氧化石墨含量对吸附的影响
图8是不同氧化石墨含量的水凝胶对Pb2+和Zn2+吸附的影响曲线。从图8可知,水凝胶对2种金属离子的吸附均出现了最高点和最低点,是由于氧化石墨的表面有大量的羰基(C=O)和羧基(-COOH),而壳聚糖中有大量的羟基(-OH)和氨基(-NH2),两者在复合的过程中,羧基和羟基会发生酯化反应及脱水反应,羧基和羟基会大量减少,因此对2种金属离子的吸附降到了最低。会出现吸附最高点,是因为2种基团的其中1种过多或过少,酯化反应后另一种基团有大量剩余,会对金属离子产生吸附。从图9可看出5 wt%水凝胶的吸附性能最好。

图8 氧化石墨含量对Pb2+和Zn2+吸附的影响
2.3.2 pH对吸附的影响
Zn2+和Pb2+在碱性溶液中会出现沉淀,因此难以准确测定其吸附效果。本文探究的pH介于酸性与中性之间。pH较小时,H+的浓度较大,-COOH的解离较少,-COO-较少导致对金属离子的吸附性较差。通常情况下,吸附性会随着pH的增大而增大,但是随着pH的增大,OH-也会变多,水中的OH-会和金属离子发生水解生成沉淀,降低了其对金属离子的吸附效果。pH=7时离子不稳定,会出现沉淀,导致无法准确测定[10]。因此该水凝胶对Zn2+和Pb2+有最好吸附效果的pH是6和5。
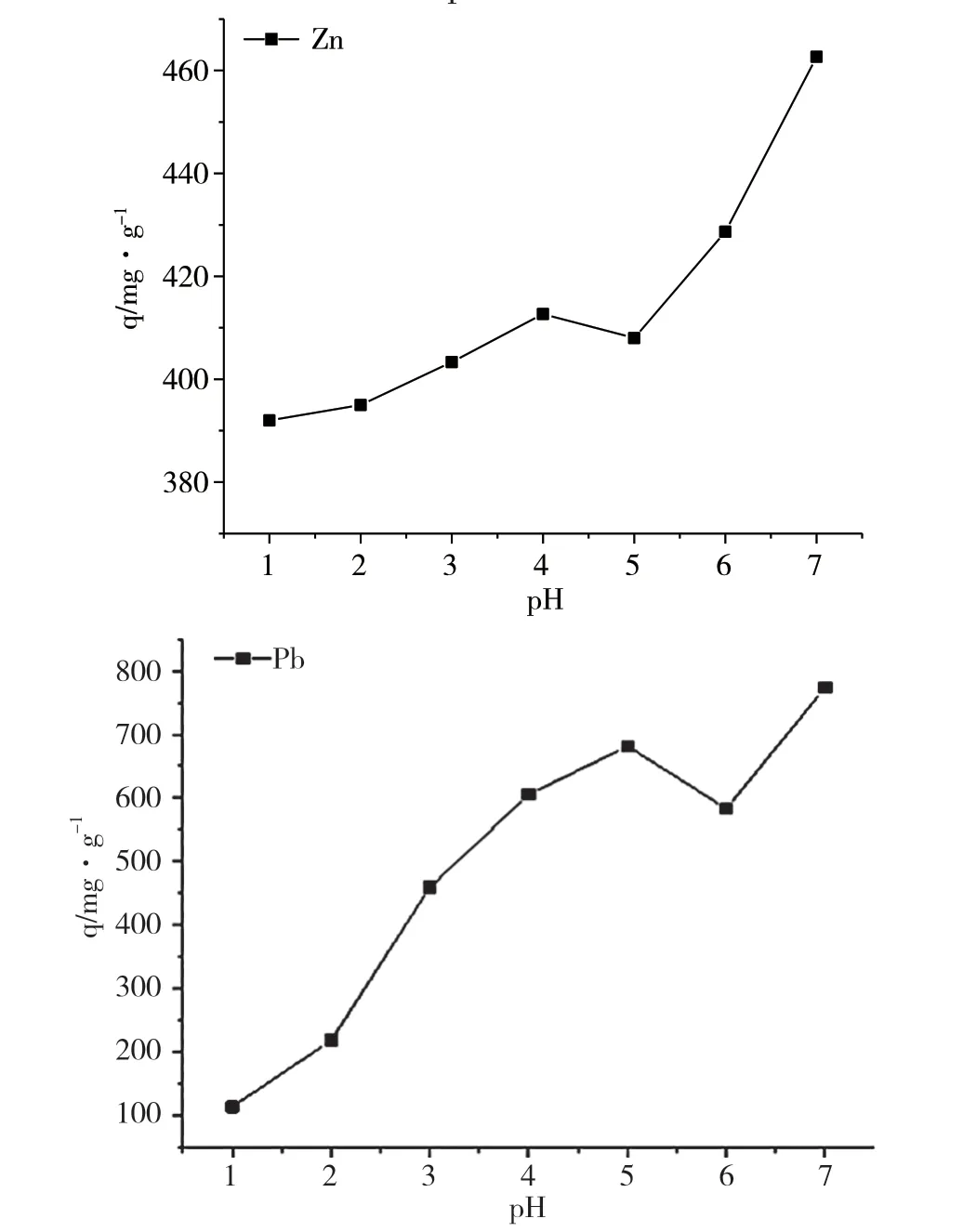
图9 pH对Zn2+和Pb2+吸附的影响
2.3.3 温度对吸附的影响

由图10可知,温度对Zn2+和Pb2+吸附的影响是不相同的。水凝胶表面含有大量的官能团如氨基、羧基等,因此水凝胶可以通过氨基和羧基,与金属离子发生螯合作用、离子交换和静电引力,从而实现对金属离子的吸附。随着温度降低,水凝胶对Pb2+的吸附性能越好,说明水凝胶吸附Pb2+是放热反应,是自发进行的。随着温度的升高,Zn2+的吸附量迅速升高,一方面是温度的升高使得水凝胶分子链逐渐松弛,内部空洞体积增大,另一方面是温度升高加快了金属离子与水凝胶活性基团的碰撞。随着温度升高,其吸附量趋近于平衡,是因为水凝胶分子间有一定的相互作用力,导致内部空洞增大到一定体积后不再扩大。综合考虑吸附及能量消耗等多种因素,水凝胶在10℃和25℃条件下对锌离子和铅离子的吸附效果最好。

图10 温度对Zn2+和Pb2+吸附的影响
2.3.4 吸附时间的影响
由图11可知,,时间达到720 min时,水凝胶对Zn2+的吸附趋于平衡,前120 min时吸附量迅速升高,是由于刚开始的吸附位点较多,随着吸附位点减少,吸附量逐渐减小,直至平衡;而水凝胶对Pb2+的吸附,前120 min时的吸附量迅速升高,是由于刚开始时的吸附位点较多,之后浓度减小,吸附量以一定的速度慢慢增加,直至1020 min后达到平衡。

图11 吸附时间对Zn2+和Pb2+吸附的影响
2.4 吸附动力学模型
复合水凝胶对Zn2+和Pb2+的吸附性动力学拟合结果如图12、图13和表1所示。吸附动力学模拟通常分为准一级吸附动力学和准二级吸附动力学两种,准一级吸附动力学模型为:
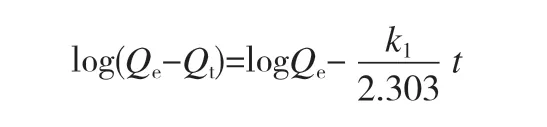
准二级吸附动力学模型为:
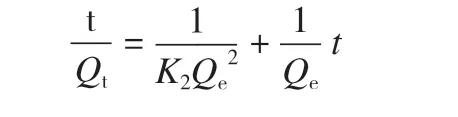
其中Qt是任意时间t时水凝胶对金属离子的吸附量;K1为准一级吸附动力学常数;K2为准二级吸附动力学常数;Qe指吸附平衡时水凝胶对重金属离子的吸附量;t为吸附时间。
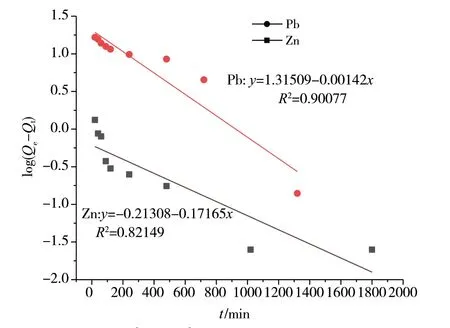
图12 Zn2+和Pb2+的准一级吸附动力学模型
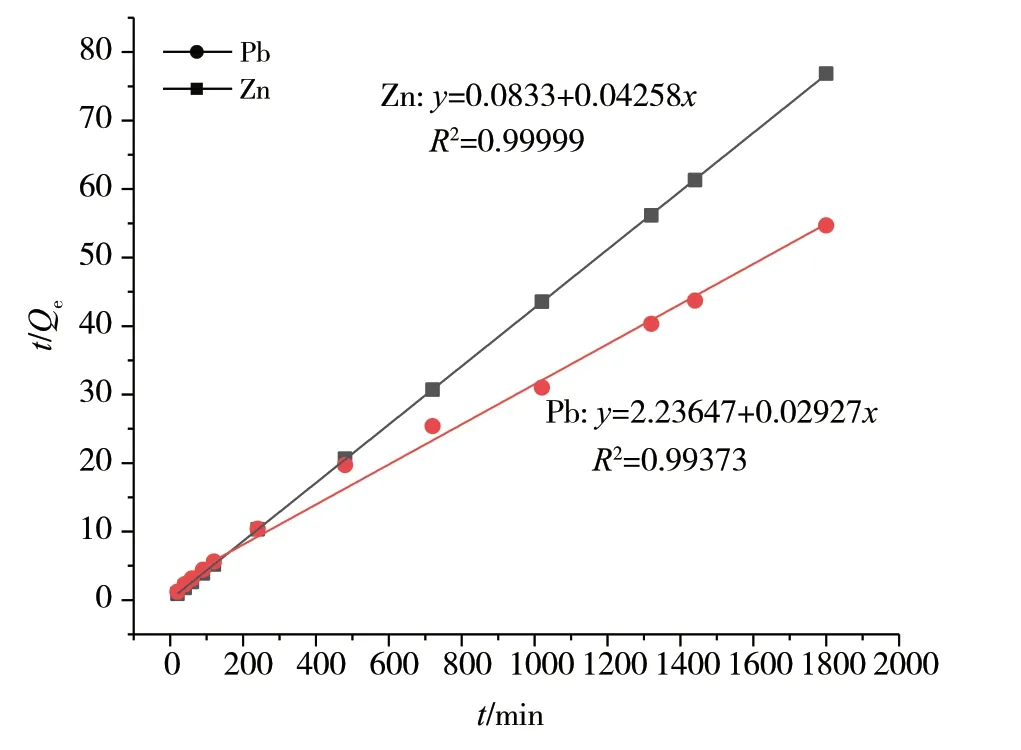
图13 Zn2+和Pb2+的准二级吸附动力学模型
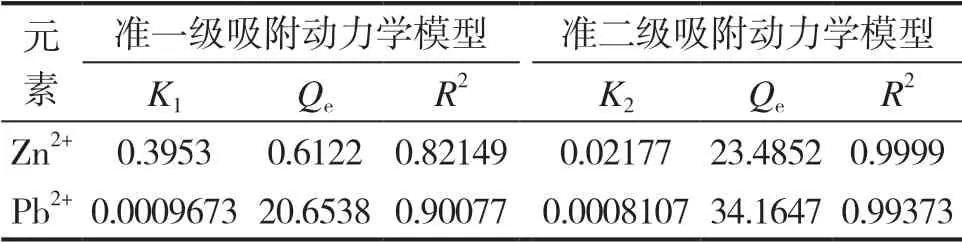
表1 复合水凝胶吸附Zn2+、Pb2+的吸附动力学模拟参数
对铅离子和锌离子的2种吸附动力学模型的数学方程及其相关性进行比较后可知,准二级吸附的相关系数比准一级吸附更接近于1,相关性更好,因此复合水凝胶对铅离子和锌离子的吸附可认为是准二级吸附,说明该吸附过程受化学吸附机理影响,涉及吸附剂与吸附质之间的电子共用或电子转移[11-13]。
3 结论
本实验用改进Hummers法制备氧化石墨,将壳聚糖和氧化石墨在机械搅拌下反应,合成氧化石墨烯/壳聚糖复合水凝胶吸附剂,采用傅里叶红外光谱仪、X射线粉末衍射仪、热重分析仪和比表面积孔径分析仪等仪器对水凝胶进行了结构表征。采用原子吸收分光光度计测定金属离子浓度,探究复合水凝胶对水中Pb2+和Zn2+吸附的最佳温度、pH值、氧化石墨含量和吸附平衡时间。结果表明,氧化石墨和壳聚糖复合水凝胶能很好地吸附水中的铅离子和锌离子,吸附Zn2+的最佳条件为:5 wt%的GO水凝胶,pH=6,10℃,720 min时的吸附量最多;吸附Pb2+的最佳条件为:5 wt%的GO水凝胶,pH=5, 25℃,1020min时的吸附量最多。对吸附动力学模型进行分析后可知,该实验的吸附过程为准二级吸附,Pb2+的吸附方程为:y=2.23647+0.02927x,R2=0.9999;Zn2+的吸附方程为:y=0.0833+0.04258x,R2=0.99373,属于化学吸附。
