COL8A1通过竞争性结合miR-876调控SUZ12的表达从而促进胃癌细胞增殖
2021-06-10屈振杰
屈振杰 ,崔 琴
内蒙古包钢医院1.肿瘤内科;2.消化内科,内蒙古 包头 014010
胃癌是消化道常见的恶性肿瘤,其发病率及死亡率居恶性肿瘤第2位[1]。目前胃癌发病机制尚未完全明确,大多数患者确诊时已至中晚期,转移、侵袭是导致胃癌术后复发、死亡的主要原因,患者远期生存率低[2-3]。近年研究表明,遗传和表观遗传失调与胃癌的发生发展密切相关[4]。 因此,基于分子基因角度探究胃癌发病机制,找寻特异性新型诊断及治疗靶点是目前研究的热点。胶原蛋白家族成员Ⅷ型胶原蛋白是由2条COL8A1基因编码的α1链和1条COL8A2基因编码的α2链构成,主要在角膜、主动脉内皮细胞和肾小球系膜细胞(MCs)中产生[5-7]。研究表明,COL8A1与血管形成及肿瘤发生发展密切相关,如Lopes等[8]在一项关于动脉粥样硬化的研究中表明,COL8A1可促进平滑肌细胞的增殖和迁移。Zhao等[9]发现,COL8A1在肝癌细胞中的表达可促进高潜能的淋巴转移性Hca-F细胞的增殖和侵袭。COL8A1与人结肠腺癌的进展和预后相关[10]。目前有关COL8A1在胃癌中的作用未见相关报道,因此,本研究探究了COL8A1在胃癌发生发展中的作用及其潜在分子机制。
1 材料与方法
1.1 临床资料收集2018年3月至2019年12月我院获得的108例胃组织标本,其中胃癌组织46例,正常组织34例,胃高级别上皮内瘤变组织28例,所有组织均经胃镜检查胃黏膜活检及病理等确诊。46例胃癌患者男30例,女16例,年龄(53.4±8.7)岁;病理T分期T1~T2期15例,T3~T4期31例;病理分期Ⅰ~Ⅱ期18例,Ⅲ~Ⅳ期28例。所获组织于液氮中低温保存,经石蜡包埋,4 μm厚度连续切片制成标本。
1.2 细胞、材料及试剂
1.2.1 细胞来源:研究采用人胃癌细胞BGC-823,购自美国ATCC细胞库。
1.2.2 材料与试剂:胎牛血清FBS、RPMI-1640培养基、胰蛋白酶、NC膜、ECL发光显色液购自美国Thermo Fisher公司;Trizol试剂、Lipo2000、miR-876 mimics购自美国Invitrogen公司;COL8A1 3′UTR、COL8A1 3′UTR-mut、SUZ12 3′UTR、SUZ12 3′UTR-mut报告基因质粒及其空质粒及COL8A1和SUZ12 siRNA均购自广州市锐博生物科技有限公司;逆转录试剂及荧光定量PCR试剂购自翊圣(上海)有限公司;细胞增殖实验反应MTS购自Abcam公司;BCA蛋白浓度检测试剂盒购自上海碧云天生物技术有限公司;双荧光素酶报告基因试剂盒购自美国Promega公司。
1.2.3 引物序列:基因序列来源于NCBI数据库,通过Primer 3.0软件设计qRT-PCR检测引物,由上海生工生物工程有限公司合成。引物序列如表1所示。

表1 qRT-PCR引物序列及扩增长度Tab 1 qRT-PCR primer sequence and amplification length
1.3 方法
1.3.1 免疫组化染色法检测不同胃组织中COL8A1蛋白表达:组织切片脱蜡、脱水,柠檬酸缓冲液中高温抗原修复,3% H2O2阻断内源性过氧化物酶活性,山羊血清封闭15 min,滴加一抗,4 ℃过夜,滴加二抗;DAB试剂盒镜下显色,HE复染,脱水,透明,中性树胶封片,以PBS代替一抗作为阴性对照。
结果判读:由两名病理科专家单独阅片,以细胞间质呈棕色或深棕色为COL8A1蛋白阳性。取镜下随机5个视野观察计数阳性细胞百分比及细胞着色程度,(1)阳性细胞百分比:0%记0分,1%~25%记1分,26%~50%记2分,51%~75%记3分,≥76%记4分;(2)着色程度:无着色记0分,浅黄色记1分,棕黄色记2分,棕褐色记3分。两评分乘积进行判断,0分记为阴性(-),2~4分记为弱阳性(+),5~8分记为阳性(++),≥9分记为强阳性(+++)。
1.3.2 细胞培养及转染:人胃癌BGC-823细胞于含质量浓度为100 g/L胎牛血清的RPMI-1640培养基,37 ℃、体积分数为5% 的CO2、95%湿度培养箱中孵育培养,并加入100 μg/ml链霉素和100 IU/ml 青霉素,待细胞密度达到80%时进行细胞传代、冻存。转染前1天将细胞接种于6孔板,待细胞贴壁后进行转染,将1 μl siRNA与250 μl Opti-MEM混匀,1 μl Lipo 2000与250 μl Opti-MEM混匀,室温放置5 min,后将两部分合并混匀,静置15 min,将转染复合物逐滴、均匀加入6孔板中,48 h后进行实验。
1.3.3 临床数据筛选:通过临床数据库GEPIA(Gene Expression Profiling Interactive Analysis)[11],设定检索条件tumor/normal>2找到在胃癌中高表达的蛋白,并通过该数据库找到与胃癌临床预后密切相关的蛋白,将两部分数据进行重合性分析,从而筛选到目的蛋白。
1.3.4 实时荧光定量PCR(qRT-PCR):采用Trizol试剂提取细胞总RNA并检测其浓度及纯度,按照逆转录试剂盒将其反转录为cDNA,将所得cDNA利用灭菌纯水稀释至适当浓度(20倍),按照qRT-PCR mix 5 μl,primer 1 μl, cDNA 4 μl的体系加入96孔PCR板中,贴膜,2 500 r/min离心1 min,将样品放入qPCR仪器中进行PCR扩增,待反应完成后拷贝数据进行分析。
1.3.5 细胞增殖实验:取对数生长期细胞,胰酶消化,制成细胞悬液接种于96孔板,每个实验组设3个复孔,37 ℃、体积分数为5%的CO2培养箱孵育48 h;配制MTS反应液(MTS∶培养液=1∶20),每孔加入100 μl,37 ℃继续培养,每隔半小时检测1次吸光度;将培养皿置于摇床上低速振荡充分溶解结晶物,在490 nm处测量各孔吸光值,绘制细胞增殖曲线。
1.3.6 克隆形成实验:取对数生长期单层培养细胞,胰酶消化制成细胞悬液,以每孔2 000个细胞浓度接种于6孔板,每孔设3个复孔,37 ℃、体积分数为5%的CO2培养箱中培养;待肉眼可见培养皿出现克隆时终止培养,收集细胞, PBS洗涤2次,加入甲醇∶乙酸比为3∶1的固定液常温固定5 min,用含0.5%结晶紫的甲醇溶液染色15 min,洗去染色液,室温晾干,镜下观察细胞克隆形成率。
1.3.7 microRNA靶标预测:通过microRNA[12]网站进行预测miR-876结合COL8A1和SUZ12的具体位点,从而行进一步研究。
1.3.8 双萤光素酶报告基因实验:将胃癌细胞接种到6孔板中培养,使其密度为90%,含有海肾荧光素酶的报道质粒用作标准参考,将COL8A1 3′UTR-mut、SUZ12 3′UTR-mut载体和miR-876转染到BGC-823细胞中,使用双重荧光素酶测定系统测量荧光素酶活性,转染48 h后测定海肾荧光素酶活性,实验重复3次。
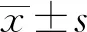
2 结果
2.1 筛选胃癌中高表达且具显著临床意义的靶基因通过GEPIA数据库[11]筛选出在胃癌中高表达的基因有3 746个,与胃癌具有显著临床相关性的基因有500个,重合性分析发现,在胃癌中高表达且具有明显预后相关性的基因有46个(见图1A)。将重合性基因进行热图分析(见图1B),找到排名前5位的分别是CTHRC1、SLC5A1、MYB、SPARC和COL8A1,均在胃癌中呈现高表达预后差特征(Logrank检验分别为P=0.00078,P=0.00059,P=0.0046,P=0.0049,P=0.003,见图1C~1G),但仅有COL8A1在胃癌中的重要性未见报道,因此我们选择COL8A1作为研究目的基因。
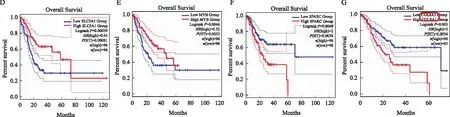
2.2 COL8A1在胃癌及胃癌前病变组织中的表达免疫组化染色法分析COL8A1在胃癌及胃癌变过程中的表达,结果显示:COL8A1蛋白阳性表达于细胞间质中,在胃癌细胞中显著高表达,正常组织中极低表达或不表达(见图2A~2C),COL8A1总阳性率胃高级别上皮内瘤变组织高于正常组织(P=0.000),胃癌组织高于胃高级别上皮内瘤变组织(P=0.014)(见表2)。qRT-PCR法分析显示,COL8A1 mRNA水平胃癌组织>胃高级别上皮内瘤变组织>正常组织, 差异有统计学意义(P<0.05)(见图2D);COL8A1与病理T分期显著相关,T3/T4期患者COL8A1水平高于T1/T2期(P<0.05),而与病理TNM分期无相关性(P>0.05)(见图2E~2F)。说明COL8A1在胃癌前病变组织中也有表达,与胃癌的发生发展密切相关,可作为早期胃癌诊断的分子指标。

注:A:GEPIA数据库胃癌差异基因筛查及重合分析;B:热图分析与胃癌显著相关的目的基因;C~G:前5位高表达目的基因与患者预后的关系。
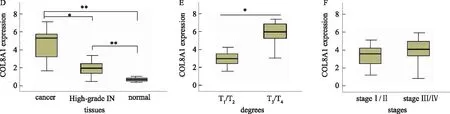
2.3 COL8A1促进胃癌BGC-823细胞增殖用siRNA介导敲低胃癌细胞中COL8A1表达(P<0.01)(见图3A),采用MTS细胞增殖检测及克隆形成实验验证显示,敲降COL8A1表达后胃癌BGC-823细胞增殖速率及克隆形成速率显著降低(P<0.05)(见图3B~3D)。

表2 COL8A1在各组织中的阳性表达Tab 2 Positive expression of COL8A1 in various tissues

注:A:正常组织;B:胃高级别上皮内瘤变组织;C:胃癌组织;D:不同组织中COL8A1表达情况;E:不同浸润程度的胃癌组织COL8A1表达情况;F:不同TNM分期的胃癌组织COL8A1表达情况。免疫组化染色(200×)。*P<0.05,**P<0.01。

注:A:细胞转染效率验证;B:细胞增殖实验结果;C:克隆形成实验;D:克隆形成速率。与siCTL比较,*P<0.05,**P<0.01。
2.4 miR-876结合COL8A1在胃癌中高表达通过microRNA.org网站[12]预测发现,COL8A1可结合miR-876(见图4A);利用荧光报告基因实验进行验证发现,共转染COL8A1-wt和miR-876-mimics时荧光活性显著抑制(P<0.01),而共转染COL8A1-mut和miR-876-mimics时荧光活性无明显变化(P>0.05)(见图4B),说明miR-876与COL8A1存在靶向结合关系。进一步通过qRT-PCR实验对所得46例胃癌患者临床数据进行检测发现,miR-876在胃癌中显著低表达(P<0.000,见图4C),且具有明显的低表达预后差特征(P=0.033,见图4D),与先前文献[12]报道miR-876的抑癌作用相符。

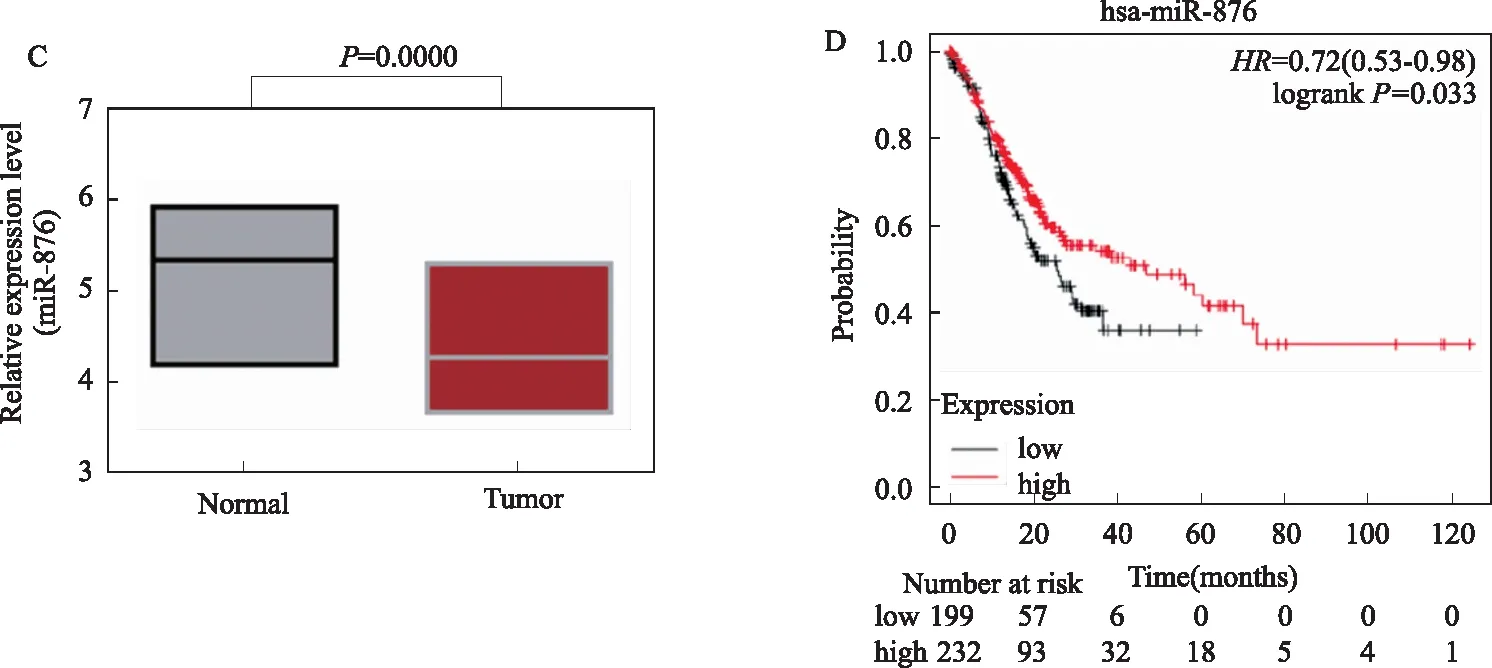
注:A:COL8A1引物序列可与miR-867结合;B:荧光报告基因实验验证COL8A1与miR-867靶向结合;C:qRT-PCR检测miR-867在胃癌中的表达情况;D:不同miR-867表达与胃癌患者预后关系。
2.5 COL8A1竞争性结合miR-876调控SUZ12的表达从而促进胃癌细胞增殖通过数据库预测发现,miR-876可结合SUZ12(见图5A),报告基因实验验证了两者的结合关系(P<0.01,见图5B)。通过qRT-PCR实验发现SUZ12在46例胃癌中显著高表达(P<0.05,见图5C)。通过过表达miR-876和miR-876+COL8A1(P<0.001,见图5D~5E),发现过表达miR-876后SUZ12表达显著抑制(P<0.01),同时过表达miR-876和COL8A1后SUZ12表达显著升高(P<0.01)(见图5F)。细胞增殖实验发现,过表达miR-876后BGC-823细胞增殖速率显著降低(P<0.05),同时过表达miR-876和COL8A1后细胞增殖速率回归至正常水平(P>0.05)(见图5G)。由此说明COL8A1竞争性结合miR-876,使得miR-876与SUZ12结合减弱,进而上调SUZ12表达,促进胃癌细胞增殖。
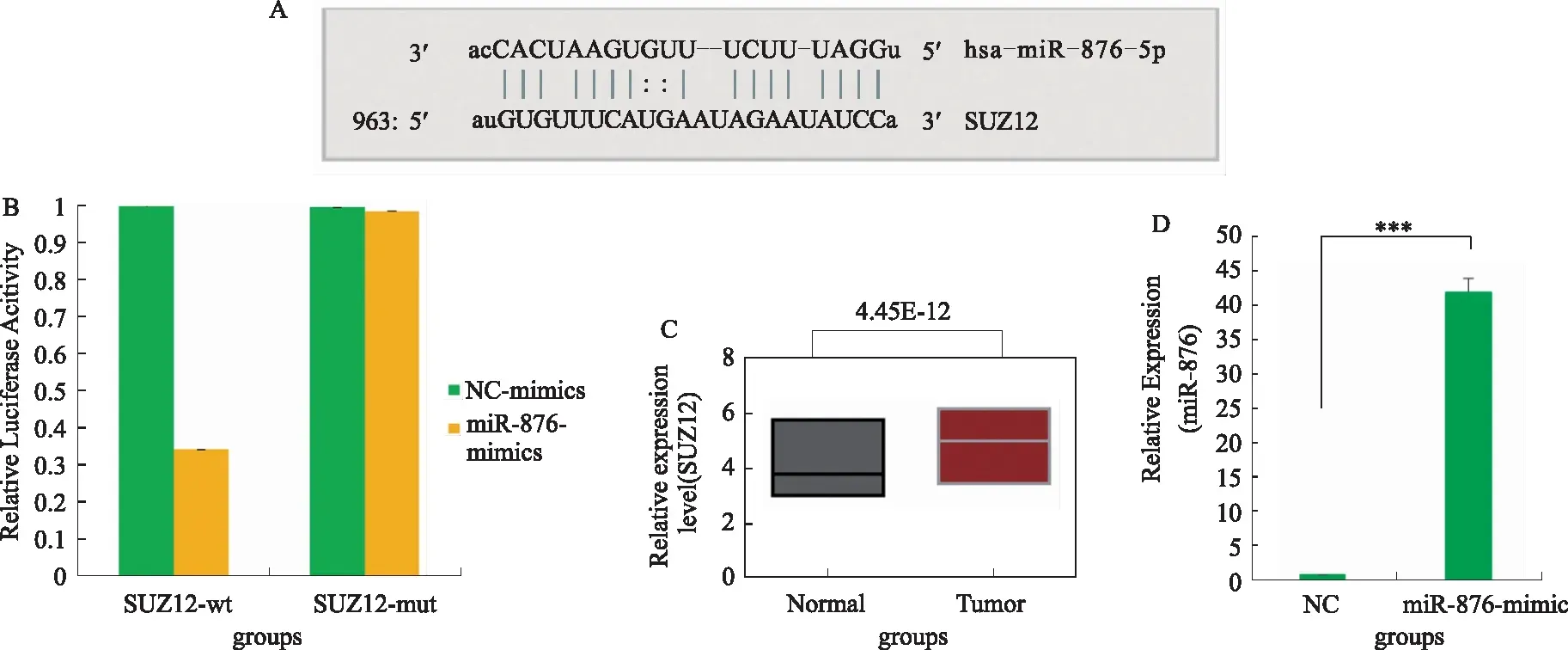
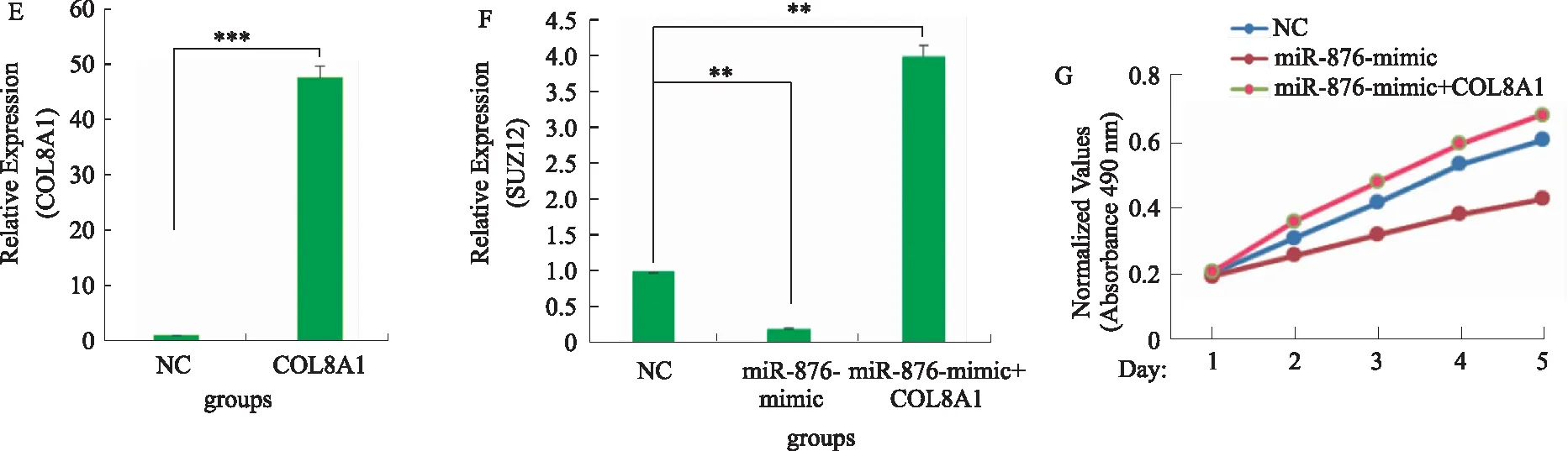
注:A:miR-867引物序列可与SUZ12结合;B:荧光报告基因实验验证miR-867与SUZ12靶向结合;C:qRT-PCR检测SUZ12在胃癌中的表达情况;D:过表达miR-876;E:过表达COL8A1;F:过表达miR-876及miR-876+COL8A1后SUZ12蛋白表达情况;G:过表达miR-876及miR-876+COL8A1后胃癌细胞增殖情况。*P<0.05,**P<0.01,***P<0.001。
3 讨论
恶性肿瘤是以细胞失控性增殖为特征,受累于广泛的基因组和表观基因组水平上紊乱、持续发生异常变化的复杂疾病[13]。随着分子生物学的研究,发现肿瘤的发生发展是多因素、多基因、多通路、多阶段发展的复杂过程,涉及癌基因、抑癌基因、凋亡相关蛋白及转移相关基因等的改变,其中原癌基因的激活和抑癌基因的失活是推进肿瘤恶性发展的主要因素[14]。因此,进一步探究胃癌发生发展的分子机制,找寻新的治疗靶点及关键调控因子,对改善患者预后至关重要。基于此本研究通过检索挖掘GEPIA数据库,得到3 700个高表达基因和500个与临床预后显著相关的基因,经重合行分析及高表达预后差原则最终选择COL8A1作为本研究的目的基因。
Ⅷ型胶原蛋白由COL8A1和COL8A2组成,主要分布于肝脏、心脏、肺、脑及软骨组织,参与血管内皮的构成[7]。既往研究发现,肝癌中Ⅷ型胶原蛋白表达显著高于良性腺瘤[15]。且发现在众多与新生血管形成相关的恶性疾病患者外周血中Ⅷ型胶原蛋白表达升高[16],提示其可能通过参与肿瘤新生血管形成促进肿瘤细胞的恶性发展进程,与肿瘤侵袭性关系密切。此外,研究还发现,COL8A1参与肝癌细胞的增殖和侵袭[17]。赵永福等[18]发现,小鼠肝癌细胞中COL8A1与肿瘤细胞增殖、侵袭及细胞耐药密切。COL8A1可能通过调控局灶粘附相关通路参与影响人结肠腺癌的进展及预后[10]。COL8A1通过PI3K/AKT信号通路促进牛MDSCs的增殖[19]。而本研究临床病理证实胃癌组织中COL8A1表达显著高于正常组织,且在胃癌前病变(胃高级别上皮内瘤变)组织中也发现COL8A1表达(均为弱阳性或阳性),COL8A1与病理T分期显著相关,提示COL8A1在胃癌前病变发展至胃癌的过程中发挥作用,参与胃癌的发生发展,可用作早期胃癌的诊断标志。通过转染敲低COL8A1表达,采用细胞实验证实敲低COL8A1表达后胃癌细胞增殖速率和克隆形成速率显著降低,证明了COL8A1在胃癌中的促癌基因特性。既往研究曾报道miR-876是肿瘤抑制因子,如在肝细胞癌(HCC)中,miR-876被发现可通过抑制靶基因来增强对索拉非尼的敏感性并抑制HCC细胞的增殖、迁移和EMT进程[20-22]。肺癌[23]、头颈部鳞状细胞癌[24]和骨肉瘤[25]中miR-876也起到抗肿瘤作用。本研究进一步通过生物信息数据库检测并证实COL8A1与miR-876存在相互结合位点, miR-876作为抑癌基因在胃癌中相比邻近正常组织显著低表达且具有明显的低表达预后差特征,同时验证还发现miR-876还可与促癌基因SUZ12结合并抑制其表达,提示miR-876、COL8A1和SUZ12之间必定存在某种竞争机制。因此,研究通过qRT-PCR实验和细胞增殖实验对其作用机制行进一步探究,发现过表达miR-876可抑制SUZ12表达,减慢细胞增殖速率;但同时过表达miR-876和COL8A1可显著上调SUZ12表达,恢复细胞增殖速率至正常水平。由此说明COL8A1可竞争性结合miR-876,减弱miR-876与SUZ12结合作用,进而增加SUZ12表达,促进胃癌细胞快速的增殖。
综上,COL8A1在胃癌中高表达,参与胃癌前病变进展为胃癌的过程,可作为胃癌早期诊断的分子标志物;COL8A1促进胃癌细胞增殖,可能通过竞争性结合miR-876,减弱miR-876与SUZ12结合作用,进而释放SUZ12,促进胃癌的发展。
