普通小麦–六倍体中间偃麦草易位系的抗条锈鉴定及应用评估
2021-06-09冯志威赵佳佳武棒棒闫素仙郑兴卫
王 音 冯志威 葛 川 赵佳佳 乔 玲 武棒棒 闫素仙 郑 军,,* 郑兴卫,,*
普通小麦–六倍体中间偃麦草易位系的抗条锈鉴定及应用评估
王 音1,**冯志威3,**葛 川3赵佳佳2乔 玲2武棒棒2闫素仙2郑 军2,3,*郑兴卫2,3,*
1山西师范大学临汾学院自然科学系, 山西临汾 041000;2山西农业大学小麦研究所, 山西临汾 041000;3山西农业大学农学院 / 作物遗传与分子改良山西省重点实验室, 山西太原 030000
小麦近缘属种中含有丰富的抗病资源, 前期从普通小麦与六倍体中间偃麦草的杂交、回交后代中, 鉴定获得稳定的小麦易位系新种质ZH811。为发掘和利用该易位系的抗性基因, 对ZH811进行苗期分小种的条锈病鉴定、田间农艺性状考察、分子细胞学特性和主要品质性状分析; 利用随机扩增多态性DNA (Random Amplified Polymorphic DNA, RAPD)开发易位片段的特异标记。结果表明, ZH811苗期对条锈菌条中29、31、32、33、34以及水源4、5和7号的混合菌种具有较强的抗性, 其抗性源于5D染色体短臂含有来源于Ee基因组的小片段易位; SCAR标记(Sequence Characterized Amplified Region, SCAR)和黑芒可作为易位片段追踪的分子和形态标记; ZH811的主要农艺性状接近当前黄淮北片麦区的主推品种, HMW-GS组合类型是“1, 17+18, 5+10”, 3个位点均为优质亚基, 各项品质指标达到中强筋的标准; 易位片段具有增加穗粒数的效应, 不含降低品质的连锁累赘。ZH811可为培育高产、抗病和优质小麦新品种提供重要的中间材料。
条锈; 易位系; 原位杂交; 分子标记
我国是全球最大的小麦生产国和消费国, 总产量常年在1.3亿吨左右。条锈病是我国小麦生产上最重要的真菌病害之一, 可造成数万吨的损失[1-2]。培育持久稳定的抗病小麦品种是控制条锈病、保障粮食安全、最经济环保的措施[3]。然而, 当前我国有效抗源, 特别是苗期抗源匮乏, 是目前抗病育种的瓶颈。生产上利用的抗病基因多以专化抗病基因为主, 大面积单一种植极易造成病原菌生理小种发生定向选择, 引起条锈病大流行[1,4]。如新致病类群V26的出现, 导致大部分小麦品种丧失抗性, 包括使用近30年含/基因的小麦品种[5]。随着新致病类群毒力和适应性的不断增强, 小麦抗条锈病育种再次成为重中之重。因此, 发掘和利用新的持久抗病基因资源刻不容缓。
小麦近缘种属具有抗病虫、抗旱、耐盐、抗寒等特点, 利用远缘杂交和染色体异源重组, 从小麦近缘种属导入新的抗病片段是提高小麦遗传多样性及培育多抗性品种的重要途径[6-8]。在小麦远缘杂交种质应用方面, 含有、、和等基因的小麦–黑麦1RS·1BL易位系, 含、和的小麦–偏凸山羊草2NS/2AS易位系, 含有长穗偃麦草抗条锈病基因的小偃系列品系[9], 含有来自彭提卡偃麦草基因的小麦–偃麦草染色体易位系[10], 以及小麦-冰草衍生出的普冰系列品系[11], 都对小麦抗病育种做出了重要贡献。绝大多数易位系因遗传补偿性差或整合的异源片段过长导致细胞学不稳定以及与不良性状连锁, 从而大大降低其育种价值, 因此建立含有小片段易位的外源遗传材料一直倍受重视。
自Lupton和Macer[12]首次提出采用系统命名小麦抗条锈病基因以来, 已有80多个基因正式公布, 分别为-。这些基因的抗性来源有两类, 一类来自普通小麦, 另一类来自小麦近缘种属, 比如基因[13]来自于顶芒山羊草()、[14]来源于拟斯卑尔脱山羊草()、[15]和[16]来源于黑麦()、[17]源于偏凸山羊草()、[18]来源于粗山羊草()、[19]来源于黏果山羊草()、[20]发现于沙伦山羊草()、[21]来自于卵穗山羊草()、[22]源于三芒山羊草()。尽管在已知抗条锈病基因中, 源于小麦近缘种属的比例只有11.3%[23], 但因其抗性持久, 均受到小麦育种家和病理学家的高度重视。
在小麦遗传改良中, 中间偃麦草是利用最成功的多年生野生近缘植物, 其蕴含许多能够增强抗性、改善品质的有益基因, 是小麦遗传改良的重要基因资源库[24]。Zhan等[25]和Lang等[26]发现, 偃麦草基因组与小麦之间能发生高水平的染色体配对, 载有目的基因的染色体更容易与小麦部分同源染色体发生交换和重组, 使得重组后的染色体在结构上更接近于小麦。六倍体中间偃麦草与小麦杂交形成小麦-中间偃麦草衍生系材料, 在小麦染色体工程研究和育种生产上有很多成功的范例。如中1-中5[27-28]、Otrastsjuskaya[29]、TE-3[30]、TAI8335[31]、TE253[32]和CH13-21[25]等对条锈病具有很好的抗性。近年来国内小麦育种家陆续对中间偃麦草与普通小麦杂交后代中的[33]、[34]、[35]、[36]、[37]、[38]等多个源于中间偃麦草的抗条锈病基因进行了定位。这些新基因的挖掘丰富了小麦抗病基因源, 为小麦遗传改良育种提供了宝贵材料, 但携带抗病基因的外源片段多数存在或多或少的连锁累赘, 可供育种家利用的有效抗源仍然较少。因此, 培育多抗性新抗源, 发掘新的抗病基因及其紧密连锁的分子标记, 且兼具良好的农艺、品质性状, 对选育多抗、高产、优质新品种具有重要意义。
为挖掘中间偃麦草的抗病基因资源, 并为培育抗病品种提供优异的中间型育种材料, 本研究前期通过普通小麦与六倍体中间偃麦草杂交后, 获得的偃麦草易位系材料, 对其进行了苗期分小种条锈病的抗性鉴定、成株期农艺性状的评估以及细胞学水平上的鉴定, 在明确其抗性来源和农艺、品质性状的基础上开发了SCAR分子标记和黑芒的形态学标记, 以期为更好地利用这些材料奠定基础。
1 材料与方法
1.1 试验材料
供试条锈菌小种: 条中29、31、32、33号以及水源4、5、7号由甘肃省农业科学院提供, 条中34号由西北农林科技大学旱区作物逆境生物学国家重点实验室提供。试验中用到的植物材料及其信息、用途均在表1中列出。
1.2 易位系ZH811抗病性鉴定
2016和2017年在山西农业大学(山西省农业科学院)小麦研究所人工气候室(面积4 m × 5 m)内, 温度(17±2)℃, 光照为1000 μmol m−2s−1, 光周期为14 L/10 D进行苗期抗病性鉴定。用条中29、31、32、33、34号以及水源4、5、7号的混合菌种对ZH811、ZH577、亲本材料及ZH811×ZH577的正反交F2及BC1群体进行接种鉴定。参照吴建辉[39]的方法, 小麦二叶期时接种, 条锈菌与滑石粉按照1∶30比例混匀, 采用抖粉法进行接种, 反应型按Line和Qayoum[40]的0~9级标准判定: 0级为免疫; 1~3级为高度抗病; 4~6级为中度抗病; 7级为中度感病; 8~9级为高度感病。根据双亲和杂交后代反应型级别划分抗感类型, 统计抗感植株数。对ZH811×ZH577的正反交F2、BC1群体计算分离比例, 以确定抗条锈基因数目及遗传特点。
1.3 易位系ZH811的荧光原位杂交细胞学鉴定
染色体制片: 将ZH811、晋麦33和临4133的种子置于垫有2层滤纸的玻璃培养皿内, 室温浸泡8 h至萌动, 置于室温暗培养, 待根长至1~2 cm时剪取根尖, 冰水处理36 h; 用卡诺氏固定液(95%乙醇与冰醋酸体积比为3∶1)固定根尖12 h; 将根尖置于1% Pectolyase Y-23果胶酶和2% cellulose Onozuka R-10纤维素酶的混合酶液中, 37℃酶解25~50 min, 再用45%冰醋酸压片, 相差显微镜下观察中期染色体。选择分裂相多、染色体分散好的片子, 液氮冷冻揭片, 晾干备用。

表1 试验所需植物材料及信息
标记探针: 用Fluorescein-12-dUTP、地高辛(digoxigenin-11-dUTP)或生物素(biotin-16-dUTP)通过切口平移法标记DNA, 15℃下标记1.5 h, –20℃避光保存备用。
荧光原位杂交: 参照崔承齐等[41]的方法进行荧光原位杂交。首先以Fluorescein-12-dUTP标记的六倍体中间偃麦草基因组DNA为探针进行原位杂交, Carl Zeiss CCD获取图像。将信号洗脱后再在同一张制片上以Digoxinin-11-dUTP 标记的质粒pSc119.2和Biotin-16-dUTP标记的质粒pAs1进行双色荧光原位杂交, 用DAPI (4’,6-diamidino-2-phenylindole)染色。采用Carl Zeiss CCD和Axiovision Rel. 4.8 (Zeiss, Oberkochen, Germany)采集并分析图像。
1.4 序列特异扩增区域 (sequence-characterized amplified region, SCAR)标记的开发及有效性
SDS法提取F3姊妹系自交3代后不同株系的DNA。使用正向、反向各10对随机设计的RAPD引物[42]进行组合, 每个引物对分别在退火温度46、50和54℃进行PCR扩增。RAPD引物TP7F (5′-CAGGCCCTTCAT-3′) / TP2R (5′-GTGTGCCCCA AC-3′)、SCAR标记引物D-1F (5′-ACTTGCTCCTG AAGCCATCA-3′) / D-2R (5′-AAGTGAAGCCCAG CAAGCG-3′)均委托生工生物工程(上海)股份有限公司合成。25 µL PCR反应体系: 模板DNA 100 ng、10× PCR buffer 2.5 μL、2.5 mmol L‒1dNTPs 2 μL、5 U μL‒1DNA聚合酶0.3 µL、10 μmol L‒1引物2 µL、ddH2O加至25 μL。PCR反应程序: 94℃预变性5 min; 94℃变性30 s, 46℃/50℃/54℃退火30 s, 72℃延伸1 min, 35个循环; 72℃再延伸10 min。2%琼脂糖凝胶电泳检测, 筛选特异片段切胶回收, 由生工生物工程(上海)股份有限公司测序。将序列结果与GenBank中已知的小麦序列进行比对, 当同源性低于50%时, 将其视为中间偃麦草染色体特异序列, 根据特异序列利用Primer 5.0软件设计SCAR标记。
为了验证所开发SCAR标记与苗期条锈病抗性的关系, 条锈菌(CYR32和CYR34)对ZH811×ZH577的DH群体共80个株系进行抗性检测, 验证SCAR标记的有效性。DH群体CYR32和CYR34的接种试验委托西北农林科技大学旱区作物逆境生物学国家重点实验室完成。
1.5 ZH811农艺性状调查
2016—2017和2017—2018年度, 在山西省临汾市尧都区小麦研究所韩村试验基地(36°06′24″N, 111°30′55″E)进行ZH811、ZH577和ZH811×ZH577 DH群体80个株系的农艺性状检测。田间种植采用随机区组试验设计, 3次重复; 小区行长2 m, 株距10 cm, 行距25 cm, 记录抽穗期和成熟期, 每个重复小区随机选取10株对株高、穗长、小穗数、穗粒数和千粒重等性状进行调查。为明确5D易位片段与主要农艺性状的关系, 对DH群体80个株系的千粒重、穗粒数、小穗数和株高进行分析。
1.6 ZH811 HMW-GS的鉴定及品质分析
参照赵佳佳等[43]方法进行HMW-GS鉴定和品质分析。随机选取ZH811、晋麦33号、师栾02-1、烟农19和中国春各个品种(系) 3~5粒种子用于谷蛋白的提取, 采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)方法测定HMW-GS组成, 对照品种为中国春(Null, 7+8, 2+12)、师栾02-1 (1, 7+9, 5+10)以及烟农19 (1, 17+18, 5+10)。
DA7200型近红外仪(瑞典Perten)测定籽粒蛋白质含量; 旋风磨3100 (Perten, Sweden)磨粉, 出粉率为70%左右; 润麦加水量为16.5%, 时间16~18 h, 磨粉后用于Zeleny沉降值、粉质及拉伸参数的测定。德国Brabender公司摇床按照AACC 56-63方法测定Zeleny沉降值, 结果校正到14%水分含量。德国Brabender公司生产的粉质仪和拉伸仪, 分别按照AACC-54-21和AACC-54-10方法测定面团形成时间、稳定时间、延伸性、最大抗延阻力以及拉伸面积等参数。参照国标小麦品种品质分类(GB/T 177320-2013)中各品质指标对应的强筋、中强筋、中筋和弱筋的分类标准, 评价ZH811的强筋类型。
1.7 数据分析
应用Microsoft Excel 2016对数据进行整理和计算, 利用SPSS 22.0软件进行数据统计分析, 采用最小显著差数(LSD)法进行差异显著性检验。
2 结果与分析
2.1 易位系ZH811抗条锈性状的来源与遗传分析
中间偃麦草Z1141和ZH811对条中29、31、32、33、34号以及水源4、5、7号条锈菌生理小种的混合菌种均表现近免疫或高抗, 而中国春、晋麦33和临4133以及ZH577对混合菌均表现高感, 表明ZH811苗期具有较强的条锈病抗性, 由其系谱分析推测抗条锈基因可能来自于中间偃麦草Z1141 (图1)。
苗期抗病性鉴定结果显示ZH811×ZH577正反交F2及BC1群体单株出现抗感分离。其中正反交F2群体的抗感分离均符合3∶1分离比(2分别为0.12和0.01), 而BC1群体符合1∶1分离比(表2), 说明ZH811的抗病性状是由显性单基因控制。
2.2 易位系ZH811的细胞学鉴定
ZH811和ZH577均为42条染色体。以六倍体中间偃麦草基因组DNA为探针、中国春基因组DNA为封阻的原位杂交结果显示, ZH811携带的易位片段在染色体端部有绿色信号(图2-A), 调节探针与封阻DNA的比例后没有发现其他外源片段。利用pAS1和pSC119.2区分染色体时, 外源易位片段位于小麦5D染色体短臂端部(图2-B)。ZH577、晋麦33和临4133中也均未检测到外源易位片段(图2-C~F), 说明ZH811中的易位片段来源于中间偃麦草。ZH811表现为高抗条锈病, 推测易位片段含有抗病基因, 将该基因暂命名为。
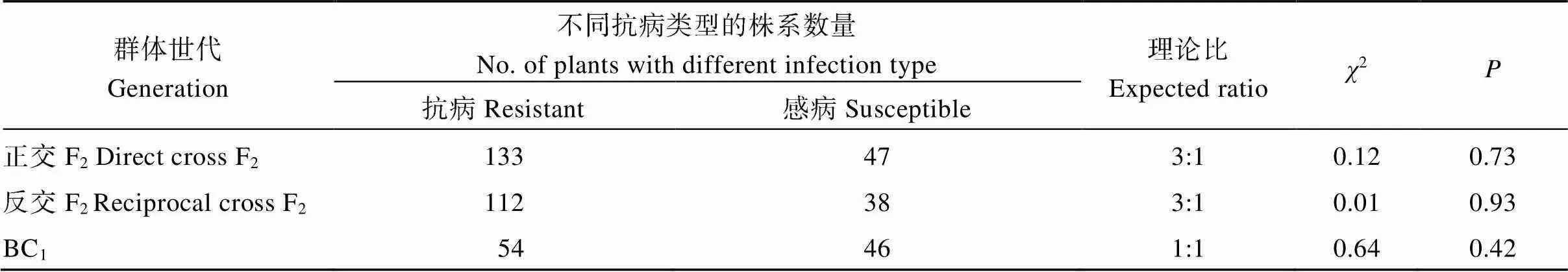
表2 ZH811和ZH577后代群体中抗、感单株数和分离比适合性检验
A, C, E: 利用中国春基因组做封阻, 中间偃麦草基因组为探针的GISH分析; B, D, F: 利用探针pAs1 (绿色信号)和pSc119.2 (红色信号)进行FISH分析。白色箭头指示小麦–中间偃麦草易位片段(A)和5D染色体(B~F)。标尺为10 μm。
A, C, E: GISH using genomic DNA ofas probe, genomic DNA of Chinese Spring as block. B, D, F: FISH using probespAs1 (green signal) and pSc119.2 (red signal). Arrows show the wheat–chromosome translocations (A) or chromosome 5D (B–F). Bar = 10 μm.
2.3 特异性序列扩增标记SCAR的开发及抗病有效性检测
利用RAPD引物对TP7F扩增时, ZH811和ZH577均能扩增出差异片段(图3-A); GenBank比对结果显示, 该片段没有与小麦基因组相似性高的序列, 推断其可能为偃麦草基因组序列(GenBank登录号为MN840590)。利用SCAR标记引物对扩增时, ZH811、二倍体长穗偃麦草(EeEe)和中间偃麦草(StStEeEeEbEb)均能够扩增出180 bp目的条带, 而ZH577、百萨偃麦草(EbEb)和拟鹅观草(StSt)以及小麦亲本中未扩增出目的条带(图3-B), 表明ZH811的5D染色体易位片段来自Ee基因组, SCAR可以作为含有易位片段的鉴定标记。
SCAR标记的抗病有效性检测结果显示, ZH811×ZH577 DH群体的80个株系中, 44个株系含有易位片段的株系表现为抗病, 36个株系不含易位片段的株系均为感病, 经卡方分析抗感比接近1∶1 (2=0.80,=0.37), 证明了ZH811的苗期抗性来源于易位片段(图4)。此外, 含有易位片段的株系均为黑芒, 可作为易位片段鉴定的形态标记。
A: ZH811和ZH577的RAPD扩增(对应泳道从左到右分别是DL2000 marker、ZH811和ZH577退火温度46℃扩增、ZH811和ZH577退火温度50℃扩增、ZH811和ZH577退火温度54℃扩增); 白色箭头指示ZH811和ZH577扩增出的差异条带; B: SCAR标记不同材料中的扩增结果(对应泳道从左到右分别是DL2000 marker、ZH811、ZH577、中国春CS、临4133、晋麦33、中间偃麦草ZH1141、二倍体长穗偃麦草PI98526、百萨偃麦草PI531712、拟鹅观草PI313960、ddH2O);
A: RAPD analysis of ZH811 and ZH577 (The corresponding lanes from left to right are DL2000 marker, ZH811 and ZH577 withmat 46℃, ZH811 and ZH577 withmat 50℃, ZH811 and ZH577 withmat 54℃; Arrows show the differential band amplified between ZH811 and ZH577; B: PCR patterns of SCAR marker (The corresponding lanes from left to right are DL2000 marker, ZH811, ZH577, CS, Lin 4133, Jinmai 33,ZH1141,PI98526,PI531712,, ddH2O).
2.4 易位系ZH811的农艺性状表现
ZH811和ZH577均为半冬性, 全生育期240 d左右, 千粒重40 g以上, 株高为70~80 cm之间。植株健壮, 叶色偏深, 主要农艺性状接近当前推广品种; 此外, ZH811为黑芒, 而ZH577为白芒(图5)。ZH811穗粒数显著多于非易位ZH577 (<0.05), 株高、小穗数和穗长也略有增加。
DH群体80个株系中, 含有易位片段的44个株系和不含有易位片段的36个株系, 平均穗粒数分别为46.4个和42.6个, 两者之间差异显著(<0.05); 含易位株系的平均株高(74.49 cm)和平均小穗数(20.24个), 高于不含易位株系的平均株高(73.26 cm)和平均小穗数(20.12个), 但差异不显著。含有易位片段株系和不含易位片段株系的千粒重分别为44.68 g和45.29 g, 差异不显著(图6), 说明除条锈抗性外, 易位片段还具有增加穗粒数的效应。
*,< 0.05
2.5 ZH811的品质检测以鉴定易位片段的品质性状遗传效应
SDS-PAGE检测表明, ZH811和ZH577的HMW-GS类型是“1, 17+18, 5+10”,、和位点均为优质亚基(图7)。
ZH811的蛋白质含量、沉降值、湿面筋含量、形成时间、稳定时间、最大拉伸阻力和拉伸面积分别为14.57%、30.25 mL、32.87%、5.82 min、7.88 min、368.00 E.U.和88.00 cm2, ZH577分别为14.96%、32.84 mL、32.26%、5.75 min、8.15 min、342.00 E.U.和89.00 cm2, 两者之间差异不显著, 但均显著高于对照良星99, 表明易位片段中没有降低品质的连锁累赘。各项品质指标均优于对照良星99, 粗蛋白含量(干基)、湿面筋含量、稳定时间、最大拉伸阻力均达到中强筋的标准(表3)。
3 讨论
本文通过小麦与中间偃麦草杂交, 获得了偃麦草的Ee染色体与小麦的5D染色体产生自发易位的抗病材料。Hu等[44]报道了来源于十倍体长穗偃麦草染色体6Js抗条锈基因的6Js(6B)代换系X005; 还有十倍体长穗偃麦草St基因组小片段染色体易位到小麦4D染色体产生的抗条锈病材料[45], 目前尚未见到有5D染色体与Ee基因组易位的抗性材料, 推测可能是新的抗条锈基因。
从左到右依次为师栾02-1 (SL02-1)、ZH811、烟农19 (YN19)、晋麦33号(JM33)、中国春(CS)。图中数字表示各条带代表的高分子量麦谷蛋白亚基类型。
The corresponding lanes from left to right are Shiluan 02-1 (SL02-1), ZH811, Yannong 19 (YN19), Jinmai 33 (JM33), and Chinese Spring (CS). The numbers in this figure indicate the types of HMW-GS represented by each band.
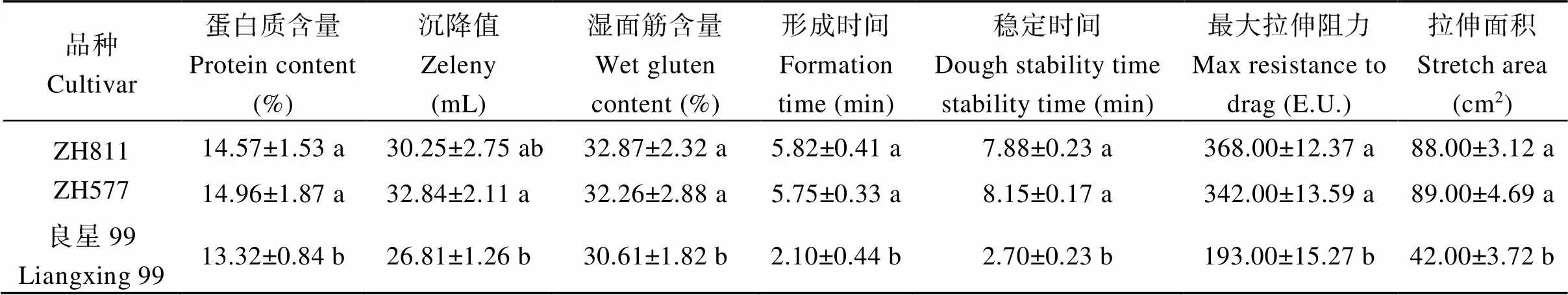
表3 不同材料的品质性状
表中数据为平均数±标准误。同列不同小写字母表示经LSD法检验在< 0.05水平差异显著。
Data are means ± SE. Different lowercase letters in the same column indicate significant difference at< 0.05 by LSD test.
缺少特异标记是众多易位系难以应用于生产的限制因素, 由于缺乏有效标记, 导致这些材料很难在选育过程中被追踪。本文通过RAPD获得了易位片段的SCAR标记, 可以直接用于抗病分子标记辅助育种。形态学标记包括可被观测到的茎、叶、穗和籽粒的色泽、性状或大小。李振声等[46]利用4E染色体蓝色胚乳标记用于蓝粒单体系的培育, Miller和Reader[47]利用远缘种质将紫胚芽鞘和紫秆性状定位于第七同源群染色体短臂, 将红粒及脆穗轴基因定位在第三同源群上, 将黑颖壳基因定位于第一同源群上; 李淑梅等[48]利用护颖颖基刚毛性状辨认含有簇毛麦2V短臂的杂交后代; Xin等[49]利用芽鞘颜色分离中间偃麦草7Ai-1上抗黄矮病基因, 并利用籽粒形状, 长芒、短芒作为形态标记。关于芒色作为形态标记的研究比较少见, 有研究表明在1A染色体上,与红颖基因和护颖茸毛基因连锁, 因此携带材料会出现黑芒、护颖茸毛性状[50-51]。ZH811易位片段具有的黑芒特性可作为形态标记, 与分子标记相比, 形态标记在田间观察更为简便直接, 也便于在发病不充分的地区进行育种选择; 此外, 目前关于小麦芒色基因的报道较少, 目前仅在小麦1AS和1D染色体上定位到控制芒色的基因[52-53], ZH811也为芒色基因的克隆提供了材料。
目前源于黑麦、簇毛麦的抗病基因、和被广泛用于小麦育种和生产。然而, 外源抗病材料的利用仍然较少。究其原因, 一是外源染色体臂或区段常导致易位系细胞学不稳定, 二是连锁累赘大大降低了利用价值。如1BL/1RS易位系已在世界范围广泛推广, 大大提高了材料的综合抗性和产量性状, 但连锁的黑麦碱基因严重影响了小麦品质[54]。ZH811是六倍体中间偃麦草染色体片段与小麦5D染色体产生的小片段易位品系, 具有苗期条锈病抗性高和增加穗粒数的优点。此外, ZH811的位点均为优质亚基, 未发现降低品质的连锁累赘, 在当前高产、优质和低耗的育种要求下具有较大利用价值。目前ZH811的苗期条锈病抗性得到准确鉴定, 该株系成株期综合农艺性状优良, 且具有特异的形态和分子标记, 可直接用于高产、抗病和优质小麦新品种的选育; 成株抗性利用在小麦抗病育种中尤为重要[55-56], 在选育过程中缺乏稳定的成株期鉴定条件, ZH811成株期抗性和相关抗性机制将是下一步研究的主要任务。
4 结论
本研究从普通小麦和六倍体中间偃麦草杂交、回交后代中鉴定出苗期高抗条锈病的易位系材料ZH811, 其抗性源于5D染色体短臂含有来源于Ee基因组的小片段易位。ZH811的主要农艺性状接近当前黄淮北片麦区的主推品种, 各项品质指标达到中强筋的标准, 可为培育高产、抗病和优质小麦新品种提供重要的中间材料。
致谢 感谢云南省农业科学院顾坚研究员在DH群体构建过程, 以及西北农林科技大学王琪琳博士在材料条锈病鉴定中给予的帮助和支持。
[1] 康振生, 王晓杰, 赵杰, 汤春蕾, 黄丽丽. 小麦条锈菌致病性及其变异研究进展. 中国农业科学, 2015, 48: 3439–3453. Kang Z S, Wang X J, Zhao J, Tang C L, Huang L L. Advances in research of pathogenicity and virulence variation of the wheat stripe rust fungusf. sp., 2015, 48: 3439–3453(in Chinese with English abstract).
[2] 陈万权, 康振生, 马占鸿, 徐世昌, 金社林, 姜玉英. 中国小麦条锈病综合治理理论与实践. 中国农业科学, 2013, 46: 4254–4262. Chen W Q, Kang Z S, Ma Z H, Xu S C, Jin S L, Jiang Y Y. Integrated management of wheat stripe rust caused byf. sp.in China., 2013, 46: 4254–4262 (in Chinese with English abstract).
[3] 李振岐, 曾士迈. 中国小麦锈病. 北京: 中国农业出版社, 2002. Li Z Q, Zeng S M. Wheat Rusts in China. Beijing: China Agriculture Press, 2002 (in Chinese).
[4] 韩德俊, 康振生. 中国小麦品种抗条锈病现状及存在问题与对策. 植物保护, 2018, 44(5): 6–17. Han D J, Kang Z S. Current status and future strategy in breeding wheat for resistance to stripe rust in China., 2018, 44(5): 6–17 (in Chinese with English abstract).
[5] McIntosh R, Mu J M, Han D J, Kang Z S. Wheat stripe rust resistance gene: a retrospective review., 2018, 6: 321–329.
[6] Cruz C D, Peterson G L, Bockus W W, Kankanala P, Dubcovsky J, Jordan K W, Akhunov E, Chumley F, Baldelomar F D, Valent B. The 2NS translocation fromconfers resistance to thepathotype of., 2016, 56: 990–1000
[7] 董玉琛. 小麦的基因源. 麦类作物学报, 2000, 20(3): 78–81. Dong Y C. Gene pool of common wheat., 2000, 20(3): 78–81 (in Chinese with English abstract).
[8] 李振声, 容珊, 钟冠昌, 陈漱阳, 穆素梅. 小麦远缘杂交. 北京: 科学出版社, 1985. Li Z S, Rong S, Zhong G C, Chen S Y, Mu S M. Wheat Wild Hybridization. Beijing: Science Press, 1985 (in Chinese).
[9] 李万隆, 李振声. 小麦品种小偃6号染色体结构变异的细胞学研究. 遗传学报, 1990, 17: 430–437. Li W L, Li Z S. A cytological study of chromosomal structure changes in a common wheat variety, Xiaoyan No. 6., 1990, 17: 430–437 (in Chinese with English abstract).
[10] Guo J, Zhang X, Hou Y, Cai J, Kong L. High-density mapping of the major FHB resistance genederived fromand its pyramiding withby marker-assisted selection., 2015, 128: 2301–2316.
[11] 李立会, 张锦鹏, 杨欣明, 刘伟华, 李秀全, 韩海明, 周升辉. 小麦与冰草属间远缘杂交及新种质创制研究进展. 见: 第十届全国小麦基因组学及分子育种大会摘要集, 2019. p 54. Li L H, Zhang J P, Yang X M, Liu W H, Li X Q, Han H M, Zhou S H. Research progress of wheat–wild hybridization and creation of new germplasms. In: The 10th National Conference on Wheat Genomics and Molecular Breeding, 2019. p 54. (in Chinese)
[12] Lupton F G H, Macer R C F. Inheritance of resistance to yellow rust (Erikss. & Henn.) in seven varieties of wheat., 1962, 45: 21–45.
[13] Riley R, Chapman V, Johnson R. Introduction of yellow rust resistance ofinto wheat by genetically induced homeologous recombination., 1968, 217: 378–384.
[14] Chen X M, Jones S S, Line R F. Chromosomal location of genes for stripe rust resistance in spring wheat cultivar Compare, Fielder, Lee and Lemhi and interactions of aneuploid wheats with races of., 1995, 143: 19–26.
[15] Zeller F J. 1B/1R wheat-rye chromosome substitutions and translocations. In: Sears E R, Sears L M S, eds. Proceedings of the 4thInternational Wheat Genetics Symposium. Missouri Agricultural Experiment Station, University of Missouri, Columbia, 1973. pp 209–221.
[16] Bariana H S, Parry N, Barclay I R, Loughman R, McLean R J, Shankar M, Wilson R E, Willey N J, Francki M. Identification and characterization of a new stripe rust resistance geneon rye chromosome 6R in wheat., 2006, 112: 1143–1148.
[17] Bariana H S, McIntosh R A. Cytogenetic studies in wheat: XV. Location of rust resistance genes in VPM1 and their genetic linkage with other disease resistance genes in chromosome 2A., 1993, 36: 476‒482.
[18] Singh R P, Nelson J C, Sorrells M E. Mappingand other genes for resistance to stripe rust in wheat., 2000, 40: 1148–1155.
[19] Marais G F, McCallum B, Snyman J E, Pretorius Z A, Marais A S. Leaf rust and stripe rust resistance genesandtransferred to wheat from., 2005, 124: 538–541.
[20] Marais G F, McCallum B, Marais A S. Leaf rust and stripe rust resistance genes derived from., 2006, 149: 373–380.
[21] Kuraparthy V, Chhuneja P, Dhaliwal H S, Kaur S, Bowden R L, Gill B S. Characterization and mapping of cryptic alien introgression fromwith new leaf rust and stripe rust resistance genesandin wheat., 2007, 114: 1379–1389.
[22] Marais F, Marais A, Mccallum B, Pretorius Z. Transfer of leaf rust and stripe rust resistance genesandfromReq. ex Bertol. to common wheat., 2009, 49: 871–879.
[23] 刘成. 小麦远缘杂交种质资源评价. 北京: 中国农业科学技术出版社, 2019. pp 185–279. Liu C. Evaluation of Wheat Germplasm Derived from Distant Hybridization. Beijing: China Agricultural Science and Technology Press, 2019. pp 185–279 (in Chinese).
[24] Friebe B, Jiang J, Knott D R, Gill B S. Compensation indices of radiation-induced wheat–translocations conferring resistance to leaf rust and stem rust., 1994, 34: 400–404.
[25] Zhan H X, Zhang X J, Li G R, Pan Z H, Hu J, Li X, Qiao L Y, Jia J Q, Guo H J, Chang Z J, Yang Z J. Molecular characterization of a new wheat–translocation line with resistance to powdery mildew and stripe rust., 2015, 16: 2162–2173.
[26] Lang T, La M S, Li B, Yu Z H, Chen Q H, Li J B, Yang E N, Li G R, Yang Z J. Precise identification of wheat–translocation chromosomes carrying resistance to wheat stripe rust in line Z4 and its derived progenies., 2018, 61: 177–185.
[27] Han F P, Liu B, Fedak G, Liu Z H. Genomic constitution and variation in five partial amphiploids of wheat–as revealed by GISH, multicolor GISH and seed storage protein analysis., 2004, 109: 1070–1076.
[28] Tang X Q, Shi D, Xu J, Li Y L, Li W J, Ren Z L, Fu T H. Molecular cytogenetic characteristics of a translocation line between common wheat andwith resistance to powdery mildew., 2014, 197: 201–210.
[29] Fedak G, Chen Q, Conner R L, Laroche A, Petroski R, Armstrong K W. Characterization of wheat–partial amphiploids by meiotic analysis and genomichybridization., 2000, 43: 712–719.
[30] Yang Z J, Li G R, Chang Z J, Zhou J P, Ren Z L. Characterization of a partial amphiploid betweencv. Chinese Spring andssp. trichophorum., 2006, 149: 11–17.
[31] Chang Z J, Zhang X J, Yang Z J, Zhan H X, Li X, Liu C, Zhang C Z. Characterization of a partial wheat–amphiploid and its reaction to fungal diseases of wheat., 2010, 147: 304–312.
[32] Bao Y, Li X, Liu S, Cui F, Wang H. Molecular cytogenetic characterization of a new wheat–partial amphiploid resistant to powdery mildew and stripe rust., 2009, 126: 390–395.
[33] 杨敏娜, 徐智斌, 王美南, 宋建荣, 井金学, 李振岐. 小麦品种中梁22抗条锈病基因的遗传分析和分子作图. 作物学报, 2008, 34: 1280–1284. Yang M N, Xu Z B, Wang M N, Song J R, Jing J X, Li Z Q. Genetic analysis and molecular mapping of stripe rust resistance gene in wheat cultivar Zhongliang 22., 2008, 34: 1280–1284 (in Chinese with English abstract).
[34] Liu J, Chang Z J, Zhang X J, Yang Z J, Li X, Jia J Q, Zhan H X, Guo H J, Wang J M. Putative-derived stripe rust resistance genemaps on wheat chromosome arm 4BL., 2013, 126: 265–274.
[35] Hou L, Jia J, Zhang X, Li X, Yang Z, Ma J, Guo H, Zhan H, Qiao L, Chang Z. Molecular mapping of the stripe rust resistance geneon wheat chromosome 2AS., 2016, 100: 1717–1724.
[36] 詹海仙, 畅志坚, 李光蓉, 贾举庆, 郭慧娟, 张晓军, 李欣, 乔麟轶, 杨足君. 小麦新抗源CH5383抗条锈病基因的遗传分析及分子定位. 生物技术通报, 2014, 6: 96–100. Zhan H X, Chang Z J, Li G R, Jia J Q, Guo H J, Zhang X J, Li X, Qiao L Y, Yang Z J. Genetic analysis and molecular mapping of stripe rust resistance gene in wheat line CH5383., 2014, 6: 96–100 (in Chinese with English abstract).
[37] Huang Q, Li X, Chen WQ, Xiang Z P, Zhong S F, Chang Z J, Zhang M, Zhang H Y, Tan F Q, Ren Z L, Luo P G. Genetic mapping of a putative-derived stripe rust resistance gene on wheat chromosome 1B., 2014, 127: 843–853.
[38] 侯丽媛, 乔麟轶, 张晓军, 李欣, 詹海仙, 畅志坚. 抗条锈病基因的遗传分析及分子定位. 华北农学报, 2015, 30(5): 7–15. Hou L Y, Qiao L Y, Zhang X J, Li X, Zhan H X, Chang Z J. Genetic analysis and molecular mapping of a stripe rust resistance gene., 2015, 30(5): 7–15 (in Chinese with English abstract).
[39] 吴建辉. 基于BSR-Seq和芯片技术的抗条锈基因候选基因分析及普通小麦成株期抗条锈QTL定位. 西北农林科技大学博士学位论文, 陕西杨凌, 2017. Wu J H. QTL Mapping for Adult-plant Resistance to Stripe Rust in Common Wheat and Candidate Gene Analysis ofBased on BSR-seq and SNP Array. PhD Dissertation of Northwest A&F University, Yangling, Shaanxi, China, 2017 (in Chinese with English abstract).
[40] Line R F, Qayoum A. Virulence, aggressiveness, evolution and distribution of races of(the cause of stripe of wheat) in North America, 1968–1987. U.S. Department of Agriculture Technical Bulletin No. 1788, 1992, 44.
[41] 崔承齐, 王林生, 陈佩度. 普通小麦-大赖草易位系T7BS·7Lr#1S和T2AS·2AL-7Lr#1S的分子细胞遗传学鉴定. 作物学报, 2013, 39: 191–197. Cui C Q, Wang L S, Chen P D. Molecular and cytogenetic identification of–translocation lines T7BS·7Lr#1S and T2AS·2AL-7Lr#1S., 2013, 39: 191–197 (in Chinese with English abstract).
[42] Zhang X Y, Dong Y S, Wang R R C. Characterization of genomes and chromosomes in partial amphiploids of the hybrid×byhybridization, isozyme analysis, and RAPD., 1996, 39: 1062–1071.
[43] 赵佳佳, 乔玲, 郑兴卫, 李晓华, 曹勇, 马小飞, 杨斌, 姬虎太, 乔麟轶, 郑军, 张建诚. 山西小麦育成品种品质性状及HMW-GS组成演变分析. 植物遗传资源学报, 2018, 19: 1126–1137. Zhao J J, Qiao L, Zheng X W, Li X H, Cao Y, Ma X F, Yang B, Ji H T, Qiao L Y, Zheng J, Zhang J C. Variation of quality-related traits and HMW-GS of wheat varieties in Shanxi province., 2018, 19: 1126–1137 (in Chinese with English abstract).
[44] Hu L J, Li G R, Zeng Z X, Chang Z J, Liu C, Yang Z J. Molecular characterization of a wheat–partial amphiploid and its derived substitution line for resistance to stripe rust., 2011, 52: 279–285.
[45] 郝薇薇, 汤才国, 李葆春, 郝晨阳, 张学勇. 小麦–十倍体长穗偃麦草广谱抗锈易位系的鉴定及分析. 中国农业科学, 2012, 45: 3240–3248. Hao W W, Tang C G, Li B C, Hao C Y, Zhang X Y. Analysis of wheat–translocation lines with broad spectrum resistance to stripe rusts., 2012, 45: 3240–3248 (in Chinese with English abstract).
[46] 李振声, 穆素梅, 蒋立训, 周汉平, 吴景科, 余玲. 蓝粒单体小麦研究(一). 遗传学报, 1982, 9: 431–439. Li Z S, Mu S M, Jiang L X, Zhou H P, Wu J K, Yu L. A study on blue-grained monosomic wheat (I)., 1982, 9: 431‒439 (in Chinese with English abstract).
[47] Miller T E, Reader S M. A guide to the homoeology of chromosomes within the., 1987, 74: 214–217.
[48] 李淑梅, 徐川梅, 周波, 陈佩度. 普通小麦–簇毛麦2V染色体端体异附加系的选育与鉴定. 南京农业大学学报, 2009, 32(1): 1–5. Li S M, Xu C M, Zhou B, Chen P D. Development and identification of–ditelosomic addition lines involving chromosome 2V of., 2009, 32(1): 1–5 (in Chinese with English abstract).
[49] Xin Z Y, Xu H J, Chen X. Research on introducing yellow dwarf resistance to common wheat using biotechnology.(Series B), 1991, 21: 36–42.
[50] McIntosh R A, Baker E P. Chromosome location and linkage studies involving thelocus for powdery mildew resistance in wheat., 1968, 93: 232–238.
[51] Hsam N B O, Kowalczyk K, Zeller F J, Hsam S L KCharacterization of powdery mildew resistance and linkage studies involving thelocus on chromosome 1A of common wheat (L.)., 2015, 56:37–44.
[52] Borner A, Schumann E, Furste A, Coster H, Leithold B, Roder M S, Weber W E. Mapping of quantitative trait loci determining agronomic important characters in hexaploid wheat (L.)., 2002, 105: 921–936.
[53] Jing H C, Kornyukhin D, Kanyuka K, Orford S, Zlatska A, Mitrofanova O P, Koebner R, Hammond-Kosack K. Identification of variation in adaptively important traits and genome-wide analysis of trait-marker associations in., 2007, 58: 3749–3764.
[54] Chai J F, Liu X, Jia J Z. Homoeologous cloning of omega-secalin gene family in a wheat 1BL/1RS translocation., 2005, 15: 658–664.
[55] 杨芳萍, 刘金栋, 郭莹, 贾奥琳, 闻伟鄂, 巢凯翔, 伍玲, 岳维云, 董亚超, 夏先春. 普通小麦‘Holdfast’条锈病成株抗性QTL定位. 作物学报, 2019, 45: 1832–1840. Yang F P, Liu J D, Guo Y, Jiao A L, Wen W E, Chao K X, Wu L, Yue W Y, Dong Y C, Xia X C. QTL mapping of adult-plant resistance to stripe rust in wheat variety holdfast., 2019, 45: 1832–1840 (in Chinese with English abstract).
[56] 张怀志, 谢菁忠, 陈永兴, 刘旭, 王勇, 闫素红, 杨兆生, 赵虹, 王西成, 贾联合, 曹廷杰, 刘志勇. 利用BSR-Seq定位小麦品种郑麦103抗条锈病基因. 作物学报, 2017, 43: 1643–1649.Zhang H Z, Xie J Z, Chen Y X, Liu X, Wang Y, Yan S H, Yang Z S, Zhao H, Wang X C, Jia L H, Cao L J, Liu Z Y. Mapping stripe rust resistance genein wheat cultivar Zhengmai 103 by BSR-seq., 2017, 43: 1643–1649 (in Chinese with English abstract).
Identification of seedling resistance to stripe rust in wheat–translocation line and its potential application in breeding
WANG Yin1,**, FENG Zhi-Wei3,**, GE Chuan3, ZHAO Jia-Jia2, QIAO Ling2, WU Bang-Bang2, YAN Su-Xian2, ZHENG Jun2,3,*, and ZHENG Xing-Wei2,3,*
1Department of Natural Sciences, Shanxi Normal University, Linfen 041000, Shanxi, China;2Institute of Wheat Research, Shanxi Agricultural University, Linfen 041000, Shanxi, China;3College of Agriculture, Shanxi Agricultural University / Shanxi Key Laboratory of Crop Genetics and Molecular Improvement, Taiyuan 030000, Shanxi, China
There are abundant disease resistance resources in relative genus of wheat. The translocation line ZH811 derived from progeny of wheat andhybrids, was selected for evaluation of stripe rust resistance. A series of stripe rust races such as CYR29, CYR31, CYR32, CYR33, CYR34, Suwon-4, Suwon-5, and Suwon-7 were used to record stripe responses at seedling stage. Agronomical traits, quality traits, and molecular cytogenetic analysis were also performed. Moreover, specific molecular markers located on alien segment was developed by RAPD method. The results indicated that ZH811 was highly resistant to all tested races at seedling stage. And it further proved that the resistance was conferred by a small-fragment-translocation from the Eegenome on 5DS chromosome. The SCAR markers and black awn traits could be used to trace the translocation fragment. ZH811 possessed similar agronomic traits with the commercial cultivars in the Yellow-Huaihe-Haihe Rivers region of wheat. The translocation fragment may be associated with the increase of grain number. The components of thewere good-quality subunits, including 1, 17+18, and 5+10, and each quality index met the standard of moderate gluten. The alien chromosomal fragment had no obvious linkage drag to grain quality performance. Based on these findings, ZH811 could be used as a potential material for wheat breeding in high yield, disease resistance, and high quality.
stripe rust; translocation line; in situ hybridization; molecular marker
10.3724/SP.J.1006.2021.01082
本研究由中国博士后科学基金项目(2020M670701), 山西省重点研发计划项目(201903D221074, 201903D221075)和山西省重点实验室项目(201705D111008-22)资助。
This study was supported by the China Postdoctoral Science Foundation (2020M670701), the Key Research and Development Program in Shanxi Province (201903D221074, 201903D221075), and the Shanxi Key Laboratory Program (201705D111008-22).
郑兴卫, E-mail: smilezxw@126.com; 郑军, E-mail: sxnkyzj@126.com
**同等贡献(Contributed equally to this work)
王音, E-mail: wangyinstar@163.com
2020-10-22;
2021-01-13;
2021-03-02.
URL: https://kns.cnki.net/kcms/detail/11.1809.S.20210302.1431.002.html
