法舒地尔对TGF-β诱导尿道成纤维细胞增殖、迁移以及胞外基质合成的影响
2021-06-09黄小兵付卫华朱景振杨凤霞
冯 欢,黄小兵,付卫华,朱景振,李 佳,杨凤霞
(陆军军医大学第二附属医院泌尿外科中心,重庆 400037)
尿道狭窄是泌尿外科常见的疾病,伤口创面过度修复,形成增生性瘢痕,破坏尿道完整性,形成功能性狭窄,是尿道狭窄的诱因之一[1-3]。近年来,创伤性、炎症性、医源性尿道狭窄患者和手术后复发患者数量显著增加,术后2年内尿道狭窄的复发率为50%~70%[4]。尿道狭窄扩张手术—再狭窄的恶性循环使得尿道狭窄的临床治疗成为难题[5]。目前,尿道狭窄以药物治疗及尿道内切开手术治疗为主,但均存在远期疗效不佳、容易复发的缺点。因此,亟需寻找有效治疗尿道狭窄的药物。
尿道狭窄由尿道瘢痕增生引起,而转化生长因子-β(transforming growth factor-β,TGF-β)诱导的成纤维细胞增生是尿道瘢痕形成的关键因素[6-7]。成纤维细胞的主要作用是修复细胞,该过程受TGF-β调控[8-9]。尿道成纤维细胞在正常情况下处于静止状态,在尿道损伤时经TGF-β调控可进行表型转换。活化的成纤维细胞大量增殖,表现出较强的分泌和胶原沉积的能力,致使细胞外基质如胶原蛋白过度合成和沉积,最终导致尿道瘢痕形成。近年来有研究报道,法舒地尔在肺纤维化和尿道瘢痕形成中发挥了重要作用,参与肺成纤维细胞和尿道瘢痕成纤维细胞的表型转化以及胶原的异常合成[10-11]。本研究拟提取尿道狭窄家兔的原代尿道成纤维细胞,通过体外培养给药后,探究法舒地尔对尿道成纤维细胞迁移和增殖能力以及胞外基质合成的影响,以探索法舒地尔对TGF-β诱导的成纤维细胞转型的作用,为尿道狭窄的治疗提供实验依据。
1 材料与方法
1.1 材料
10%SDS-PAGE凝胶(Bio-Rad)、α-SMA抗体(Sigma)、Akt抗体(Sigma)、pAKT抗体(Sigma)、mTOR抗体(Sigma)、胶原蛋白Ⅰ抗体(CST)、胶原蛋白Ⅲ抗体(CST)、LC3抗体(CST)、E-钙黏蛋白抗体(CST)、波形蛋白抗体(CST)、纤维黏连蛋白抗体(CST)、N-钙黏蛋白抗体(CST)、ATG5抗体(CST)、ATG7抗体(Abcam)、IgG-HRP(Santa Cruz)二抗、DAPI(Beyotime)、侵袭小室(Millipore)。
1.2 方法
1.2.1 细胞培养 在无菌条件下获得家兔体内少量的尿道瘢痕组织,将组织标本洗涤并浸泡在平衡盐溶液中,然后切成大小为1 mm×1 mm×1 mm的标本[12-13]。将标本置于37 ℃、0.1%胶原酶中消化50 min后过滤,组织悬浮液以1 000 r/min离心5 min,在含20%灭活胎牛血清的DMEM培养液中复苏,获得原代尿道成纤维细胞,并采用免疫组织化学染色法进行细胞鉴定。取第3代细胞进行细胞爬片、固定、灭活过氧化物酶,按顺序滴加血清封闭液、波形蛋白(成纤维细胞的特异性标记蛋白)Ⅰ抗、Ⅱ抗及ABC复合物,以DAB显色,然后脱水、透明、封片,显微镜观察。成纤维细胞在DMEM培养基(含10%胎牛血清、青霉素100 μ/mL、链霉素100 μg/mL、丙酮酸10 mmol/L、谷酰胺10 mmol/L、非必需氨基酸20 mmol/L)中于37 ℃、5%CO2条件下培养。
1.2.2 Transwell实验检测细胞迁移 小室嵌片置于含2×104/L细胞的24孔板内,10 ng/mL TGF-β或50 μM法舒地尔与10 ng/mL TGF-β共同处理24 h,分为对照组、TGF-β组和法舒地尔(Fasu) 50 μM+TGF-β组。取出小室内庭,用PBS洗涤,4%多聚甲醛固定。内庭上部细胞用0.1%结晶紫染色。细胞迁移数量用Image J软件计算。
1.2.3 MTT实验检测细胞增殖 成纤维细胞按每孔2×103/L接种于96孔板,10 ng/mL TGF-β或50 μM法舒地尔与10 ng/mL TGF-β共同处理24 h,分为对照组、TGF-β组和Fasu 50 μM+TGF-β组。然后用5 mg/mL MTT溶液10 μL处理4 h,弃去培养液加入二甲基亚砜,并于570 nm处测量光密度值(OD值)。细胞增殖率=[(实验组OD值-空白组OD值)/(正常组OD值-空白组OD值)]×100%。
1.2.4 Western blot检测蛋白表达 测量细胞外基质蛋白和自噬相关蛋白表达情况时,成纤维细胞按每孔5×104/L接种于细胞皿,用10 ng/mL TGF-β或者联合不同浓度(0,25,50 μM)的法舒地尔共同处理24 h,分别设为对照组、TGF-β组、Fasu 25 μM+TGF-β组和Fasu 50 μM+TGF-β组。收集细胞,用冷PBS溶液洗2次,加入300 μL裂解液(10 mmol/L Tris-HCl pH 7.6、160 mmol/L NaCl、1 mmol/L EGTA、1%脱氧胆酸、1%Triton、0.1%SDS)于冰上裂解5 min后,以12 000 r/min离心30 min,上清液于-80 ℃储存。总蛋白用10%SDS-PAGE凝胶分离,并转移到PVDF膜上。分别孵育α-SMA蛋白、胶原蛋白Ⅰ、胶原蛋白Ⅲ、p62、LC3、ATG5、ATG7(1∶2 000稀释),4 ℃过夜,二抗用IgG-HRP室温孵育1 h。显影后用Image J软件计算蛋白浓度。测量细胞迁移相关蛋白以及AKT/mTOR信号通路相关蛋白时,成纤维细胞按每孔5×104/L接种于细胞皿,用10 ng/mL TGF-β或者联合50 μM法舒地尔共同处理24 h,分别设为对照组、TGF-β组、Fasu 50 μM组和Fasu 50 μM+TGF-β组。Western blot操作步骤除一抗孵育环节替换为波形蛋白、纤维黏连蛋白、N-钙黏蛋白、E-钙黏蛋白、Akt/PKB、pAKT、mTOR、pmTOR(1∶2 000稀释)等抗体稀释液,其余步骤一致。
1.3 统计学分析
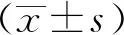
2 结果
2.1 法舒地尔对成纤维细胞外基质相关蛋白的影响
Western blot结果显示(图1),相比于对照组,TGF-β组的α-SMA蛋白、胶原蛋白Ⅰ和胶原蛋白Ⅲ表达明显增加(P<0.05)。相比于TGF-β组,其余各组的α-SMA蛋白、胶原蛋白Ⅰ和胶原蛋白Ⅲ等细胞外基质蛋白表达明显下降(P<0.05)。

a:Western blot电泳图;b:α-SMA相对表达量;c:胶原蛋白Ⅰ相对表达量;d:胶原蛋白Ⅲ相对表达量 *:与对照组比较,P<0.05;#:与TGF-β组比较,P<0.05
2.2 法舒地尔对成纤维细胞增殖、迁移的影响
Transwell实验结果显示(图2a~b),TGF-β组的细胞迁移数量显著高于对照组(P<0.05),Fasu 50 μM+TGF-β组的细胞迁移数量显著低于TGF-β组(P<0.05)。MTT结果实验显示(图2c),相比于TGF-β组,对照组及Fasu 50 μM+TGF-β组的细胞增殖率显著较低(P<0.05)。Western blot结果显示(图2d~h),相比于对照组,TGF-β组的波形蛋白、纤维黏连蛋白、N-钙黏蛋白表达显著上升,E-钙黏蛋白表达显著下降(P<0.05);相比于TGF-β组,Fasu 50 μM+TGF-β组的波形蛋白、纤维黏连蛋白、N-钙黏蛋白表达显著下降,E-钙黏蛋白表达显著上升(P<0.05)。
a:细胞迁移结晶紫染色图( ×20);b:细胞迁移数量定量分析;c:细胞增殖定量分析;d:Western blot电泳图;e:E-钙黏蛋白相对表达量;f:波形蛋白相对表达量:g:纤维黏连蛋白相对表达量;h:N-钙黏蛋白相对表达量 *:与对照组比较,P<0.05;#:与TGF-β组比较,P<0.05
2.3 法舒地尔对AKT/mTOR信号通路的影响
Western blot结果显示,相比于对照组,TGF-β组的pAKT蛋白表达显著下降(P<0.05),但pmTOR表达无统计学差异(P>0.05)。与TGF-β组相比,Fasu 50 μM+TGF-β组的pAKT和pmTOR蛋白表达明显上升P<0.05),见图3。
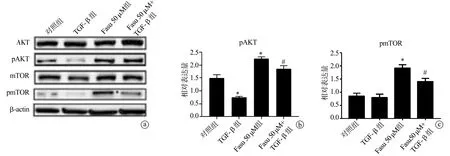
a:Western blot电泳图;b:pAKT蛋白相对表达量;c:pmTOR蛋白相对表达量 *:与对照组比较,P<0.05;#:与TGF-β组比较,P<0.05
2.4 法舒地尔对成纤维细胞自噬相关蛋白的影响
Western blot结果显示,相比于对照组,TGF-β组的ATG7、ATG5、LC3自噬相关蛋白表达显著上升(P<0.05),P62蛋白表达显著下降(P<0.05);相比于TGF-β组,Fasu 25 μM+TGF-β组和Fasu 50 μM+TGF-β组的ATG7、ATG5、LC3自噬相关蛋白表达明显下降(P<0.05),P62蛋白表达显著上升(P<0.05),见图4。

a:Western blot电泳图;b:ATG7蛋白相对表达量;c:ATG5蛋白相对表达量;d:P62蛋白相对表达量;e:LC3蛋白相对表达量 *:与对照组比较,P<0.05;#:与TGF-β组比较,P<0.05
3 讨论
尿道狭窄是一种慢性创伤性疾病,其特征是尿道内纤维组织的形成增加。其病理过程包括创面过度修复,尿道黏膜及海绵体组织纤维化,尿道腔增生、压迫或堵塞,最终导致尿道梗阻等功能紊乱[14]。尿道瘢痕狭窄的形成是瘢痕成纤维细胞、细胞因子和细胞外基质共同作用的结果。细胞外基质含有蛋白质、多糖等大分子物质,包括胶原蛋白、弹力蛋白、纤维蛋白、蛋白多糖等,这些生物大分子的无序合成和降解最终导致瘢痕形成[15]。因此,抑制成纤维细胞的异常生物学活性和基质在瘢痕组织中的过表达是预防瘢痕组织增生挛缩的有效途径。
尿道瘢痕成纤维细胞是尿道狭窄主要的效应细胞[16],其增殖和迁移在尿道瘢痕形成中具有重要意义。TGF-β可以诱导纤维细胞增殖、迁移。除此之外,TGF-β可诱导尿道成纤维细胞转换成肌成纤维细胞,增加α-SMA蛋白的合成和表达,α-SMA蛋白和胶原蛋白的过表达是尿道瘢痕形成的主要原因[17]。α-SMA蛋白组成细胞骨架基本结构,是成纤维细胞转换成肌成纤维细胞的特殊标志。尿道损伤后TGF-β诱导α-SMA蛋白表达并促进其转换[18-19]。同时胶原蛋白Ⅰ和胶原蛋白Ⅲ是胞外基质的主要成分。尿道狭窄海绵体由83.9%的胶原蛋白Ⅰ和16.1%的胶原蛋白Ⅲ组成[20]。本研究中TGF-β显著提高了α-SMA蛋白、胶原蛋白Ⅰ和胶原蛋白Ⅲ的表达量,促进了细胞迁移和增殖,与上述研究结果一致。进一步研究发现,法舒地尔的各个剂量组显著降低了α-SMA蛋白、胶原蛋白Ⅰ和胶原蛋白Ⅲ的表达量,从而抑制了成纤维细胞向肌成纤维细胞转化,高浓度的法舒地尔明显抑制了TGF-β刺激下成纤维细胞的增殖与迁移能力。同时本研究观察到经法舒地尔处理后,波形蛋白、纤维黏连蛋白、N-钙黏蛋白表达显著下降,E-钙黏蛋白表达显著上升,提示法舒地尔也抑制了TGF-β诱导的成纤维细胞向肌成纤维细胞转换。
自噬是细胞再利用细胞内组分包括大分子来维持细胞稳态的分解代谢通路,近年来发现,其在纤维化疾病的发生发展过程中也发挥了极大的作用[21]。AKT/mTOR信号通路是一个重要的真核细胞通路,可以参与到免疫抑制、细胞增殖、凋亡以及自噬等过程。研究表明,mTOR介导的自噬途径可以抑制成纤维细胞增殖,预防硬膜外纤维化粘连[22]。Kiyono等[23]证明通过调节AMPK驱动的AKT/mTOR和TGF-β/SMAD3通路可以缓解异丙肾上腺素诱导的心肌纤维化。在肝肿瘤细胞和哺乳动物肿瘤细胞中TGF-β可以快速刺激细胞自噬,但具体机制尚不明确。He等[24]的研究证明TGF-β诱导的纤维形成可以被PI3K/AKT/mTOR介导的自噬抑制。本研究结果显示,TGF-β组的pAKT、pmTOR和p62蛋白表达显著下降,ATG7、ATG5、LC3等自噬相关蛋白上调,提示自噬过程被抑制;而法舒地尔不仅上调了pAKT、pmTOR、p62等蛋白,抑制了ATG7、ATG5、LC3等自噬相关蛋白,同时还抑制了成纤维细胞的增殖、迁移以及胞外基质合成,表明法舒地尔可以通过激活AKT/mTOR信号通路激活自噬,进而抑制TGF-β诱导的成纤维细胞转型。
综上所述,本实验初步证实了法舒地尔可以通过激活AKT/mTOR介导的自噬从而抑制TGF-β诱导的成纤维细胞增殖、迁移以及胞外基质合成,提示法舒地尔可能在尿道狭窄中发挥治疗作用。
