磁共振影像特征评价较低级别胶质瘤患者预后的临床价值
2021-06-09孙涛湛允波阎静刘献志
孙涛 湛允波 阎静 刘献志
郑州大学第一附属医院神经外科 郑州 450052
较低级别胶质瘤包括WHO Ⅱ级和Ⅲ级浸润性胶质瘤,其生物学习性多样、临床行为可变,给治疗和预后评价带来了很大挑战[1]。异柠檬酸脱氢酶(isocitrate dehydrogenase,IDH)突变存在于超过70%的Ⅱ级、Ⅲ级胶质瘤中,预示着患者有更好的临床预后[2]。1p/19q联合缺失为少突胶质细胞瘤的分子标志物,预示着肿瘤性质相对稳定、患者预后较好[3]。根据这两个重要的分子标志物,一项来自对癌症基因图谱(The Cancer Genome Atlas, TCGA)数据库的研究将较低级别胶质瘤分为三个不同的预后组:IDH突变和1p/19q联合缺失组、IDH突变和1p/19q非联合缺失组,以及IDH野生型组[4]。2016 WHO中枢神经系统肿瘤分类也首次将IDH突变、1p/19q联合缺失这两个分子参数纳入肿瘤的分类中,确立了分子病理在脑胶质瘤诊断、分类和预后评估等方面的地位[5]。尽管分子病理在判断脑胶质瘤患者预后方面有了很大进展,但这些基因信息需要手术或穿刺获取肿瘤组织标本,会给患者带来创伤和痛苦。因此,一种安全、便捷的检查方法就显得十分重要。MRI作为脑肿瘤诊断的一种可靠、无创、无辐射的检查方法[6],在预测脑胶质瘤级别、IDH突变和1p/19q联合缺失状态等方面均有较好的准确性[7]。本研究分析肿瘤的部位、强化程度,以及肿瘤周围有无卫星灶等影像学特征与较低级别胶质瘤患者生存时间的关系,以探讨MRI影像特征在较低级别胶质瘤中的预后价值。
1 材料与方法
1.1一般资料收集2012-01—2016-12在我院接受手术治疗的119例Ⅱ级、Ⅲ级脑胶质瘤患者的资料,包括性别、年龄、术前生存质量(KPS)评分、切除程度、组织学分级、分子病理和辅助治疗等。术前均在本院接受MRI检查,且检查资料完整。患者一般情况良好,均为首次手术,术前未接受化疗或放疗。患者均签署知情同意书。
1.2方法
1.2.1 MRI检查 采用德国西门子公司生产的Skyra 3.0 T磁共振成像仪扫描。共有T1WI序列、T2WI序列、FLAIR序列、ADC序列、DWI序列、T1WI增强序列等。其中T1WI增强序列使用江苏恒瑞公司生产的钆特酸葡胺作为增强剂。扫描操作均由我院磁共振技师完成。
1.2.2 图像分析 由2名高年资磁共振科医师分别进行图像分析。他们并不知晓患者的年龄、生存时间和肿瘤的级别等临床信息,评估结果不一致时协商解决。评估MRI特征包括:(1)肿瘤的部位,分别为额叶、颞叶、顶叶、岛叶和枕叶。(2)肿瘤是否累及大脑功能区。(3)肿瘤的强化程度,分别为无强化、轻度强化和明显强化。(4)强化部分是否跨中线。(5)肿瘤是否为囊性。(6)T1/FLAIR的比例,包括T1与FLAIR近似相等、T1略小于FLAIR、T1远小于FLAIR。(7)肿瘤是否侵犯脑室。(8)肿瘤周围是否有卫星灶。(9)肿瘤是否侵犯颅骨。
1.2.3 随访方法 通过电话和门诊进行随访。总生存期(OS)指手术与死亡或随访结束之间的间隔时间。无进展生存期(PFS)指从诊断之日到疾病复发、死亡或最后随访的日期之间的间隔时间。
1.3统计学分析使用SPSS 22.0版本进行统计学分析。单因素分析采用Kaplan-Meier法,各预后因素生存率的比较采用Log-rank检验。考虑到年龄、术前KPS评分、切除程度、术后放化疗、肿瘤的分级和分子病理为影响预后的临床病理因素,将单因素分析中有意义的影像特征和临床病理因素共同进行多因素分析,多因素分析采用COX回归。P<0.05为差异有统计学意义。
2 结果
2.1临床病理特征119例患者中,男61例(51.3%),女58例(48.7%);中位年龄44岁。完全切除90例(75.6%),不完全切除29例(24.4%)。93例患者(78.2%)接受术后放疗,96例患者(80.7%)接受术后化疗。119例患者均有分子病理信息。其中,IDH突变型76例,IDH野生型43例;1p/19q联合缺失48例,1p/19q非联合缺失71例。(IDH,1p/19q为两个不同的分子病理)。
2.2单因素、多因素生存分析单因素分析发现,肿瘤的强化程度、强化部分是否跨中线、T1/FLAIR的比例、肿瘤是否侵犯脑室,以及肿瘤周围是否有卫星灶,均为较低级别胶质瘤患者OS与PFS的预后因素。见表1。多因素COX回归分析发现,肿瘤的强化程度及肿瘤周围是否有卫星灶,为较低级别胶质瘤患者预后的独立危险因素。见表2。
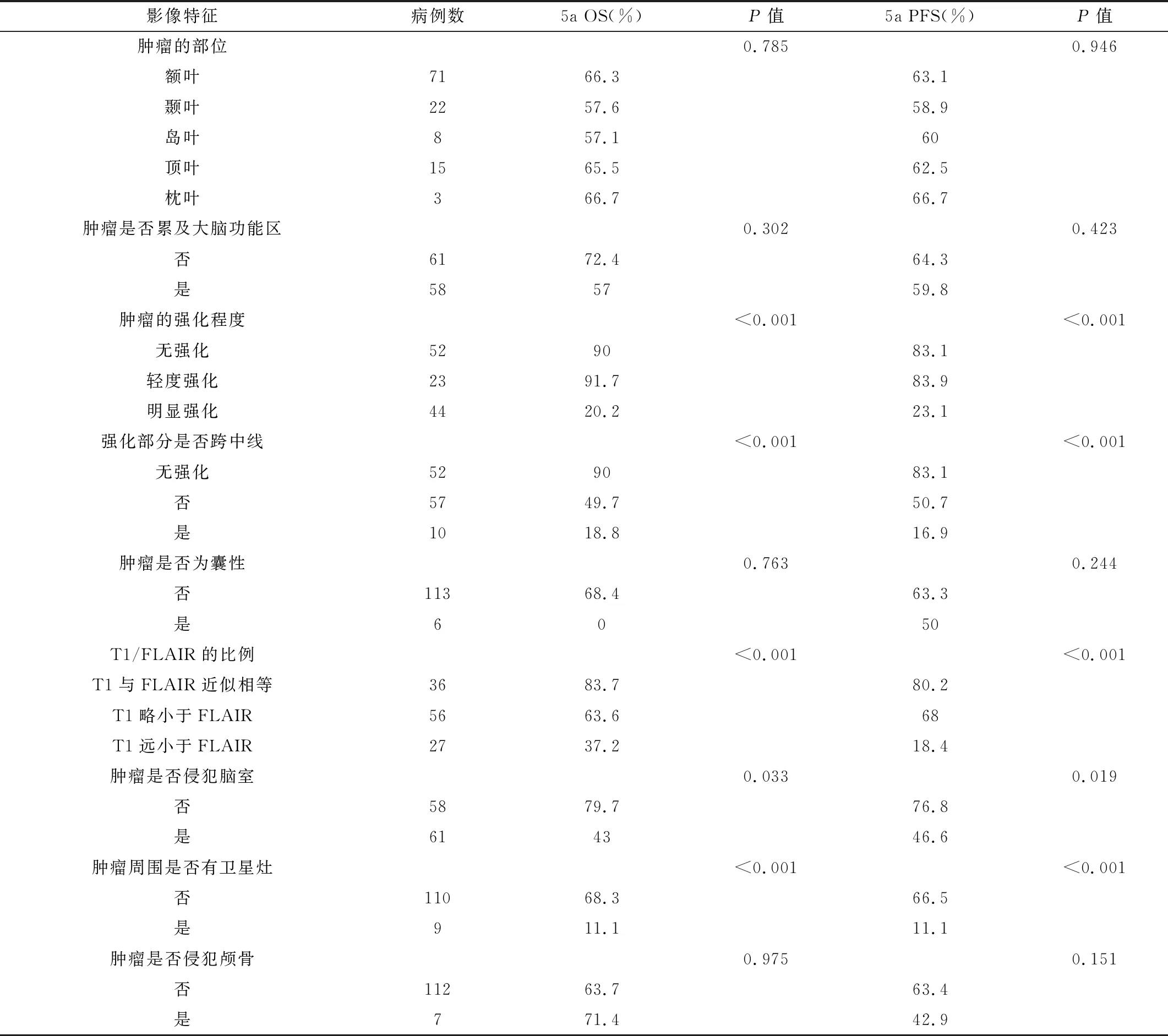
表1 单因素分析影像特征与较低级别胶质瘤患者预后的关系(n=119)
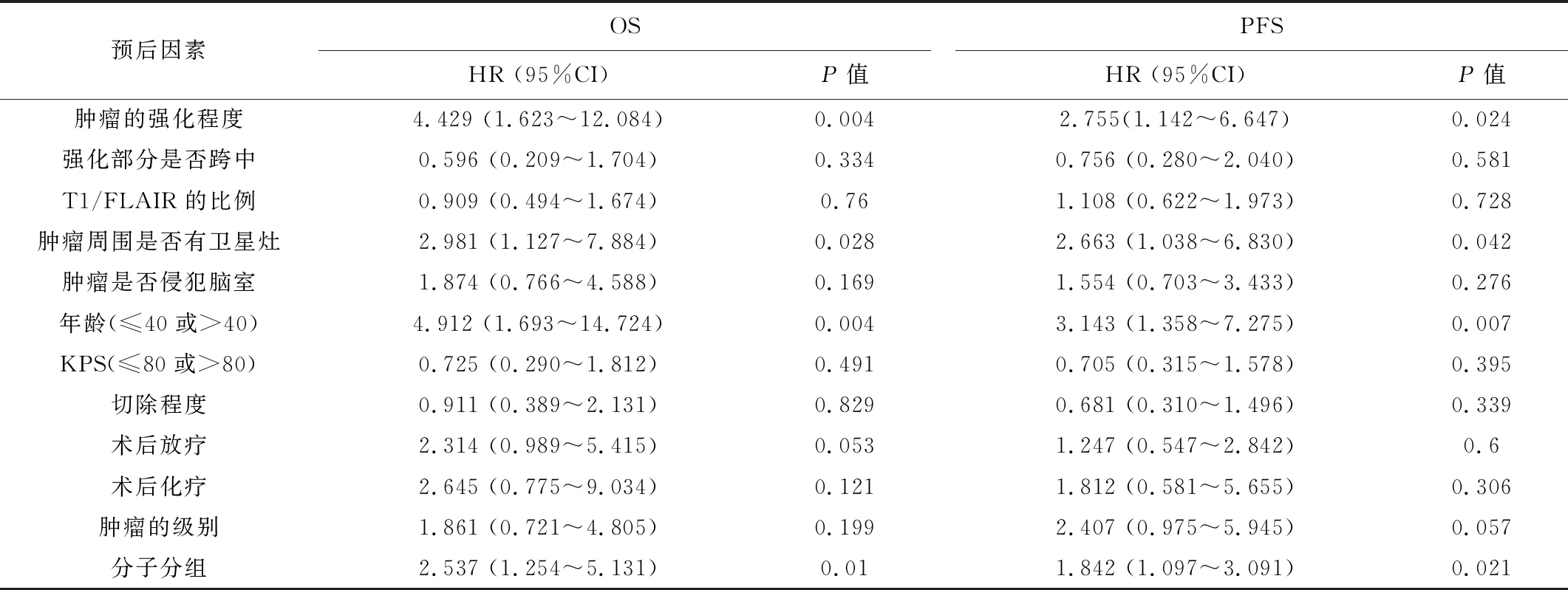
表2 影响较低级别胶质瘤患者预后的多因素分析(n=119)
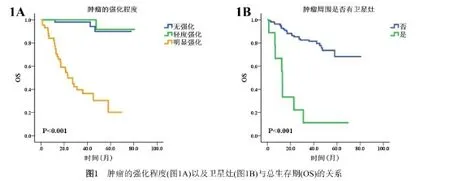
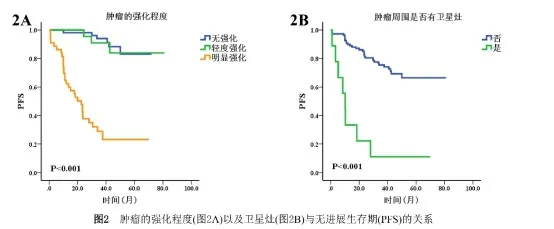
2.3强化程度、肿瘤周围有无卫星灶与生存时间的关系无强化、轻度强化与明显强化的肿瘤患者的5 a OS分别为90.0%、91.7%与20.2%,生存曲线见图1A (P<0.001)。肿瘤周围无卫星灶与有卫星灶的患者的5 a OS分别为68.3%与11.1%,生存曲线见图1B (P<0.001)。无强化、轻度强化与明显强化的肿瘤患者的5 a PFS分别为83.1%、83.9%与23.1%,生存曲线见图2A (P<0.001)。肿瘤周围无卫星灶与有卫星灶的患者的5 a PFS分别为66.5%与11.1%,生存曲线见图2B (P<0.001)。
3 讨论
MRI作为诊断脑胶质瘤首选检查方法,具有很高的灵敏度和准确度。此外,不同于组织病理和分子病理,MRI检查无须手术或穿刺,具有安全、无创、方便、可重复等优势。有研究表明,MRI强化特征能很好预测IDH突变状态,IDH野生型胶质瘤与IDH突变型胶质瘤相比,强化更常见且更明显,患者的预后更差[8-9]。其病理学基础为IDH突变会引起一系列蛋白的表达和胶质瘤结构的改变,进而影响肿瘤血管的生成和细胞增殖[10]。有研究发现,强化程度与较低级别胶质瘤患者的OS和PFS均有关系,肿瘤明显强化的患者往往生存时间更短[11-12]。本研究结果显示,单因素与多因素分析均证实强化程度为较低级别胶质瘤患者OS和PFS的预后因素。有关研究结果显示,肿瘤无强化或轻度强化的患者有着更长的生存时间[13]。因此,MRI肿瘤的强化程度与患者的预后关系非常密切,可通过肿瘤强化程度评估患者的预后和病情发展。
此外,我们发现肿瘤周围卫星灶为较低级别胶质瘤患者预后的独立危险因素。Zhou等[11]在单因素分析中发现,肿瘤周围卫星灶与较低级别胶质瘤患者的OS与PFS均有关。Peeken等[14]研究发现,MRI发现肿瘤周围有卫星灶预示着胶质瘤级别较高,患者预后较差。在其他肿瘤中,卫星病灶与患者的预后也同样关联。如在胃癌、肝细胞癌等研究中均证实,肿瘤周围有卫星病灶时,很可能已发生远处转移,患者术后复发的风险较高,预后较差[15-16]。
综上所述,本研究分析了MRI影像学特征与较低级别胶质瘤患者预后的关系,证实肿瘤的强化程度以及卫星病灶与患者的生存时间和结局密切相关,在预测患者的预后及指导临床治疗等方面价值巨大。
