Alpha-突触核蛋白与完整线粒体相互作用的NMR研究
2021-06-09余锦波张则婷徐国华李从刚
余锦波,张 偲,张则婷,徐国华*,李从刚
1. 中国科学院生物磁共振分析重点实验室,波谱与原子分子物理国家重点实验室(中国科学院 精密测量科学与技术创新研究院),湖北 武汉 430071;2. 中国科学院大学,北京 100049
引 言
帕金森综合征密切相关蛋白alpha-突触核蛋白(α-synuclein)[1-3]是一种天然无结构蛋白.该蛋白由140个氨基酸残基构成,其氨基酸序列包含三个部分:第1~60位氨基酸残基组成的N端,该区易和膜相互作用,具有形成α-螺旋结构的倾向;第 61~95位氨基酸残基组成的非淀粉样成份区(NAC),该区包含较多疏水氨基酸,具有形成β-片层结构的趋向;第 96~140位氨基酸残基组成的羧基端,该区富含酸性氨基酸,在生理pH下带有大量负电荷,大部分情况下此区域为无规则卷曲[4].
线粒体是真核细胞中重要的细胞器,是细胞进行有氧呼吸制造能量的主要场所[5].其结构由内到外分为基质、线粒体内膜、膜间隙和线粒体外膜[6,7].虽然目前帕金森症发病机制尚不完全清楚,但普遍认为,线粒体功能障碍也是主要原因之一.有研究证实α-synuclein的过表达能改变线粒体的形态、动力学及损害线粒体正常功能[8-14],但其作用机制并不明确.围绕这一问题已有研究组开展了α-synuclein与线粒体模拟膜及分离提取的完整线粒体的相互作用的研究,使用线粒体模拟膜的研究发现α-synuclein与线粒体膜的相互作用依赖于心磷脂,α-synuclein能与心磷脂含量高(约18%)的线粒体内膜作用,而与心磷脂含量低(<1%)的线粒体外膜并不相互作用[15-17],且N端在与线粒体的结合中发挥重要作用,但α-synuclein具体的作用位点仍不十分清楚.
核磁共振(NMR)技术是研究生物大分子相互作用的有效方法[18,19],它能够对样品进行无损伤的检测[20-25],并提供详细的生物大分子作用位点信息.本文利用NMR方法研究了α-synuclein与新鲜提取的完整线粒体的相互作用,证实NMR方法是研究蛋白质与完整线粒体相互作用的有效方法.
1 实验部分
1.1 实验材料
三羟甲基氨基甲烷(Tris)、乙二胺四乙酸二钾(EDTA·2K)、蔗糖、苯甲基磺酰氟(PMSF)购自国药集团化学试剂有限公司.对蛋白质进行同位素标记所用的15NH4Cl和13C-glucose购自Cambridge Isotope Laboratories,Inc.提取线粒体所用的实验动物为六周龄的SD品系雄性大鼠,购自湖南斯莱克景达实验动物有限公司.蛋白免疫印迹(Western Blotting)检测所用的标样蛋白铜锌超氧化物歧化酶(SOD1)和细胞色素C氧化酶亚基6c(COX6c)及其对应一抗抗体购自武汉云克隆科技股份有限公司;鼠抗兔IgG二抗抗体购自Abcam plc.;显色所用增强型二氨基联苯胺(DAB)显色试剂盒购自生工生物工程有限公司;二喹啉甲酸(BCA)蛋白浓度检测试剂盒购自上海碧云天生物技术有限公司.线粒体染色所用的特异性红色荧光染料(Mito Tracker® Red CMXRos)购自Thermo Fisher Scientific Inc.
1.2 蛋白样品的表达与纯化
非标记、15N标记和15N/13C双标记的α-synuclein的表达与纯化依照文献[26,27]所述的方法进行.
表达方法简述如下:将整合有α-synuclein基因的重组质粒Pt7-7转化至大肠杆菌BL21(DE3)感受态细胞中,挑取单菌落接种于含氨苄青霉素的LB液体培养基中,在37 ℃、220 rpm的摇床中培养,然后在LB液体培养基(非标记的α-synuclein)或M9培养基(15N标记与15N/13C双标记的α-synuclein)中扩大培养,至OD600为0.8时加入异丙基硫代半乳糖苷(IPTG)(Sigma,终浓度为1.0 mmol/L)进行诱导表达,5 h后收菌.
纯化方法简述如下:将菌体用高压细胞破碎仪裂解,然后沸水浴20 min,14 000 rpm、4 ℃条件下离心取上清;加入硫酸链霉素(终浓度为10 mg/mL)旋转混匀30 min,14 000 rpm、4 ℃条件下离心取上清(该步骤用于沉淀球蛋白);再加入硫酸铵(终浓度为360 mg/mL)旋转混匀30 min,沉淀目的蛋白α-synuclein,14 000 rpm、4 ℃条件下离心30 min收集蛋白沉淀. 将蛋白沉淀溶解后首先用阴离子交换柱DEAE纯化,再用分子筛S100(GE Healthcare)进一步纯化,纯化后的蛋白用脱盐柱(GE Healthcare)脱盐后冻干存放备用.
1.3 大鼠肝脏线粒体的提取
大鼠肝脏线粒体的提取参阅文献[28]进行.其方法简要如下:取六周龄左右的雄性SD大鼠采用拖颈法处死,剪开大鼠胸腹部表皮与肌肉以暴露腹腔,取大鼠肝脏并称重,将剪碎的肝脏放入提取缓冲液(按照10 mL缓冲液/g肝组织的比例加入,缓冲液的组成为10 mmol/L Tris、1 mmol/L EDTA·2K和320 mmol/L蔗糖,pH 7.4),并在匀浆器中匀浆,整个操作在冰上进行,然后通过差速离心法提取线粒体,1 300 g、4 ℃条件下、低速离心10 min,以沉淀组织碎片等非线粒体成分,7 000 g、4 ℃条件下、高速离心10 min,收集线粒体成分,低速离心和高速离心循环3次以得到高纯度的线粒体.
1.4 线粒体的纯度检测与计数
1.4.1 线粒体的纯度检测
COX6c可作为线粒体的标志蛋白,而SOD1可作为胞质组分的标志蛋白.利用蛋白质免疫印迹技术对所提取的线粒体分别进行这两个标志蛋白的检测即可确定线粒体的纯度[29].首先将所提取的线粒体进行超声裂解释放出线粒体内的蛋白质,之后将线粒体裂解液进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE),电泳后进行转膜与封闭,再分别用COX6c与SOD1相应的一抗抗体进行孵育,最后经过二抗抗体孵育与显色观察所提取的线粒体内是否含有被检测的蛋白,并确定线粒体纯度.
1.4.2 线粒体的计数
线粒体的计数基于线粒体内的总蛋白浓度进行测算[30].首先将所提取的线粒体超声裂解,之后使用 BCA蛋白浓度检测试剂盒测定线粒体内蛋白质的总浓度,再根据蛋白质浓度推算出肝脏中线粒体的数目.
1.4.3 线粒体荧光染色与荧光共聚焦实验
我们用250 nmol/L的线粒体红色荧光染料(Mito Tracker® Red CMXRos)对所提取的线粒体染色30 min,然后用提取缓冲液清洗线粒体3次,制片后使用配备了63倍油镜的LEICA TCS Sp8荧光共聚焦显微镜进行观察,激发波长为579 nm,发射波长为599 nm.
1.5 NMR样品制备与实验
α-synuclein稀溶液样品的制备:将冻干的α-synuclein蛋白样品溶解在含10%重水的提取缓冲液中至终浓度为0.015 mmol/L.α-synuclein与线粒体孵育样品(即α-synuclein线粒体样品)的制备:用500 μL的α-synuclein稀溶液重悬自6 g大鼠肝组织新鲜提取的线粒体.为防止α-synuclein的降解,我们也制备了添加 PMSF的样品(即α-synuclein-PMSF样品和α-synuclein-PMSF线粒体样品),无论是稀溶液样品还是蛋白与线粒体孵育样品,PMSF的终浓度均为1 mmol/L.
所有NMR实验均在配备了5 mm TCI H-C/N-D CryoProbeTM超低温探头的Bruker 850 MHz谱仪上完成,实验温度为279 K.1H-15N SOFAST-HMQC实验直接维(1H)和间接维(15N)谱宽分别为10 204 Hz和2 240 Hz,两维中心分别位于δH4.70和δN119.0,采样数据点阵t2×t1=1 024×256,累加次数为288,弛豫等待时间为0.1 s.α-synuclein在279 K下的信号归属通过稀溶液中15N和13C双标记的样品来完成,采集了HN(CO)CA、HNCA、CBCA(CO)NH和HNCACB等三共振实验进行主链归属.NMR数据通过Topspin3.2处理,在Sparky中进行分析.化学位移变化通过(1)式计算得到:

其中Δδ1H代表1H的化学位移变化,Δδ15N代表15N的化学位移变化.
1.6 NMR实验后样品检测
α-synuclein-PMSF线粒体样品在完成 NMR实验后,进行了 SDS-PAGE和蛋白质免疫印迹检测.离心分离上清液与线粒体沉淀,向上清液与沉淀中加入 5×上样缓冲液并沸水浴,之后进行SDS-PAGE,观察线粒体是否破损.在经过转膜与封闭后,用α-synuclein一抗抗体进行孵育,最后经过二抗抗体孵育与显色,观察α-synuclein在与线粒体混合后是否发生降解.
2 结果与讨论
2.1 线粒体的纯度和活力
线粒体的纯度可用线粒体特征蛋白COX6c和胞质特征蛋白SOD1来表征.我们利用蛋白质免疫印迹技术对提取的线粒体分别进行了这两个蛋白的检测,结果显示提取的线粒体含有 COX6c而不含有SOD1 [图1(a, b)],表明提取的线粒体纯度较高,未受到胞质组分的干扰.
为表征提取的线粒体的活性,我们用线粒体膜电位依赖的红色荧光探针(Mito Tracker® Red CMXRos)对所提取的线粒体进行了染色,并用荧光共聚焦显微镜进行了观察.如图1(c)~1(e)所示,明场与线粒体染色的荧光图叠加良好,表明所提取的线粒体纯度较高、活性良好.
2.2 α-synuclein与完整线粒体相互作用
我们配制了α-synuclein线粒体样品,来研究α-synuclein与完整线粒体的相互作用.为确定α-synuclein和线粒体的个数比在一个合理范围,我们首先利用线粒体的总蛋白量估算了线粒体的数目.BCA法测定结果显示每克肝组织所提取的线粒体含有1.68 mg蛋白质,依据每毫克蛋白质对应的线粒体数目约为 8.1×109个(Schmitt等[30]的研究结果),可以推算出我们所提取的线粒体数目约为1.36×1010个/g肝组织. 而本研究使用了来自6 g肝组织的线粒体,即线粒体的数目已达8.16×1010个,以及0.015 mmol/L的α-synuclein蛋白,蛋白与线粒体的个数比为56 000:1.假设线粒体是直径为1 μm的球体,α-synuclein能与线粒体进行相互作用,且相互作用模型是前60个氨基酸[图2(a)]形成α-螺旋结构嵌在膜表面,则一个线粒体表面可容纳170 000个蛋白分子(远大与56 000),因此我们实验中所设计的蛋白与线粒体的个数比是合理的.

图1 分离提取的大鼠肝脏线粒体纯度和活力的表征. (a)线粒体特征蛋白COX6c和(b)胞质特征蛋白SOD1的蛋白免疫印迹检测结果,最右孔道为SOD1标样作为阳性对照,用以表征线粒体的纯度,Mito表示线粒体;(c)~(e)荧光共聚焦表征线粒体的活性,(c)为明场图,(d)为荧光共聚焦图,(e)为明场与荧光共聚焦叠加图Fig. 1 The analysis of isolated mitochondrial purity and viability from the liver of rat. (a) The COX6c component and (b) SOD1 component were detected by western blotting (SOD1 standard sample as positive control in figure (b)),showing the mitochondrial purity. (c)~(e) Mitochondrial viability characterized by fluorescence confocal microscopy:(c) Bright field; (d) Isolated mitochondria were stained with Mito Tracker® Red CMXRos whose accumulation is dependent upon the mitochondrial membrane potential (MMP); (e) Overlay of figure (c) and figure (d)
在此基础上,我们采集了α-synuclein线粒体样品的1H-15N SOFAST-HMQC谱[图2(b)].如图所示,相比于稀溶液,部分氨基酸残基的信号强度呈现明显减弱,并未出现新的信号峰,化学位移未表现出明显移动.基于稀溶液中获得的信号指认结果(该蛋白除5个脯氨酸外,可实现约90%的信号归属),我们对信号强度和化学位移进行了详细分析[图3(a, b)],结果显示化学位移变化很小,数值几乎均小于0.005,但α-synuclein N端(1~60)信号强度出现了明显减弱[图3(a)],表明该段残基能与线粒体相互作用,这种相互作用使得蛋白的转动相关时间变长,横向弛豫速率增加,信号强度减弱.
α-synuclein非常容易降解,特别是在含有丰富的蛋白酶的线粒体中,但 PMSF可以有效抑制α-synuclein的降解,且并不影响线粒体的功能[31].为排除蛋白酶泄露降解α-synuclein导致 N端信号强度降低的可能性,我们又采集了α-synuclein-PMSF线粒体样品的NMR谱图,以及稀溶液中含有和不含 PMSF的α-synuclein样品的谱图[图 2(c, d)].可以看出 PMSF本身对蛋白没有影响[图2(c)].添加PMSF的α-synuclein线粒体样品相比于不添加的样品也未呈现出明显差异[图2(d)].同样,我们也对α-synuclein-PMSF线粒体样品的信号强度和化学位移进行了详细分析[图3(c, d)],结果显示仍然是仅α-synuclein N端(1~60)信号强度出现了明显减弱[图3(c)],即与α-synuclein线粒体样品所得结果相同.
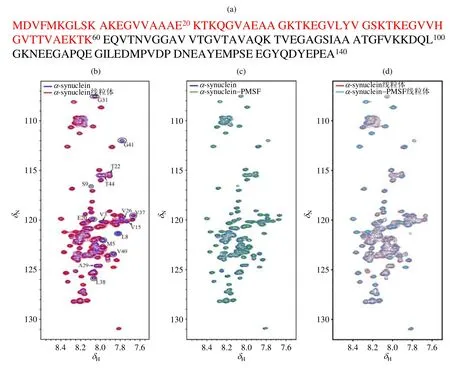
图2 不同条件下α-synuclein的1H-15N SOFAST-HMQC谱图对比. (a) α-synuclein 的氨基酸序列,组成N端的第1~60的残基用红色表示;(b) α-synuclein稀溶液(蓝色)与α-synuclein线粒体样品(红色)的谱图叠加;(c)含有(绿色)与不含有(蓝色)1 mmol/L PMSF的α-synuclein稀溶液的谱图叠加;(d) α-synuclein线粒体样品(红色)与α-synuclein-PMSF线粒体样品(青色)的谱图叠加Fig. 2 1H-15N SOFAST-HMQC spectra of α-synuclein under different conditions. (a) The amino acid sequence of α-synuclein, the N-terminus region (1~60) are colored in red; (b) Spectral overlay of α-synuclein in absence (blue) and presence (red) of intact mitochondria, the partial peaks of which signal intensity attenuated in the presence of intact mitochondria are marked; (c) Spectral overlay of α-synuclein with (green) and without (blue) PMSF(1 mmol/L) in diluted solution; (d) Spectral overlay of α-synuclein with (cyan) and without (red) PMSF (1 mmol/L) in the presence of intact mitochondria
为了进一步验证结果的可靠性,我们又对NMR实验完成后的α-synuclein-PMSF线粒体样品执行了SDS-PAGE和蛋白免疫印迹分析(图4).SDS-PAGE结果显示上清中只看到α-synuclein蛋白的条带,并不能看到来自线粒体蛋白的条带,表明 NMR实验后线粒体的完整性良好[图 4(a)].蛋白免疫印迹检测的结果显示α-synuclein未发生降解,并且α-synuclein绝大多数分布在上清中,分布在沉淀中的非常少[图 4(b)].这一方面表明α-synuclein与线粒体的作用比较弱,一方面也表明绝大多数α-synuclein并未在与线粒体共同孵育的过程中进入线粒体内部,而仍是分布在线粒体的外面.即使假设分布于沉淀中的α-synuclein全部进入线粒体内部(通常情况下,沉淀中的α-synuclein可能一部分分布于线粒体外膜上与之结合,一部分进入线粒体内部),其所占总蛋白浓度的比例也是非常低的.另外,在该NMR实验中我们使用的蛋白浓度仅0.015 mmol/L,考虑到NMR技术低灵敏的特点,我们所观察到的NMR信号应是来自于所占比例高的位于线粒体外的α-synuclein组分,而不可能是所占比例非常低的进入线粒体内的α-synuclein组分(浓度过低难以达到检测限).由此,我们推测本实验中所观察到的α-synuclein与完整线粒体的相互作用是来自于α-synuclein与线粒体外膜,而不是蛋白进入线粒体,进而与线粒体内膜产生的相互作用.
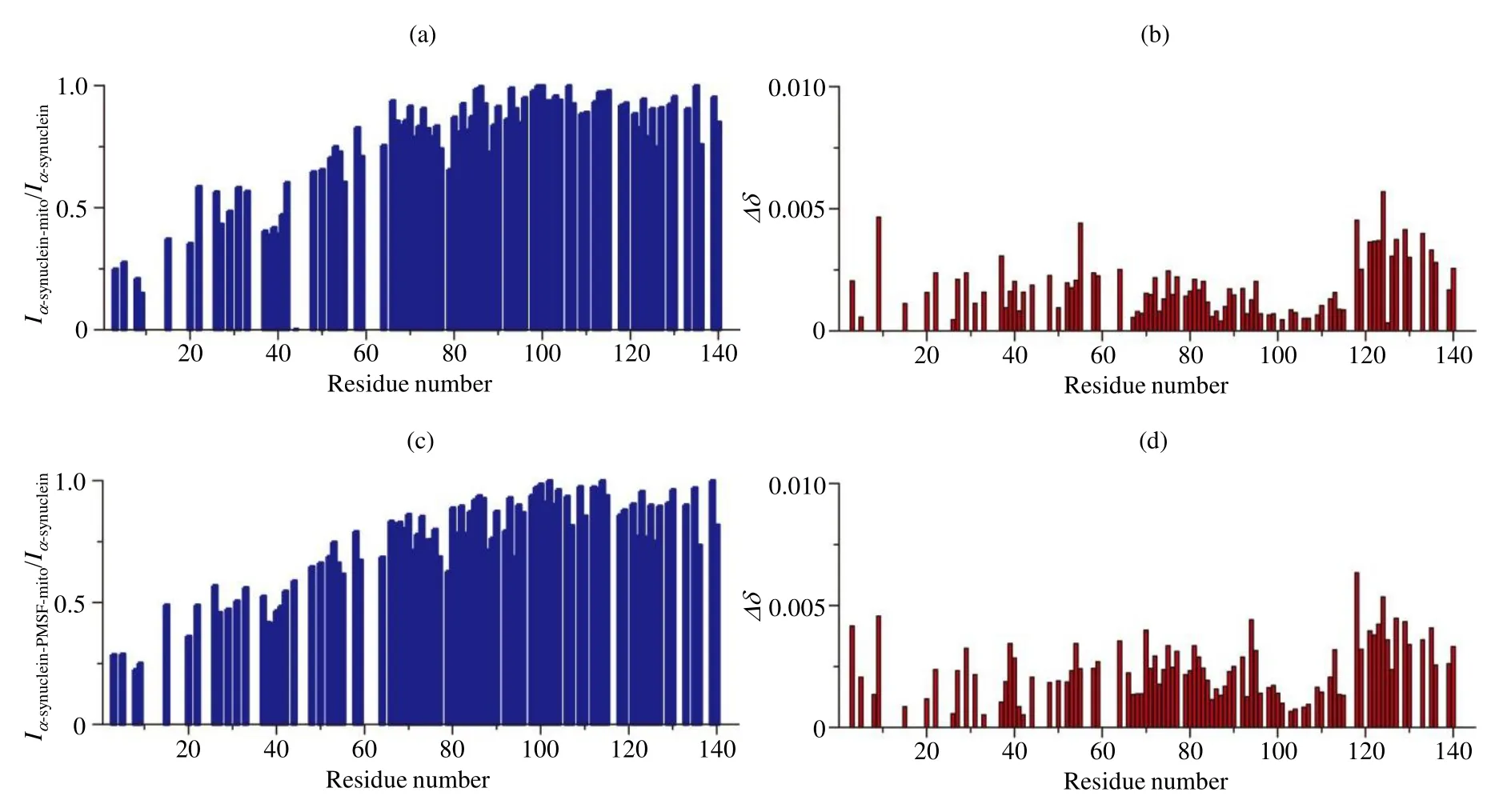
图3 α-synuclein线粒体样品氨基酸残基信号强度与化学位移变化结果. 相比于稀溶液,α-synuclein线粒体样品氨基酸残基的(a)强度变化和(b)化学位移变化;相比于稀溶液,α-synuclein-PMSF线粒体样品氨基酸残基的(c)强度变化和(d)化学位移变化(注:图中没有数值的空白部分主要为因谱峰重叠严重导致难以获取准确信号强度的氨基酸残基)Fig. 3 The analysis of residue resolved NMR signal intensity and chemical shift change of α-synuclein in the presence of mitochondria(the values of NMR signal intensity ratio and chemical shift changes are shown as blank for the residues whose signal intensity can not be accurately obtained due to the overlap of spectral peaks). (a) NMR signal intensity ratio (Iα-synuclein-mito/Iα-synuclein) of α-synuclein in the presence and absence of mitochondria; (b) Chemical shift changes of α-synuclein in presence of mitochondria compared to α-synuclein; (c)NMR signal intensity ratio (Iα-synuclein-PMSF-mito/Iα-synuclein) of α-synuclein with PMSF in the presence of mitochondria and α-synuclein; (d)Chemical shift changes of α-synuclein with PMSF in the presence of mitochondria compared to α-synuclein
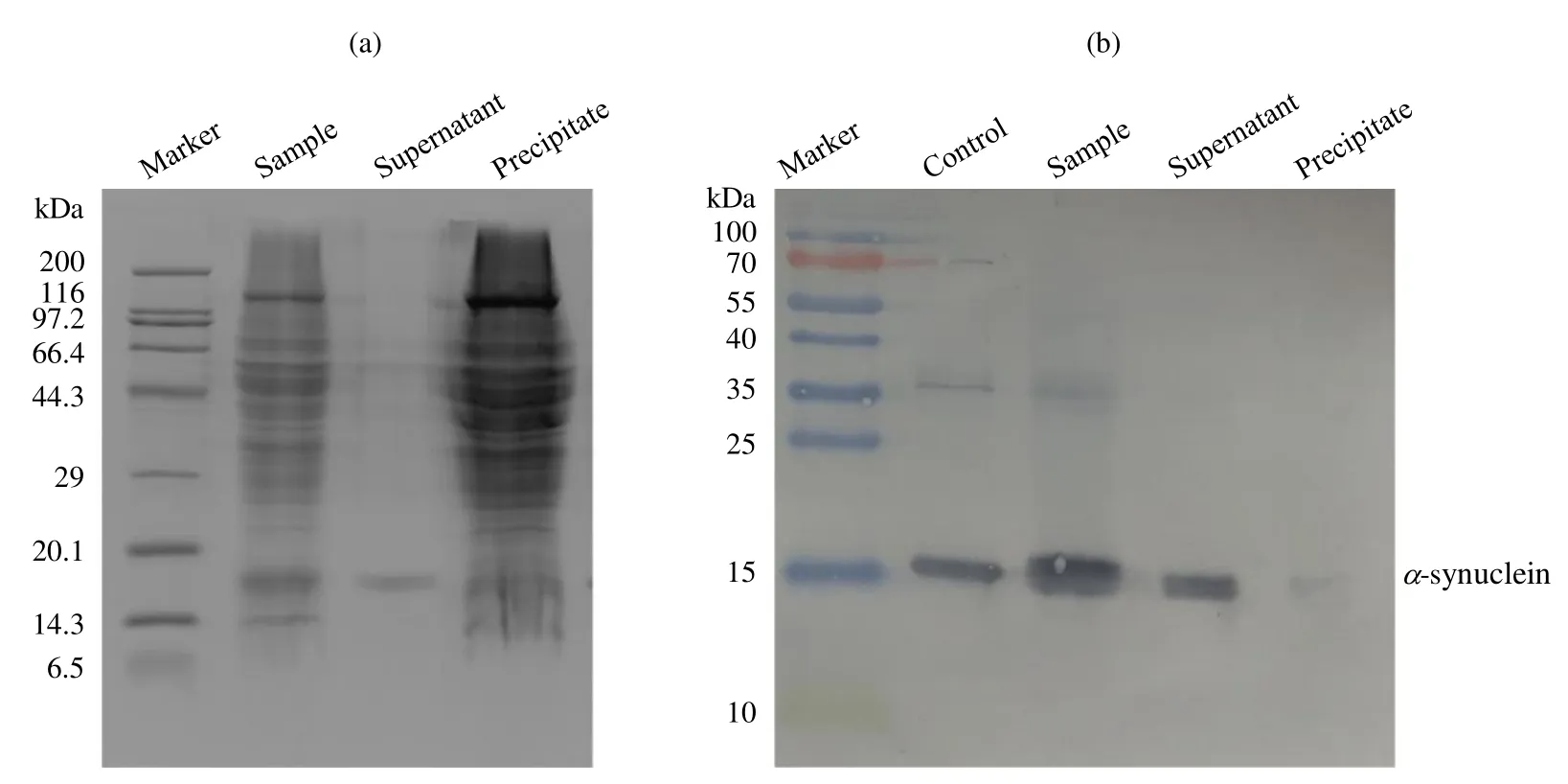
图4 α-synuclein-PMSF线粒体样品的(a) SDS-PAGE和(b)蛋白免疫印迹检测结果. 图中Control表示α-synuclein的标准品对照,Sample表示α-synuclein-PMSF线粒体样品,Supernatant表示α-synuclein-PMSF线粒体样品离心后的上清,Precipitate表示α-synuclein-PMSF线粒体样品离心后的沉淀Fig. 4 (a) SDS-PAGE and (b) Western-blotting analysis of α-synuclein with PMSF in the presence of intact mitochondria (a)SDS-PAGE analysis showing integrity of mitochondria; (b) Western-blotting analysis showing that α-synuclein is undegraded; Control:α-synuclein standard sample, Sample: α-synuclein with PMSF in the presence of intact mitochondria, Supernatant: the supernatant of the sample (α-synuclein with PMSF in the presence of intact mitochondria) that was centrifuged, Precipitate: the precipitate of the sample that was centrifuged
另外,我们的研究表明α-synuclein与线粒体的相互作用主要是通过其N端来实现,这一特征与我们及其他研究组前期所报道[20,32-34]的α-synuclein与生物模拟膜相互作用所表现出来的特征非常相似,表明它们的作用模式非常相似,即α-synuclein与线粒体的相互作用很可能仍是通过其N端形成α-螺旋结构的形式与线粒体膜相互作用.但是在信号强度降低的幅度和所波及的范围上与之前的报道也表现出一些差别:我们前期报道[32]的α-synuclein与1-棕榈酰基-2-油酰基卵磷脂/ 1-棕榈酰-2-油酰基磷脂酸(POPC/POPA)组成的单层小脂质体(SUV)的相互作用中,信号强度降低最明显的N端前 10个残基衰减达到了>90%的水平,其信号衰减范围延伸到了蛋白的前 120个残基;而在α-synuclein与线粒体的作用中,信号强度降低主要发生在N端,并未进一步延伸到NAC区,且其信号强度降低最明显的 N端前 10个残基的衰减在约 75%的水平,表明这种相互作用可能不及α-synuclein与POPC/POPA组成的SUV的相互作用强.
我们的研究显示NMR观察到的α-synuclein与线粒体的相互作用应来自于α-synuclein与线粒体外膜,这与其他研究组通过模拟线粒体外膜组分研究其与α-synuclein的相互作用所得结果并不相同.其他研究组的研究结果显示α-synuclein与心磷脂含量低的线粒体外膜(<1%)并不相互作用[15-17].这可能是因为已有的研究使用的是磷脂组装的SUVs或单层大泡脂质体(LUV)来模拟线粒体外膜(模拟线粒体外膜中不含心磷脂成分),而完整的线粒体外膜除磷脂组分外,还含有其他组分(如脂蛋白、糖等).另外,模拟外膜的曲率与完整线粒体也存在差异.这些都可能导致模拟线粒体外膜并不能真实反映完整线粒体的实际情况,从而造成研究结果的差异.这也体现出使用完整线粒体开展研究的重要性.
3 结论
本文通过NMR技术研究了α-synuclein与完整线粒体的相互作用,发现α-synuclein能与完整线粒体外膜相互作用,且作用区域主要位于α-synuclein N端前1~60个氨基酸残基.这一研究证实NMR方法是研究蛋白质与完整线粒体相互作用的有效方法.
利益冲突
无
