葛叶多酚的提取工艺及其抗氧化性质
2021-06-08唐婷范朱家庆李荣彬冯军黄芳丽梁杰婷田玉红李晓慧程昊
唐婷范 朱家庆 李荣彬 冯军 黄芳丽 梁杰婷 田玉红 李晓慧 程昊

摘 要:采用回流法提取葛叶中的多酚,用福林酚法测定葛叶多酚含量,通过精密度、稳定性和加标回收率试验验证适用性,对葛叶多酚的抗氧化性质进行研究,并利用单因素实验研究对葛叶多酚得率的影响.结果显示葛叶多酚最佳提取工艺为:溶剂pH值为4、料液比1∶30、70 ℃水浴2.0 h,提取2次,精密度实验相对标准误差为0.27%,稳定性实验相对标准误差为0.94%,加标回收率实验相对标准误差为1.66%,此条件下葛叶多酚得率为2.22%;葛叶多酚对DPPH·和·OH具有较强的清除作用,最大清除率分别为80.99%和76.24%.回流法提取葛叶多酚工艺合理,操作简单,且提取后的葛叶多酚有较强的抗氧化性,为葛叶多酚的开发利用提供基础性研究.
关键词:葛叶;多酚;提取工艺;抗氧化性
中图分类号:TQ91 DOI:10.16375/j.cnki.cn45-1395/t.2021.02.017
0引言
葛叶来源于植物野葛Pueraria lobata(Willd.)Ohwi.的叶,据医学专著《神农本草经》记载,葛根的茎、叶、花、果、根均可入药[1],《别录》记载其“主金疮止血”[2].葛叶中含有多酚类化合物.王淑惠等[3]通过气相色谱-质谱法(GC-MS)联用,对不同生长月份的葛叶挥发油进行鉴定,得到20多个成分,其中就包含多酚类物质.多酚是植物体内的复杂酚类次生代谢产物,具有多元酚羟基结构[4].植物多酚由于其有效的抗氧化特性以及在预防各种氧化应激相关疾病(例如癌症)中的显著效果而引起越来越多的关注[5-9].不同植物多酚类提取物的利用和开发已成为食品和医学相关研究的主要领域[10-12],多酚的提取工艺是其中一个重要的环节.
目前多酚的提取方法有很多[13-14],常用的有微波辅助提取法[15]、超临界流体萃取法、超声波提取法[16]等.其中微波辅助提取法不适合高温敏感物质,温度过高会破坏提取物分子结构;超临界流体萃取法对设备要求高,成本大;超声波提取法机械能耗大,溶剂消耗过快.与此相比的回流提取法[17],操作工艺简单,不会造成太多的资源浪费,且成本低,是一种常用的植物多酚提取方法.宋力等[18]采用回流法提取菠萝皮中的多酚,并与微波法、超声波法等4种方法作对比,发现回流法提取的多酚抗氧化清除率最高.
近年来,对葛根多酚的研究大多数集中在根部,对葛叶多酚研究较少.本实验以葛叶作为原料,利用回流提取法提取葛叶中多酚,采用福林酚法[19]测定葛叶中多酚的含量,通过精密度、稳定性和加标回收率实验验证适用性,并对葛叶多酚得率和多酚提取液的抗氧化性能进行研究.
1材料与方法
1.1 材料与试剂
葛叶,选用广西北海野葛的叶(2019年8月采收);没食子酸,分析纯,天津市光复精细化工研究所;福林酚试剂、水杨酸,分析纯,天津市大茂化学试剂厂;碳酸钠,分析纯,广东光华化学厂有限公司;二苯基苦基肼自由基,分析纯,WaKo公司;无水乙醇,分析纯,台山市粤侨试剂塑料有限公司.
1.2 仪器与设备
V2000型可见分光光度计:上海舜宇恒平科学仪器有限公司;AR124CN分析天平:上海奥豪斯仪器有限公司;TDL-80-2B低速离心机:上海安亭科学仪器厂;SHZ-95B型循环水式多用真空泵:河南省予华仪器有限公司;ZY-LDG12真空冷冻干燥机:上海紫裕生物科技有限公司.
1.3 实验方法
1.3.1 葛叶原料预处理
选择品质良好无虫害的优质葛叶,将其洗净放入60 ℃烘箱烘干,烘干后的葛叶研磨打碎,备用.
1.3.2 葛叶多酚含量的测定
采用福林酚法[19]测定葛叶里的多酚含量,利用福林酚的强氧化性与多酚发生蓝色反应,并利用分光光度计在745 nm处进行吸光度检测.用没食子酸作为标定物质,利用标准品的标准曲线计算多酚含量.
1.3.3没食子酸标准曲线的绘制
用分析天平称量11.00 mg(±0.10 mg)没食子酸标准品,定容到100 mL容量瓶中配制成质量浓度0.11 mg/mL的没食子酸标准液;取0.2 mL、 0.4 mL、0.6 mL、0.8 mL、1.0 mL没食子酸标准液,分别加入1.5 mL福林酚试剂和2.0 mL 10% Na2CO3溶液定容于25 mL容量瓶,混合均匀避光反应30 min后在745 nm处测其吸光度[15],绘制标准曲线.
1.3.4精密度、稳定性和加标回收率实验
1)精密度实验
用移液管吸取葛叶多酚提取液2.0 mL至 25 mL容量瓶中,加入1.5 mL福林酚试剂和 2.0 mL 10% Na2CO3溶液后用蒸馏水定容,混合均匀避光反应30 min,在745 nm处不间断测量6次吸光度[20].
2)稳定性实验
吸取多酚提取液2.0 mL至25 mL容量瓶中,加入福林酚试剂1.5 mL和10% Na2CO3溶液2.0 mL 后用蒸馏水定容,混合均匀避光反应30 min,每隔 2 min在745 nm处测量6次吸光度.
3)加标回收率实验
分别吸取2.0 mL葛叶多酚提取液至5个25 mL容量瓶中,在每个容量瓶中分别加入不同浓度的没食子酸标准溶液,并计算平均回收率和RSD值.
1.3.5 葛叶多酚提取单因素实验考察
1)溶剂pH对多酚得率的影响
调配pH值為3、4、5、6、7的蒸馏水溶剂,用电子天平称量2.00 g预处理过的葛叶,加入料液比为1∶30的不同pH值的溶剂,在50 ℃下加热回流2 h,提取一次[21],按“1.3.3”步骤测定吸光度,分析数据绘制葛叶多酚得率与pH值曲线图.
2)提取时间对多酚得率的影响
称量2.00 g处理过的葛叶,加入料液比为1∶30的pH值为4的溶剂,在50 ℃下加热回流 1.0 h、1.5 h、2.0 h、2.5 h和3.0 h,提取一次,按“1.3.3”步骤测定吸光度,分析数据绘制葛叶多酚得率与提取时间曲线图.
3)料液比对多酚得率的影响
称量2.00 g处理过的葛叶,加入不同料液比(1∶10、1∶20、1∶30、1∶40、1∶50),pH值为4的溶剂,在50 ℃下加热回流2 h,提取一次,按“1.3.3”步骤测定吸光度,分析数据绘制葛叶多酚得率与料液比曲线图.
4)提取温度对多酚得率的影响
称量2.00 g处理好的葛叶,加入料液比为 1∶30的pH值为4的溶剂,在不同温度(50 ℃、60 ℃、70 ℃、80 ℃、90 ℃)下加热回流2 h,提取一次,按“1.3.3”步骤测定吸光度,分析数据绘制葛叶多酚得率与提取温度曲线图.
5)提取次数对多酚得率的影响
称量2.00 g处理好的葛叶,加入料液比为1∶30的pH值为4的溶剂,在70 ℃下加热回流 2 h,提取不同次数(1、2、3、4),按“1.3.3”步骤测定吸光度,分析数据绘制葛叶多酚得率与提取次数曲线图.
1.3.6葛叶多酚的抗氧化性质研究[22-24]
1)葛叶多酚对DPPH·的清除率
取不同浓度配置好的葛叶样液2.0 mL,加入0.3 mmol/L的DPPH·无水乙醇溶液2.0 mL,混合摇匀后避光放置30 min,在517 nm处测定吸光度[A1];用2.0 mL无水乙醇代替DPPH·无水乙醇溶液测定吸光度[A2];再以2.0 mL蒸馏水代替葛叶样液测定吸光度[A0],用无水乙醇做为空白参比.將样液替换为标准液按上述步骤做出标准物曲线与样液清除率作比较.平行测定3次求平均值.DPPH·自由基清除率公式如下:
[DPPH·自由基清除率=1-A1-A2A0×100%](1)
2)葛叶多酚对·OH的清除率
取试管加入l mL 9.0×10-3 mol/L FeSO4溶液,再加入2.0 mL相同浓度的水杨酸溶液,最后加入 2.0 mL 8.8×10-3 mol/L双氧水溶液,混合均匀后暗处静置30 min,在525 nm处测定吸光度[A0],不加双氧水溶液作为空白对照.另取试管依次加入 l.0 mL FeSO4溶液、2.0 mL水杨酸溶液、2.0 mL葛叶样液和2.0 mL双氧水溶液,在上述条件下测吸光度[A1].按上述在加葛叶样液不加双氧水溶液条件下测吸光度[A2]. [A1] 和[A2]以蒸馏水作参比,平行测定3次求平均值.·OH自由基清除率公式如下:
[·OH自由基清除率=A0-A1-A2A0×100%] (2)
1.3.7数据处理
各实验指标测定3 次取平均值以减小实验误差.使用Origin 8软件进行数据分析处理和绘制图表.
2结果与分析
2.1 没食子酸标准曲线
由图1可知,将标准液质量浓度与所测吸光度值拟合,得到回归方程[y=0.089x-0.001],[R2=0.999 8],说明该曲线具有良好的回归性.
根据标准物的标准曲线方程可得到多酚的得率计算公式:
[多酚得率=A+0.0010.089×Vm×100%] (3)
式中:[A]为提取液吸光度;[V]为提取液体积,mL;[m]为样品质量,g.
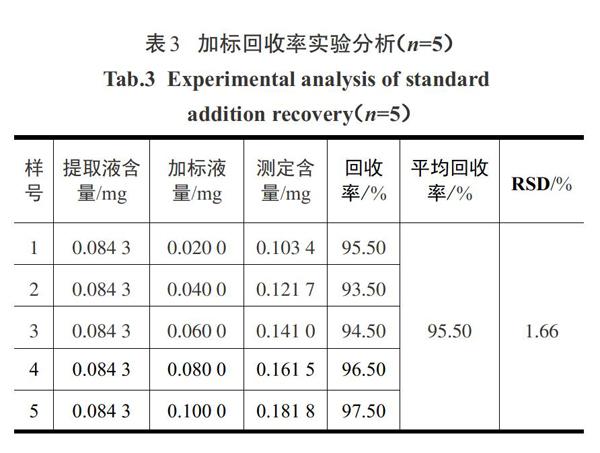
2.2精密度、稳定性和加标回收率结果分析
精密度、稳定性和加标回收率实验结果见表1—表3.由表1—表3得知,葛叶多酚提取液的精密度、稳定性和加标回收率RSD分别为0.27%、0.94%、1.66%,此方法的平均回收率为95.50%.通过实验数据结果说明该测定方法适用于葛叶多酚的测定.
2.3单因素实验
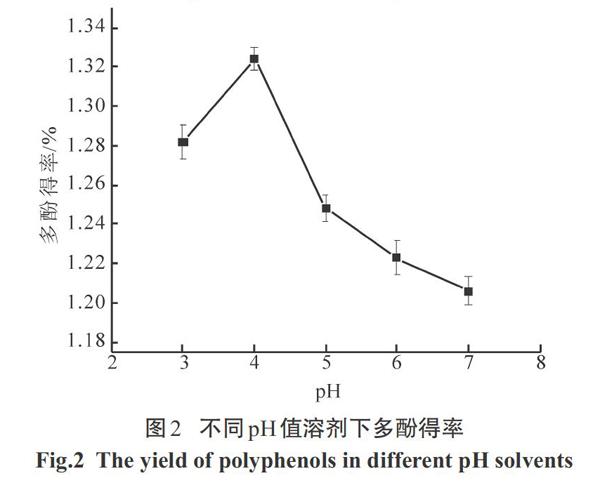
2.3.1溶剂pH对多酚得率的影响
图2为不同pH值对多酚得率的影响.
由图2可以看出,在其他实验条件相同的情况下,葛叶多酚得率在pH=4时最大,达到1.32%.原因可能是植物里的多酚作为盐类存在,当在酸性条件下容易使单宁酸游离出来,相比酸性环境单宁在碱液中更容易浸出且易氧化,所以选取pH=4的溶剂较合适.
2.3.2 提取时间对多酚得率的影响
图3为不同提取时间对多酚得率的影响.
由图3可以看出,多酚最高得率为1.41%,提取时间为2.0 h.在2.0 h内得率逐渐增大的原因可能是在时间较短的情况下,葛叶与水的接触时间不够,并没有从葛叶中提取出全部的产物.在2.0 h后下降是因为已经提取出的多酚接触空气时间过长,在高温下容易被氧化,所以得率会逐渐地减小[25].选择时间2.0 h较合适.
2.3.3料液比对多酚得率的影响
图4为不同料液比对多酚得率的影响.
由图4可以看出,在料液比1∶30处多酚得率最大为1.42%.原因可能是当料液比低时,水与多酚会有一个浓度差,可以加快多酚的溶解提取.随着料液比的增加,溶剂增大浓度减小,浓度差会有一个动态平衡,得率就会趋于平缓.因此,选择料液比为1∶30较合适.
2.3.4提取温度对多酚得率的影响
图5为不同提取温度对多酚得率的影响.
由图5可知,最高点也是得率最大的点在70 ℃,得率为1.98%.在50 ℃~70 ℃,多酚得率曲线上升趋势明显.多酚得率升高的原因可能是在温度较低时,对于提取物没有达到最优的实验条件,多酚的溶解速度不高.在70 ℃后下降可能是因为多酚的浸出速度达到了一个平衡,温度过高反而使酶蛋白受热发生变性,减少了多酚的含量[26].选取提取温度为70 ℃较合适.
2.3.5提取次数对多酚得率的影响
图6为不同提取次数对多酚得率的影响.
由图6可看出,随着提取次数的增加,葛叶中多酚的得率越来越小.在同样的实验条件下,对葛叶多酚第1次的提取得率为1.81%,第2次提取时多酚得率急剧下降,为0.41%.原因是经过2次提取葛叶中的多酚类化合物基本已浸出,为降低能耗以及避免多次提取造成多酚损失[27],所以提取2次为宜, 2次提取多酚得率共为2.22%.
2.3.6单因素实验小结
实际上葛叶比葛根的多酚含量相对较少,但是经过单因素数据分析可以看出,采用提取时间2 h、提取pH值为4、料液比1∶30、提取次数2次时葛叶多酚提取条件最优,在此条件下葛叶多酚得率可达2.22%.在此条件下葛叶的多酚含量相对较多,可用于后续抗氧化性检测.
2.4葛叶的抗氧化活性结果分析
2.4.1DPPH·清除能力测定结果
图7为不同质量浓度的没食子酸标准液和样液对DPPH·清除率的影响.
由图7结果可知,在实验测定的质量浓度范围内,样液与没食子酸标准液对DPPH·的清除率是随着质量浓度增加而增加.在质量浓度小于1.5 mg/mL时,对DPPH·的清除率较为明显,原因是样液和没食子酸一样含有供氢体,可还原氧化性的自由基,从而终止自由基连锁反应,之后清除率变化开始平缓没有大幅度的变化,可能是试液中的有效物质被氧化[8].
2.4.2清除羟基自由基·OH清除能力测定结果
图8为不同质量浓度的没食子酸标准液和样液对·OH清除率的影响.
由图8结果可知,没食子酸标准液对于羟基自由基的清除率变化相对于样液来说是相对平缓的,标准液在实验浓度范围内对·OH清除能力基本不變,接近于直线.在低浓度时样液的清除率较低,随着浓度的增加曲线呈上升趋势后逐渐平缓,可能是在反应体系中样液对羟基自由基的清除能力到达了一定数值,在质量浓度为6 mg/mL处最大清除率为76.24%.
3结论
用福林酚法测定多酚含量,其质量浓度范围选取在0~4.4 μg/mL,没食子酸质量浓度与吸光值呈良好的线性关系.对葛叶多酚的提取进行单因素实验,得出最优的提取多酚的条件为:提取时间2 h,提取pH值为4,料液比1∶30,提取次数2次,在此条件下提取葛叶多酚得率可达2.22%.对葛叶多酚提取液进行精密度、稳定性及加标回收率实验,结果表明:精密度实验相对标准误差为0.27%;稳定性实验相对标准误差为0.94%;加标回收率实验相对标准误差为1.66%,证明该方法的准确度良好,可应用于葛叶多酚含量的测定.在实验质量浓度0.5~2.5 mg/mL范围内葛叶多酚提取液对DPPH·和·OH的最大清除力分别为80.99%和76.24%,证明提取液具有较好的抗氧化性能.
参考文献
[1] 周龙洋,叶大东,苟洪昱.达县野生葛根资源保护与开发利用初探[J].中国园艺文摘,2010,26(12):78-79.
[2] 吴庆玲,许缘巧,章琼蕾,等.葛叶的研究进展[J].科技创新与应用,2016(11):62-63.
[3] 王淑惠,雷荣爱,宋二颖,等.葛根地上部分挥发性成分的研究[J].中国药事,2002,16(2):107.
[4] 张杰.荷叶多酚的稳定性及荷叶多酚特型黄酒的工艺研究[D].芜湖:安徽工程大学,2018.
[5] 唐婷范,刘雄民,凌敏,等.蒜头果皮果肉抗氧化成分提取及其抗氧化性质研究[J].食品科学,2012,33(2):16-19.
[6]AGATONOVIC-KUSTRIN S,MORTON D W. HPTLC -bioautographic methods for selective detection of the antioxidant and α-amylase inhibitory activity in plant extracts[J]. MethodsX,2018,5:797-802.
[7]SHEN Y B,ZHANG H,CHENG L L,et al. In vitro and in vivo antioxidant activity of polyphenols extracted from black highland barley[J].Food Chemistry,2016,194:1003-1012.
[8] 唐婷范,杜丹丹,邓起东,等.毛冬青叶多酚的提取工艺及其抗氧化性质的研究[J].食品研究与开发, 2018, 39(9):23-28.
[9] CHEN R Z,LIU Z Q,ZHAO J M,et al. Antioxidant and immunobiological activity of water-soluble polysaccharide fractions purified from acanthopanax senticosu[J]. Food Chemistry,2011,127(2):434-440.
[10] 张保,张萌,李立天,等.拐枣枝多酚提取工艺优化及其抗氧化活性研究[J].食品研究与开发,2017,38(23):50-56.
[11] 何岚,李俊年,杨冬梅,等.植物酚类化合物对东方田鼠体重增长和内脏器官发育的作用[J].兽类学报,2010,30(3):297-303.
[12] 魏欢,李翔宇,于全平,等.添加5种植物酚类化合物对高精料底物瘤胃体外发酵及产甲烷的影响[J].草业学报,2018,27(11):192-199.
[13] 董科,冷云,何方婷,等.植物多酚及其提取方法的研究进展[J].食品工业科技,2019,40(2):326-330.
[14] 关海宁,刁小琴,乔秀丽,等.响应面优化超临界CO2萃取玉米须多酚工艺及抗氧化性研究[J].食品研究与开发,2019,40(6):120-125.
[15] 方瑞娜,赵心瑗,贾小菊.响应面法优化微波辅助提取诺丽果多酚工艺研究[J].食品研究与开发,2018,39(21):106-111,145.
[16] 齐泊霖,高尊,谢春阳.响应面法优化超声波辅助法提取稠李子多酚的工艺研究[J].食品研究与开发,2019,40(4):71-76.
[17] 宋力,薛灵芬,李森,等.回流法提取菠萝皮中多酚及其含量的测定[J].信阳师范学院学报(自然科学版),2016,29(4):592-595.
[18] 王周,张驰翔,蒲博,等.溶剂回流法提取石榴皮总多酚及抗氧化活性的研究[J].食品工业,2015,36(7):57-62.
[19] 朱仙慕,陈丹,马国萍,等.叶下珠薄层色谱鉴别及福林酚法测定总多酚含量研究[J].中国中医药科技,2018,25(4):514-519.
[20] 陈君,裴世成,吴钢.不同采收期倒地铃总黄酮及芦丁的含量变化[J].广西科技大学学报,2015,26(4):6-8,16.
[21] 黄瑶,高年芬,谭俊呈,等.酶法制备青钱柳茶汤的工艺研究[J].广西科技大学学报,2016,27(4):116-121.
[22] LI J,ZHANG S T,ZHANG M N,et al. Novel approach for extraction of grape skin antioxidants by accelerated solvent extraction:box-behnken design optimization[J]. Journal of Food Science and Technology,2019,56(11):4879-4890.
[23] 姚宏亮,沈洁,佴逸凡.藕皮多酚提取工艺优化及其体外抗氧化性研究[J].食品研究与开发,2019,40(14):103-108.
[24] 杨希,叶明.高钙菊花枸杞酸奶的研制及其体外抗氧化降血糖功能[J].广西科技大学学报,2018,29(3):108-114,128.
[25] 姚奉奇.茶叶多酚类衍生物热解和氧化特性及其反应机理研究[D].合肥:中国科学技术大学,2018.
[26] 袁晶,张海燕,曾朝珍,等.超声波辅助复合酶法提取苹果多酚工艺优化[J].保鲜与加工,2019,19(6):159-163.
[27] 黄艳,孙怡婷,张见明,等.松毛菇多酚的提取及纯化工艺研究[J].食品研究与开发,2019,40(21):106-114.
Extraction technology of polyphenols from Pueraria lobata leaf and its antioxidant properties
TANG Tingfan1,2, ZHU Jiaqing1,2, LI Rongbin1,2, FENG Jun1,2, HUANG Fangli1,2, LIANG Jieting1,2, TIAN Yuhong, LI Xiaohui1,2, CHENG Hao*1,2
(1.School of Biological and Chemical Engineering, Guangxi University of Science and Technoloy, Liuzhou 545006, China; 2.Guangxi Key Laboratory of Green Processing of Sugar Resources (Guangxi University of Science and Technoloy), Liuzhou 545006, China)
Abstract: The polyphenols in Pueraria lobata were extracted by reflux method, and the content ofpolyphenols in Pueraria lobata was determined by Folin phenol method. The applicability of polyphenols in Pueraria lobata was verified by precision, stability and standard addition recovery tests and the antioxidant properties of polyphenols from Pueraria lobata were studied. The single factor experiment was used to study the effect on the yield of polyphenols from Pueraria lobata. The results showed that the optimum extraction conditions were as follows: solvent pH=4, solid-liquid ratio 1∶30, 70 ℃ water bath for 2.0 h, the relative standard error of precision test was 0.27%; the relative standard error of stability test was 0.94%; the relative standard error of recovery experiment was 1.66%; under these conditions, the yield of Pueraria leaf polyphenols was 2.22%. Polyphenols from Pueraria lobata had strong scavenging effect on DPPH· and ·OH, with the maximum scavenging rates of 80.99% and 76.24%, respectively. The process of extracting polyphenols from Pueraria lobata by reflux method is reasonable and simple, and the extracted polyphenols have strong antioxidant activity, providing basic research for the development and utilization of Pueraria lobata polyphenols.
Key words: leaves of Pueraria lobata; polyphenols; extraction technology; antioxidation
(責任编辑:黎 娅)
收稿日期:2020-09-14
基金项目:广西研究生教育创新计划项目(GKYC202012);国家自然科学基金地区科学基金项目(21662003);广西壮族自治区中青年教师
基础能力提升项目(KY2016YB250);广西糖资源绿色加工重点实验室主任基金(GXTZY201901);广西科技大学博士基金项目
(校科博14Z06)资助 .
作者简介:唐婷范,博士,高级实验师,研究方向:天然产物化工.
通信作者:程昊,博士,副研究员,研究方向:应用化学,E-mail:iamchenghao@126.com.
