2021版《ACG临床指南:特异质性药物性肝损伤的诊断和处理》精粹介绍及相关思考
2021-06-08于乐成刘鸿凌赵新颜马世武陈成伟
于乐成 刘鸿凌 赵新颜 马世武 陈成伟
2021年5月,美国胃肠病学会(American College of Gastroenterology,ACG)发布了新版《ACG临床指南:特异质性药物性肝损伤的诊断和处理》(简称《指南》)[1]。这是该《指南》自2014年首次发布以来[2],时隔7年进行的修订和更新。现对该《指南》进行介绍。
特异质性药物性肝损伤(idiosyncratic drug-induced liver injury,IDILI)在胃肠病学和肝脏病学临床实践中颇为常见,临床表现多样,可从无症状性肝脏生化指标升高到出现肝细胞性或胆汁淤积性黄疸、肝衰竭或慢性肝炎。在西方国家,抗菌药物、草药和膳食补充剂(herbal and dietary supplements,HDS)及抗癌药物(如酪氨酸激酶抑制剂或免疫检查点抑制剂)最为常见。诊断目前仍为排除性,需要对导致肝损伤的各种病因进行仔细评估,以便排除其他病因和建立DILI的临床诊断。终末期肝病模型(model for end-stage liver disease,MELD)评分和并存疾病负担是疑似DILI患者病死率的重要决定因素。若存在肝细胞性黄疸,DILI的病死率可达10%。若出现进展性黄疸,无论伴或不伴凝血功能异常,应送至三级医疗中心接受专业诊治,必要时需考虑肝移植。系统性应用糖皮质激素治疗DILI的价值尚有争议,但如难以区分DILI还是自身免疫性肝炎(autoimmune hepatitis,AIH),或DILI呈现突出的AIH样特征,则可考虑应用糖皮质激素。
2021版《指南》共有23条 “提示点”(key concepts)和16条推荐意见。
一、概论
本《指南》写作组受美国胃肠病学会和实践准则委员会的委托,依照循证医学的策略进行撰写。检索数据库包括:(1)MEDLINE数据库截止2020年9月收录的关于DILI的正式评论和分析;(2)美国内科医师协会手册关于健康实践和设计实践指南的评估;(3)ACG的指南制定政策;(4)《指南》起草者和外部评审者关于IDILI诊治的临床经验。
该《指南》提出的推荐意见(表1)具有一定的灵活性,对具体患者应根据情况进行适当调整。推荐意见尽可能基于证据;若缺乏相关证据,则基于《指南》起草组的共识性意见。由2名经过正规训练的方法学专家采用“推荐意见分级的评估、制定和评价(GRADE)系统”(表2)对证据的质量进行评估。当公众健康获益十分明确和/或收效非常值得怀疑时,推荐意见的强度并不总是取决于证据的GRADE质量级别。对于不宜按照GRADE程序处理的声明,则以“提示点”的形式表现。在某些情况下,提示点是基于对证据的外推和/或专家观点。

表1 推荐意见汇总

表2 推荐意见分级的评估、制定和评价(GRADE)
本《指南》未特别提及自身免疫性DILI,以及他汀类药物和其他降脂药物或化疗药物相关的DILI。建议读者关注LiverTox网站,该网站为卫生保健工作者和患者提供了1 200余种特定药物和补充剂所致肝毒性最新的、无偏见的实用资源。
引起DILI的药物及其临床表现广泛多样,且缺乏客观的诊断试验。尽管DILI在人群中的总体发病率较低,但临床医师在面对不明病因的急性和慢性肝损伤,以及在处方特定的药物(例如咪唑硫嘌呤、抗TNF药物、磺胺类药物)时,必须考虑到DILI的可能性。
DILI可分为固有型(intrinsic type)和特异质型(idiosyncratic type)。当药物剂量足够大时,固有型DILI在人类和动物模型中具有可预测性。特异质型DILI相对少见,仅见于易感者,与药物剂量的关系不够一致,临床表现差异更大。虽然新近有数据开始模糊这两型DILI之间的区别,但这种划分仍是有用的概念模式。对乙酰氨基酚(APAP)是最常见的、唯一仍在广泛应用的可导致固有型DILI的药物。APAP肝毒性的临床表现相对容易识别,且有关诊治指南业已建立。本《指南》专注于更广泛且更难诊治的特异质型DILI。此外,在临床实践中根据潜伏期、肝损伤模式(R值)、死亡风险(Hy’s法则)、结局(消退或慢性化)等特征(见表3)对DILI进行评估和处置是至关重要的。

表3 术语和定义
儿童和成人的疾病谱不同,引起DILI的药物也有所不同。年龄对DILI易感性的影响可具有药物特异性。如抗惊厥药等中枢神经系统药物和米诺环素等抗微生物药是引起儿童DILI最常见的病因。婴幼儿和儿童对丙戊酸钠相关肝损伤敏感,发生阿司匹林相关Reye综合征的风险也增加。虽然各年龄段患者均可发生丙基硫氧嘧啶(PTU)相关肝损伤,但儿童患者更易发生严重甚至致命性的PTU肝中毒。随着年龄增大,机体对异烟肼、阿莫西林-克拉维酸和呋喃妥因相关肝损伤的风险增高。
二、遗传和非遗传性危险因素
目前对DILI的遗传性风险因素认知有限。非遗传性风险因素可能与宿主、环境及药物因素相关(表4)。

表4 易使个体发生特异质型药物性肝损伤的变量
尚无证据提示妇女对所有药物所致的DILI均有更高的风险,但妇女罹患某些药物(如米诺环素、甲基多巴、呋喃妥因和奈韦拉平)所致DILI的风险可能更高。米诺环素、甲基多巴、双氯芬酸和呋喃妥因所致DILI的典型特征是类似于自身免疫性肝炎(AIH)的慢性肝炎,女性多见。
DILI是引起妊娠期妇女急性肝损伤的少见病因。引起妊娠期DILI的药物一般是不常使用的处方药。无证据显示妊娠本身可增加除了四环素之外药物的易感性。常见引起孕妇DILI的药物包括某些抗高血压药物(甲基多巴、肼苯哒嗪等)、抗逆转录病毒药物和PTU。在停用可疑药物后,大多数肝损伤可自然恢复,但偶有需要肝移植和引起母体死亡的报道。
虽然动物试验显示糖尿病可增加某些药物(如APAP)所致DILI的易感性,但临床上并无证据提示糖尿病可增加患者对所有药物所致DILI的易感性。在糖尿病患者,甲氨蝶呤和抗结核药物所致的肝损伤可能增多。美国药物性肝损伤网(US-DILIN)数据显示,这些患者的糖尿病基础与死亡或肝移植需求独立相关。
虽然RUCAM量表将饮酒作为DILI因果关系评估的一大因素,大量饮酒也是APAP、甲氨蝶呤及异烟肼等药物所致DILI的危险因素,但并无证据显示慢性饮酒是所有类型药物所致DILI的危险因素。建议大量饮酒者不要使用度洛西汀。US-DILIN新近报告,导致重度饮酒者DILI最常见的病因是合成代谢类固醇(可能是联想相关),但与非DILI患者相比,重度饮酒与临床结局的恶化并无关联。
尽管尚无证据显示药物-药物相互作用(DDI)及多重用药可增加所有类型药物所致DILI的发病风险,但这两种情况常与DILI的危险因素相关。DDI可具有潜在的增加抗结核药物和丙戊酸钠等抗惊厥药物所致DILI的风险。
(关于DILI危险因素的)提示点:
1.虽然文献描述了有关DILI发病风险的多种宿主因素、环境因素和药物相关因素,但没有证据提示这些因素是所有药物相关DILI的主要危险因素。
2.年龄、性别、饮酒等因素可增加某些特定药物引起DILI的风险。
三、DILI的诊断和因果关系评估
DILI的诊断仍为排除法,主要依赖详细的病史采集、合理的血液检查、肝胆影像检查和肝活检等进行判断。诊断流程基于相关临床评分系统。虽然这些评分系统的诊断架构有助于将临床病史和各项检查进行整合,但清晰度不足,准确性也未得到充分证明。诊断DILI所需的最低建议数据见表5。

表5 疑似药物性肝损伤(DILI)诊断评估的最低建议要素
详细的病史调查对诊断DILI非常必要。准确掌握用药史、肝损伤发病时间、肝脏生化指标的变化过程至关重要。DILI通常在开始用药6个月内发病,但也有例外,例如呋喃妥因、米诺环素、他汀类药物(表6)倾向于在更长的潜伏期后引起DILI。

表6 最常引起或已得到详细描述的引起肝损伤的药物及其所致肝损伤模式
了解最常见和最罕见与DILI相关的药物,将大大促进DILI相关病史的准确采集。还应注意到非法药物的使用,例如亚甲基二氧甲基苯丙胺等药物与肝损伤有关,在某些情况下还与ALF有关。总体上,抗生素和抗癫痫药物是最常见引起DILI的药物,占DILI总数的60%,而抗高血压药和降糖药相对不太常见引起DILI。HDS所致DILI报告越来越多,因此密切询问HDS的使用情况是至关重要的。
四、诊断评估:血液试验和影像研究
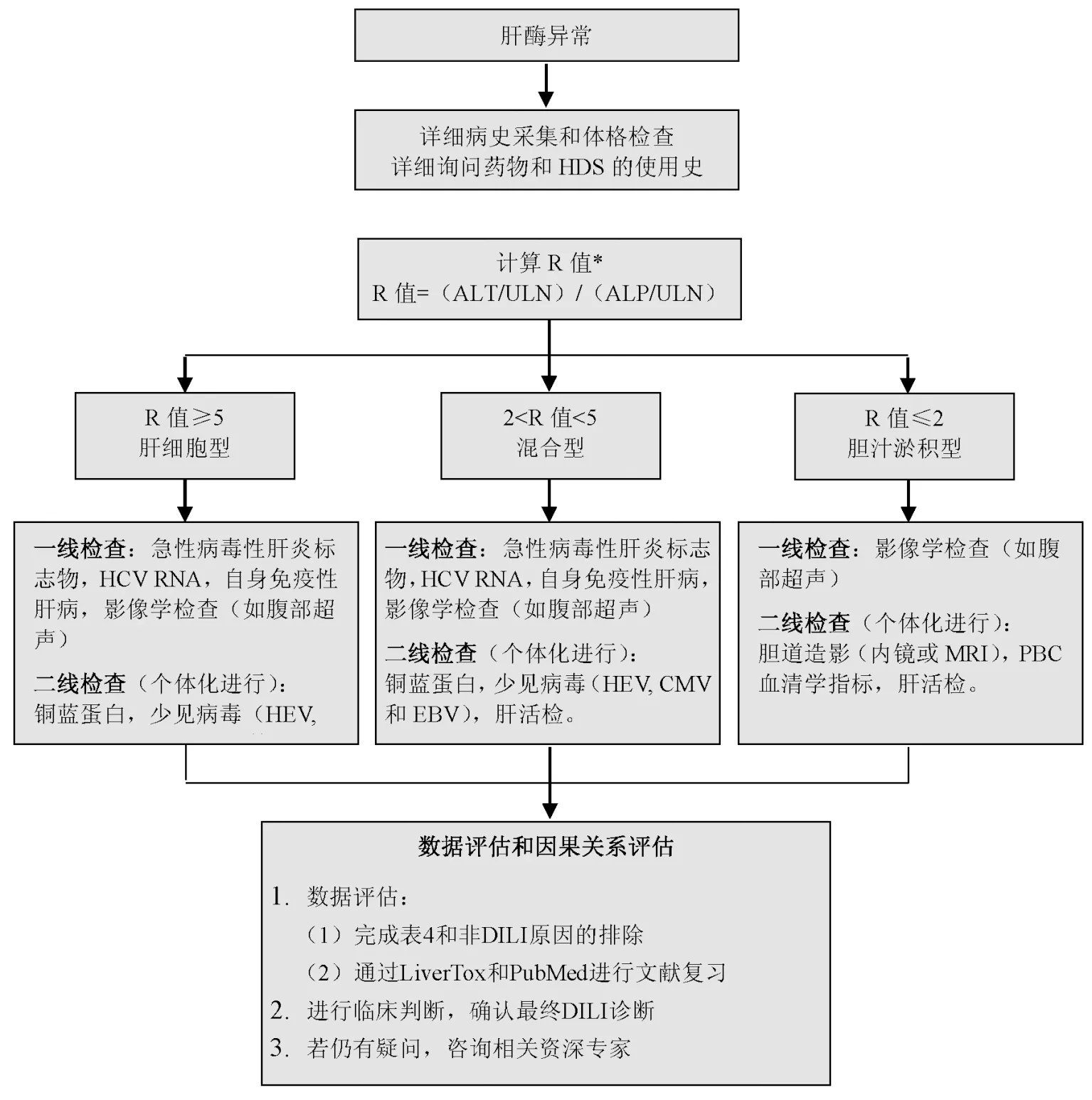
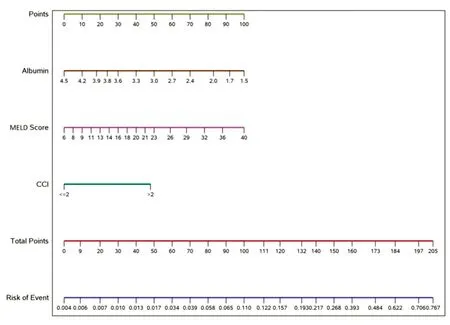
DILI的诊断可以根据发病时的肝损伤类型加以划分。通常,R>5为肝细胞损伤型,R<2为胆汁淤积型,2 急性肝细胞型肝损伤的鉴别诊断包括:急性病毒性肝炎,自身免疫性肝炎(AIH),缺血性肝损伤,急性布加综合征和威尔逊病。值得注意的是,急性胆道梗阻一开始可表现出肝细胞型损伤的特点,但随后进展为胆汁淤积型的表现。 急性丙型肝炎和急性戊型肝炎感染常“伪装”成DILI。由于最初丙型肝炎抗体可能为阴性,因此其诊断具有挑战性。最近一项DILIN前瞻性研究报道,1.5%的急性丙型肝炎患者被误诊为DILI。因此对于疑诊为肝细胞损伤型DILI患者,推荐检测HCV RNA以排除急性丙型肝炎感染。另一项DILIN前瞻性研究报道,3%疑诊为DILI的患者检测出戊型肝炎IgM抗体阳性。由此可见:对于疑似DILI的人群,特别是与急性病毒性肝炎临床特征相符合的人群,推荐进行急性戊型肝炎血清学检测。虽然通过检测抗-HEV IgM可以很容易诊断出多数急性戊型肝炎,但当前该检测的可靠性仍不高。因此HEV血清学检测最适于具有明显危险因素的患者(如疫区旅行史),在这种前提下能够提高检测的准确度和预测值。急性巨细胞病毒(CMV)、EB病毒(EBV)、单纯疱疹病毒(HSV)感染有时也可能会出现肝脏生化指标的异常,但这类患者常伴有一些特征性表现,包括淋巴结病、皮疹及异型淋巴细胞全身系统表现等。 所有类型的DILI均应与AIH进行鉴别。事实上,一些药物易于导致自身免疫样DILI(autoimmune-like DILI,AL-DILI),例如米诺环素和呋喃妥因。通常需要检测血清抗核抗体(ANA)、抗平滑肌抗体(ASMA)等自身抗体及IgG水平,少数患者可考虑肝活检加以鉴别。低滴度(<1:80)自身抗体水平对于鉴别诊断价值有限,因为约30%成年人,特别是女性,可能会出现低水平自身抗体。免疫检查点抑制剂(ICIs)相关的肝损伤正在迅速增加,其诊断通常依据特定的临床背景,自身免疫性标记物可阴性,组织学不一定出现特发性AIH的典型病理表现。 威尔逊病(Wilson disease)是一种罕见病,尽管小于40岁的年轻患者疑诊为DILI时均应筛查血清铜蓝蛋白,但也有老年人诊断为威尔逊病的报道。通常,铜蓝蛋白正常或增高可排除该病,但铜蓝蛋白是一种急性期反应蛋白,可能会在急性肝炎过程中出现假性正常或增高。当存在疑问或铜蓝蛋白水平减低时,可根据威尔逊病诊断指南进行以下检测,包括24 h尿铜、裂隙灯检测K-F环、血清铜水平、ATP7B基因检测。布加综合征有时与DILI表现类似,存在痛性肝肿大和/或腹水量迅速增加时,应考虑此病。 对于疑似胆汁淤积型DILI的人群,特别需要鉴别胰胆管疾病,其可累及肝内或肝外胆管。肝外胆管受累的病因包括胆总管结石或恶性肿瘤(如胰胆管肿瘤或淋巴瘤),很容易通过腹部影像技术(超声、CT或MRI)加以鉴别。然而,各种肝内胆管受累性疾病可与DILI表现类似,必须加以鉴别。鉴别诊断的方法包括:详细的病史采集和物理诊断(例如败血症、全胃肠外营养或心力衰竭),用于诊断原发性胆汁性胆管炎(PBC)的抗线粒体抗体(AMA)等血清学检查,或影像学检查(肝脏转移瘤,副癌综合征或硬化性胆管炎)。对于疑似DILI的患者,内镜下逆行胆管造影仅用于常规影像检查无法排除嵌顿性胆管结石或原发性硬化性胆管炎(PSC)的患者。 在DILI评估过程中,肝活检为非必要检查。在DILIN注册研究中,前300例接受肝活检的比例不足50%。DILIN入组患者因转诊偏倚和入组标准严格,肝损伤严重程度较重。据推测,轻度肝损伤患者肝活检率可能更低。然而,对于某些疑诊DILI的病例而言,肝活检是有益的、甚或具有诊断价值。最近一项DILIN前瞻性研究描述了大量确诊为DILI患者的组织学特征。其他研究中也有类似报道。但依据肝活检进行确诊的DILI比例较低。肝活检通常作为常规检查的补充,可提示其他诊断或排除竞争性病因,而非揭示教科书级的典型DILI病理学表现。 某些情况下,例如鉴别AIH和DILI时,强烈推荐肝活检。目前AIH的诊断流程包括组织学检查。AIH通常会对免疫抑制治疗产生应答,但往往需要长期治疗,并且具有相关风险和副作用。因此,在仍需鉴别AIH或拟采用免疫抑制治疗时,推荐肝活检。值得注意的是,在某些病例,药物可能诱发AIH。多数情况下,药物诱导的AIH在停用免疫抑制剂后不会引起AIH的复发,而特发性AIH一旦停用免疫抑制剂多数患者的病情将复发。近来的数据表明应用糖皮质激素治疗后,ALT早期应答可能有助于鉴别DILI和AIH。 一般而言,肝脏生化指标的持续异常会增加肝活检的必要性。大多数DILI病例在停用导致肝脏损伤的药物后,肝生化指标稳定下降。这种现象通常被称为药物廓清(washout)或去激发(dechallenge),同时有助于DILI诊断。而肝脏生化指标持续异常往往不支持诊断DILI,而是增加了其他诊断的可能性,如PSC、AIH、PBC、恶性肿瘤或肉芽肿性肝炎。胆汁淤积型DILI的病程一般长于肝细胞损伤型。肝活检时机视具体情况而定。一些学者认为,(对于肝细胞型DILI)停用可疑药物30 d后ALT峰值下降不足50%,诊断为DILI的可能性减低。也有学者则认为ALT降低一半以上的截点时间(cutoff time)为60 d。对胆汁淤积型DILI而言,若在发病180 d时ALP或胆红素水平无显著下降(较峰值下降50%以上,或降至<2×ULN),则不支持诊断DILI。但目前尚无前瞻性研究对基于这些时间截点的肝活检结果进行检验。因此,若急性肝细胞型DILI发作后60 d或胆汁淤积型DILI发作后180 d肝脏生化指标仍未复常,则进行肝活检是合理的。如果肝脏生化指标持续上升,特别是有肝衰竭征象时,有理由进行早期活检。反之,如果肝脏生化指标逐步下降,尽管速度慢,则推迟肝脏活检也是合理的。DILI也可能导致慢性损伤如胆管消失综合征,若怀疑此种情况,则肝活检有助于诊断和判断预后。 当临床考虑有必要继续或再次应用可疑药物时,肝活检也是必要的。关于长期接受甲氨蝶呤治疗时肝活检的评估指南已经发布。对于其他一些药物(如异烟肼和化疗药物),肝活检也有助于评估再次暴露的风险。对于甲氨蝶呤引起的纤维化和脂肪变性,Roenigk分类系统是公认的组织学评价标准。对于其他药物,风险分层通常是基于对坏死和纤维化程度的评估。在DILIN和其他队列研究中,嗜酸性粒细胞浸润和坏死程度较轻提示生化复常的可能性增加。接受过肝移植手术的患者较为特殊,需通过肝活检除外排斥反应等竞争性病因后才能考虑诊断DILI。 研发有关DILI诊断和预后判断的血清生物标志物也越来越引起人们的兴趣。血清谷氨酸脱氢酶和miRNA-122是有潜力的候选标志物,而角蛋白18、骨桥蛋白和巨噬细胞集落刺激因子受体可能有助于预测急性DILI的预后。但该领域的研究尚不成熟,这些生物标志物还不能常规应用于临床实践。 对疑似DILI患者的评估流程见图1。 *R值仅作为参考。检查及其顺序必须基于患者整体情况,包括鉴别诊断中的危险因素(例如最近到HEV流行区旅行),相关症状(例如腹痛和发热)以及实验室检查时间(R值可能随DILI发展而变化)。ALP,碱性磷酸酶;ALT,丙氨酸氨基转移酶;CMV,巨细胞病毒;EBV,EB病毒;HCV,丙型肝炎病毒;HEV,戊型肝炎病毒;HSV,单纯疱疹病毒;ULN,正常上限值。图1 疑似特异质型DILI的评估流程图 (关于DILI诊断的)提示点: 1.当疑诊DILI时,应明确用药史及起病时的肝脏检测异常项目。 2.DILI是一种排除性诊断,因此应当系统性排除其他需要进行鉴别的病因。 3.根据R值可以将DILI分为肝细胞损伤型、胆汁淤积型或混合型。这种分型允许对需要进行鉴别的病因进行系统性排查。 4.肝活检可支持临床疑似DILI病例的诊断,提供有关疾病严重程度的重要信息,也有助于排除需要进行鉴别的其他肝损伤病因。 推荐意见:见表1第1~3条,是关于DILI诊断的建议。 DILI因果关系评估方法包括:(1)RUCAM量表;(2)Maria和Victorino系统,又称临床诊断量表(Clinical Diagnostic Scale,CDS);(3)2004日本消化病周量表(the Digestive-Disease-Week Japan 2004 scale,DDW-J),该表仅在日文文献中发表,但在英文文献中有引用。这些因果关系评估工具与DILI诊断的黄金标准和专家共识相比表现良好,其中以RUCAM量表[3-4]应用最广,颇受部分临床医师、制药工业和药物监管机构的青睐。 RCUAM被设计用来在床边或诊所应用,总分为-10到14,评分越高则DILI的可能性也越大。评分结果分为以下几个可能性水准:(1)排除(excluded,≤0分);(2)不可能(unlikely,1~2分);(3)可能(possible,3~5分);(4)很可能(probable,6~8分);(5)极可能(highly probable,≥9分)。RUCAM量表将DILI分为肝细胞损伤型、胆汁淤积型和混合型。根据暴露的时间和肝脏生化指标复常情况,DILI的风险因素,合并用药情况,其他病因的排查(鉴别诊断),以及再用药情况等进行加减分。对RUCAM量表的某些指标如何评分尚存在歧义,复测的可靠性也不尽满意(据2008年Rochon等的研究报告,可靠系数为0.51,95%可信区间上限为0.76)。而且,2010年Rockey等报告,RUCAM与基于专家共识观点的美国DILI网络(DILIN)因果关系评分系统相比,一致性仅为中等(相关系数r=0.42,P<0.05)。 DDW-J和CDS评分系统是对RUCAM的修订,在评估项目的数量方面存在差异,对药物因素或患者特征的赋分权重也有所不同。其中CDS在将因果关系归结为“很可能”(probable)方面更为严格,采用了一个苛刻的数值评分范围。尽管有这些限制,但有助于加强对DILI的临床印象,尤其是对于不常见到DILI的临床医师。其最大用途也许在于为临床医师如何整合病史和相关检查结果以诊断DILI提供了一个逻辑框架。它提醒临床医师要特别注重DILI病史的采集,尤其要注意精准记录药物暴露时间和潜伏期。 (关于DILI因果关系评估量表和专家共识的)提示点: 1.包括RUCAM量表在内的DILI评分系统不应作为识别DILI的唯一工具,因为这些评分系统在重复测试的可靠性方面尚不令人满意,也缺乏严格的验证;但临床医师可将其作为DILI的诊断框架,以便在对疑似DILI患者进行评估时排除其他肝损伤病因。 2.肝损伤病因进行全面评估后的专家共识观点,可能是目前对疑似DILI患者建立药物与肝损伤之间因果关系的金标准,但这种方法在临床实践中难以广泛开展,因此不推荐在临床实践中应用。 3.对病史和肝损伤病因进行仔细评估后,仍不能明确DILI的诊断,临床医师应考虑寻求咨询相关专家,以便确认DILI的诊断及可疑药物和肝损伤之间的因果关系。 急性DILI患者停用可疑药物后6个月内通常能自行恢复,部分患者可发展至ALF或慢性肝损伤。美国DILIN前瞻性研究纳入的899例确诊(definite)、很可能(probable)或可能(possible)DILI的患者中,69%康复,17%发展至慢性肝损伤(定义为发病6个月以上肝脏生化指标仍升高),10%死亡或接受肝移植。有一项基于人群的研究发现,23%的DILI患者需住院治疗,黄疸是最常见症状。年龄、种族和性别等临床特征与严重肝损伤的相关性研究也有报道。一项纳入99例DILI患者的研究发现,持续性肝损伤患者的年龄明显高于治愈患者(平均年龄52岁对43.7岁,P=0.01)。与白人相比,非裔美国人更易发生严重肝损伤、住院率更高、肝移植或肝脏相关死亡的发生率更高,且容易发展为慢性肝损伤。非裔美国人和白人中,最常使用的导致DILI的药物分别是甲氧苄氨-磺胺甲恶唑和阿莫西林-克拉维酸。大样本DILI研究提示,女性患者占56%~70%,这表明女性发生特异质型DILI的风险较高,且发生更严重肝损伤的风险也更高。 DILI预后部分取决于肝损伤类型。胆汁淤积型肝损伤患者发生慢性肝损伤的概率是肝细胞损伤型患者的两倍。相比之下肝细胞型DILI更可能致命或需要肝移植。多数情况下,导致ALF的肝细胞型DILI表型发展较慢,这与APAP导致的ALF不同。 多项研究数据支持Zimmerman于1978年最初发现的10%规律,后来将其定义为“ Hy’s法则”(见表3)。美国ALF研究小组一项纳入1 198例ALF的研究显示,有11%的ALF患者明确为DILI所致,3周无移植存活率仅为27%。未行移植患者的死亡原因主要是全身感染和/或脑水肿。在美国,除APAP外,因ALF导致肝移植患者的最常致病药物包括抗结核药、抗癫痫药和抗生素。对于DILI相关ALF患者,可参考英国国王学院(King's College)标准和美国ALF研究小组非APAP相关ALF标准对其预后和肝移植时机进行评估,但这两种标准并非专门为DILI所制定。 Hayashi等报道,MELD评分19分和修正的Hy’s法则(nrHy’s法则,定义为TBil≥2.5 mg/dL,R>5)可以很好地预测DILI发病后26周内与肝脏相关的死亡情况,c统计量分别为0.83和0.73。Ghabril等最近研发并验证了一种模型,包括白蛋白、MELD评分和Charlson合并症指数等指标,可准确预测可疑DILI患者的6个月病死率;该模型的这种预测效能在306名疑似DILI患者中得到证实,c统计量为0.89(95%CI=0.86~0.94)。在含有254名患者的验证队列中,c统计量高达0.91(95%CI=0.83~0.99)。据此模型研发的病死率计算器,可在诊所或床旁使用(图2)。 (关于DILI预后的)提示点: 1.特异质型DILI预后相对较好,约10%患者可达到急性肝衰竭(ALF)的阈值(凝血功能障碍和脑病),发展为慢性肝损伤者不足20%。 2.DILI相关ALF预后较差,其中40%需要肝移植,42%死亡。肝性脑病重和MELD评分高者预后差。 3.预后评分系统已研发成功,在识别有死亡风险的DILI患者方面表现良好。 推荐意见:见表1第4条,是关于DILI预后的建议。 这项经过验证的预测模型,纳入了Charlson合并症指数、终末期肝病(MELD)模型评分和血清白蛋白水平,可预测疑似急性DILI患者的6个月病死率。顶部的线性评分为Charlson合并症指数、MELD评分和血清白蛋白评分的指定得分。与总分相关的6个月病死率风险在图底部的2个线性刻度上。引自参考文献[5]。图2 药物性肝损伤(DILI)患者6个月病死率预测列线图 一般情况下,对于正在发生或既往发生DILI的患者,最好避免再次应用可疑肝毒性药物。临床医师对肝损伤药物再刺激的担忧是基于机体对药物肝毒性存在记忆反应。在这样的情况下,甚至是在初次用药时肝损伤较轻的情况下,再次用药也可能会导致较初次用药更快、更严重甚至致命的肝损伤发作。虽然并非对所有药物均是如此,但免疫反应是许多此类肝损伤反应的发病基础,这也支持何以重复用药会导致更严重的肝损伤。除非可疑肝损伤药物对最为威胁生命的原发性疾病而言是无可替代的治疗方法。例如,在艾代拉利司(Idelalisib)、瑞格非尼(Regorafenib)、瑞博西尼(Ribociclib)和帕唑帕尼(Pazopanib)等新型抗癌药物的说明书中,越来越多地插入关于在剂量调整的情况下恢复用药(再次用药)的建议。临床医生应当认识到药物的这些肝毒性反应,并对患者进行细致的教育培训,告知患者疑似伤肝药物的名称,鼓励患者佩戴提示再用药可能会导致更严重肝毒性反应后果的医学警报腕带和卡片。 推荐意见:见表1第5条,是关于再用药(再暴露或再激发)的建议。 DILI治疗的关键是停用可疑药物。早期停药可能阻止进展至ALF,但缺乏确凿证据支持。某些患者仅服药用2~3 d即可发生致命性肝损伤。对特异质型DILI相关ALF,目前尚无获批的解毒剂。大多数临床医生使用苯海拉明和羟嗪等抗组胺药物治疗症状性瘙痒。此外,入组DILIN前瞻性研究的患者中,多达30%接受了熊去氧胆酸(UDCA)治疗,但其在急性和慢性DILI中的疗效尚不确切。 重度DILI患者接受糖皮质激素治疗并不少见,但尚无随机对照试验来评估其疗效和安全性。仅有有限的回顾性研究表明,可能与病情改善有关,但也有相关研究结果显示其与不良事件增加相关。N-乙酰半胱氨酸(NAC)是一种获准用于治疗APAP过量(引起固有型DILI)的解毒剂。在一项随机安慰剂对照试验中,NAC被用来治疗非APAP 相关的ALF,主要研究结果未达预期(总体生存率改善),但可显著改善伴有早期肝性脑病(Ⅰ-Ⅱ)患者的病情,无移植生存率在NAC组为52%,而在安慰剂对照组为30%。在现代医疗条件下,所有ALF相关的临床试验都受到肝移植的影响,因为肝移植可挽救约40%的非APAP相关ALF患者的生命,但这些患者的真实自然病程将永远未知。NAC临床试验中明确为DILI的患者(N=42),NAC治疗组的无移植存活率为58%,而未接受NAC治疗组为27%。但静滴NAC治疗非APAP 相关ALF患儿的1年生存率较低。南非一项研究应用NAC治疗102名抗结核药相关肝损伤住院患者,结果显示,两个治疗组间的主要终点(达到ALT<100 U/L的时长)和总病死率并无明显差异,但NAC组的住院时间显著缩短(中位数9 d对18 d)研究者认为对于抗结核药物相关DILI住院患者,应考虑静脉使用NAC。 推荐意见:见表1第6~9条,是关于DILI治疗的建议。 约17%的DILI患者可发展为慢性(发病后6个月进行肝功能评估),其中胆汁淤积性肝损伤的慢性化发生率更高。西班牙一项研究以肝损伤发病后1年的肝生化指标异常情况来判断DILI的慢性化发生率约为8%。预测DILI慢性化的因素包括年龄较大、血脂异常、严重DILI、以及与他汀类和抗感染药相关的肝毒性。慢性DILI可能类似于AIH并对糖皮质激素治疗有应答,只要血清学标志物和肝活检检查支持该诊断。曾观察到急性DILI之后可发展至肝硬化及出现相关并发症,但总体上这种情况罕见。 (一)HDS-DILI的流行病学 在全球范围内,HDS-DILI越来越常见,并可导致显著的发病率和病死率。在美国,HDS是导致DILI的第二常见药物。但DILIN前瞻性研究表明,在2004—2014年所有入组病例中,HDS肝毒性例数呈上升趋势,其中用于健身和减肥的补充剂是与肝损伤最常相关的HDS类型。 (二)HDS的监管 临床医生和消费者应当认识到,HDS并不像普通药品研发那样经过严格的监督过程。特别是HDS既没有经过临床前和临床毒理学安全性测试,也没有通过临床试验对其安全性或有效性进行检验。 根据1994年《膳食补充剂健康教育和安全法案》的规定,HDS可以在未经FDA事先批准的情况下上市销售。根据该法案,膳食补充剂的定义是旨在补充膳食缺乏的营养素,而不是完整的膳食。补充剂由饮食成分组成,包括维生素、矿物质、植物萃取剂、氨基酸、酶、器官或腺体组织和代谢产物。医用食品尽管被认为是膳食补充剂,但与常规药物一样在医师的监督下进行管理。但与药物不同的是,医用食品并未经过与药物同样严格的安全性和功效测试。在DILIN系列案例中,有医用食品黄酮过氧化物引起了肝细胞损伤/胆汁淤积混合型肝损伤,部分患者肝损伤严重。 2007年的《膳食补充剂现行生产质量管理规范最终规则》要求生产商有责任标注产品的真实信息和销售安全的产品。FDA的职责是通过食品安全和应用营养中心监测HDS上市后引起的不良事件报告,并在怀疑某种HDS有毒性时将其确定为不安全产品。消费者和医疗保健提供者可以通过药品监督网(MEDWATCH)系统自愿报告不良事件。膳食补充剂制造商必须报告与其产品相关的不良事件,但是报告的自愿性可能会导致报告不足。FDA一旦认为某种产品不安全,就会向消费者和医生发布警告,尤其是在该药物使用受限或需要退出市场的情况下。 (三)HDS-DILI的因果关系评估 当前的因果关系评分系统和评估过程对诊断HDS-DILI存在明显的局限性。 目前尚无专门针对HDS-DILI的因果关系评估量表。与HDS相关的细微差别可能会对因果关系评估方法造成干扰。膳食补充剂的品质易受多种因素影响,包括草药的生长地域或生长条件,以及炮制方法和生产标准。这些因素可能导致它们的成分或浓度随时间以及生产批次的不同而存在差异。此外,HDS产品可能还含有标签上未标明的成分,如污染物或混杂物。有些未标明的成分常常是强效的处方药成份,用以保持HDS产品的预期效果,例如增强性功能成分。还有些未标记的成分,准确地说可能是污染物,包括微生物或重金属。最后需要指出,即使在肝损伤事件和HDS产品之间建立了关联,但HDS产品常常包含很多复杂的成分。尽管某些成分更可能造成肝损伤,但难以排除其他成分的影响,从而很难将肝损伤归因于HDS中的某种成分。 较常用的评估方法包括RUCAM量表和专家评估意见,两者的共同点是都受说明书警示和药物肝毒性事件报告的影响,但RUCAM量表受此影响更为明显。在RUCAM量表中,若有药物肝毒性警告标记则会增加得分。但HDS标签上通常不存在此类警告,因此RUCAM评分很少会得到最高分数。可见,对于HDS肝毒性的判断,专家评估意见可能是最好的方法。专家意见允许评估者考虑所有可用的临床信息,包括对已发表文献的定性评估,以及对相关产品的个人使用经验。 (关于HDS-DILI流行病学、管理及因果关系评估的)提示点: 1.草药和膳食补充剂(HDS)在美国药物性肝损伤(DILI)病因中所占比例越来越高,其中最常见的是健身和减肥补充剂。 2.当前对HDS的管理与传统处方药有很大不同。最重要的是对HDS上市前安全性分析未作要求。 3.患者和(卫生保健服务)提供者必须意识到目前对膳食补充剂的监管不够严格,无法确保市售产品完全安全。应让患者意识到HDS有引起肝损伤的可能性这一事实。 4.考虑到HDS产品的多样性和污染的可能性,当前的(量表)因果关系评估方法不太适合于HDS肝毒性的评估;但专家评估意见很可能最适合HDS肝毒性因果关系的评估,因为其在判断肝损伤的可能性时会考虑所有相关信息。 5.有必要通过食品药品管理局(FDA)的MEDWATCH系统,自愿报告疑似HDS肝毒性病例。 (四)HDS-DILI的临床表现和诊断 HDS肝毒性的诊断方法与常规药物相同,主要在于排除非药物性肝损伤的原因。但临床医生必须询问患者是否使用HDS,因为许多患者都不会主动告知这类病史。诊断HDS肝毒性时需注意某些病例的肝损伤潜伏期可能很长。美国目前HDS-DILI占肝毒性病例总数的20%,主要涉及合成代谢类固醇、绿茶提取物和含有多种成分的保健品。合成代谢类固醇通常导致长时间的胆汁淤积性肝损伤,而绿茶提取物则引起急性和肝细胞损伤。 某些药物或其同类药物引起的DILI模式相对固定,这一重要特征使得临床医生对诊断DILI更有把握。许多药物和肝损伤的这种关联是通过详细观察仔细记录的患者病历后得出的。但在HDS肝毒性病例中,只在少数产品可以观察到常见和重复的肝损伤模式。某些含合成代谢类固醇的健身产品可引起胆汁淤积症,而吡咯双烷类生物碱常引起肝窦阻塞综合征(SOS)。医用食品Flavocoxid和营养补充剂Oxy ELITE Pro与严重的肝损伤相关。大多数HDS引起肝细胞型肝损伤(R>5),但市售健身类HDS产品则是明显的例外。新近DILIN研究报道,在40例绿茶引起的肝损伤患者中,95%为肝细胞损伤型,且与HLA-B * 35:01有关。胆汁淤积性肝损伤患者中,胆管消失的程度预示预后不良。 (五)HDS-DILI的处置 最佳管理方法是临床医生能高度怀疑到HDS与肝损伤有关。由于中草药肝损伤过程的不可预测性,应及时停用相关可疑产品,并密切观察患者病情变化。HDS所致ALF和严重胆汁淤积的处置,与处方药所致肝损伤的处理相似。 推荐意见:见表1第10~13条,是关于HDS-DILI处置的建议。 晚期恶性肿瘤患者因使用ICIs而引起肝损伤的现象在临床上越来越常见。ICI作用机制包括阻断细胞毒性T淋巴细胞抗原-4(CTLA-4)、程序性细胞死亡受体-1(PD-1)和程序性细胞死亡受体配体1(PDL1)。迄今已有7种ICIs获得US-FDA批准(见表6)。接受ICI治疗的患者高达90%出现了与免疫相关的不良事件,并认为这是由于ICIs的脱靶效应所致。约30%的患者出现血清肝酶升高。还需重视的是,HBV再激活既可能发生在那些有慢性HBV感染的患者,也可能发生在既往感染过HBV的患者,其临床表现可能与DILI相似,因此应当对患者进行HBV血清学标志物的评估。DILI通常发生在应用ICI 4~12周或1~3剂之后。DILI起病时通常无症状,且一般为混合型肝损伤,但随后肝损伤演变为肝细胞型。高达50%的患者可检测到低滴度ANA,但很少出现ASMA。黄疸和肝衰竭非常少见。组织学上,ICIs导所致的DILI与AIH不同。德克萨斯州安德森癌症中心最近一项大型回顾性研究显示,在接受各种ICI治疗的5 000多例晚期恶性肿瘤患者中,发生中或重度肝毒性的概率为2%。在这项研究中,对于有或无潜在肝病的患者,其肝损伤特征、对类固醇治疗的反应及临床结局没有差异。尽管接受ICIs联合治疗的患者其DILI发病率高于单纯接受ICI治疗的患者(9.2%对1.2%,P<0.001),但肝损伤的严重程度在ICI单药治疗和联合治疗之间并无显著差异。 在应用ICI或其他化疗药物之前,应进行HBV和HCV的血清学检测。对于病毒血清学试验阳性的患者,不管是以前感染还是并发感染,应根据临床情况应给予适当的抗HBV或抗HCV治疗,或给予乙肝疫苗接种预防。 对于中至重度ICI肝毒性,主要治疗方法是停用或推迟应用ICI,并启动免疫抑制治疗。皮质类固醇是主要使用的免疫抑制剂;对全身皮质类固醇治疗无应答或产生不良反应的严重DILI患者,可加用或保留使用吗替麦考酚酯等替代药物。对于HBV再激活的患者,应进行抗病毒治疗。 美国约有450万成年人或1.8%的成年人被诊断为CLD。最常见的CLD是非酒精性脂肪性肝病(NAFLD,20%)、酒精性肝病(5%)、慢性丙型肝炎(1%~5%)和慢性乙型肝炎(0.5%~1%)。CLD在普通人群中的发病率不断上升,加上越来越多的药物用于治疗各种急慢性疾病,这将导致临床医生更多地面临在CLD基础上发生DILI的患者。美国DILIN前瞻性研究显示,10%的入组患者存在CLD。但有研究提示,临床上表现为急性肝损伤的住院或门诊患者队列中,DILI占比不足1%。某些临床特征,如暴露于已知的肝毒性药物、DILI发病的潜伏期、生化指标、临床和组织学特征,以及先前发表的肝毒性报告,均有助于提高对CLD患者发生DILI的怀疑度。但由于缺乏客观和确证的实验室检查,使得很难在CLD背景下确诊DILI。因此DILI在很大程度上仍然是一种排除性诊断,需要根据临床情况首先考虑更为常见的急性肝损伤原因,如病毒性肝炎、胰胆管疾病、饮酒和缺血。更复杂的情况是,有些CLD可出现黄疸(例如酒精性肝炎、自身免疫性肝炎和慢性乙型肝炎),可能会被误认为是DILI。所幸大多数NAFLD和丙型肝炎患者在疾病活动时并无黄疸表现,尽管肝脏生化指标可能在2~5×ULN之间消长。Lewis和Stine撰写的肝硬化患者处方用药指南可供进一步参考。 由于CLD可能会导致体内药物清除减少、代谢异常、排泌改变或适应性应答减弱,临床上可能会认为CLD患者更易于发生DILI,但目前支持这种假设的证据有限。少数研究提示,疑似NAFLD可增加所有药物所致DILI的风险,包括一些特定的药物如甲氨蝶呤、他莫昔芬和ICIs。尽管担心他汀类药物应用于NAFLD等潜在肝病患者时的肝毒性,却有大量的文献报告潜在的肝病并非DILI发病风险增加的因素。实际上,US-DILIN在历时8年的研究中,在1 188例DILI患者中仅发现22例可归因于服用他汀类药物,CLD并非DILI风险增加的因素。而且,不断更新的数据表明,NAFLD或HCV感染者实际上可能从他汀类药物的治疗中获益。抗逆转录病毒药物的肝毒性似乎在合并HCV或HBV感染的人类免疫缺陷病毒(HIV)感染者中更为常见。然而,越来越多地使用含有替诺福韦(TDF)的方案,减少使用与急性肝损伤相关的药物如双脱氧核苷酸、阿巴卡韦和奈韦拉平,可能会使得HIV相关药物所致的严重急性DILI的发病率下降。慢性HBV、HCV和HIV感染者发生异烟肼肝中毒的风险可能增高,但临床上很难区分肝损伤是病毒感染的自发性发作或波动,还是真正的DILI。肝组织学数据有助于诊断肝移植受者的DILI,但尚需要更多的数据来证实这些观察结果。 Child-Pugh B级和C级肝硬化患者发生DILI的风险可能会增加,在给患者处方药物时应当十分谨慎。治疗丙型肝炎的蛋白酶抑制剂可能会加重Child-Pugh B级和C级肝硬化患者的肝脏失代偿,所以对此类患者应选用不含蛋白酶抑制剂的方案。有报道显示,PBC相关肝硬化患者应用奥贝胆酸治疗可能存在剂量依赖肝毒性,因此对于这类患者有关于奥贝胆酸肝毒性的警告和减少剂量的建议。 关于CLD患者发生DILI后的临床结局,似更有可能发展为重症或缓解过程较慢,因为这类患者肝脏再生能力受损,这与在慢性丙型肝炎基础上发生急性甲型和乙型肝炎时的情况一致。支持这种见解的证据还有:(1)慢性乙型肝炎患者发生异烟肼相关严重肝细胞损伤的风险高于无慢性乙型肝炎的患者;(2)高效抗逆转录病毒药物(HAART)引起的肝损伤在病毒性肝炎患者中似乎更为严重;(3)DILIN前瞻性研究显示,与无潜在肝病的个体相比,有潜在CLD的个体发生DILI的病死率显著增高(16%对5.2%,P<0.001);与不饮酒的DILI患者相比,大量饮酒的DILI患者有更高的氨基转移酶峰值,尽管与肝脏相关的死亡或肝移植情况在两组之间并无显著差异。尚有数据显示,因DILI住院的肝硬化患者,其住院病死率达15.8%。 (关于慢性肝病与DILI关系的)提示点: 1.目前尚无确切数据表明潜在的慢性肝病(CLD)是DILI的一个主要危险因素,但CLD可能会增加某些特定药物引起DILI的风险。慢性HBV和HCV感染者可能更容易发生特定药物(如异烟肼和抗逆转录病毒药物)引起的肝损伤,其后果也可能更为严重。 2.潜在的脂肪性肝病并不增加他汀类药物肝毒性的风险。失代偿期肝硬化患者应用他汀类药物时应重新评估其指征,因为有增加发生横纹肌溶解症的风险。 3.慢性丙型肝炎肝硬化失代偿期患者应避免使用含有蛋白酶抑制剂的方案进行抗病毒治疗。罹患原发性胆汁性胆管炎(PBC)与Child-Pugh B级和C级肝硬化的患者,应用高于推荐剂量的奥贝胆酸治疗与肝功能失代偿有关。 推荐意见:见表1第14~16条,是关于慢性肝病患者DILI处置的建议。 DILI多见于成年人,高龄是其危险因素。许多人误认为儿童DILI发生率低是因为使用处方药较少所致。但儿童DILI确实是存在的,且很可能被低估。儿童DILI以肝细胞损伤型居多。更为有趣的是,儿童对肝损伤的反应与成人存在差异,例如APAP肝毒性在儿童低于成人,而抗癫痫药物在儿童更容易导致严重肝损伤。 DILIN前瞻性研究发现,抗菌药和抗癫痫药是儿童DILI最常见的原因。米诺环素是与儿童DILI相关的最常用的抗菌药物,在成人则是阿莫西林-克拉维酸盐。儿童丙戊酸钠和其他抗癫痫药相关DILI的发生率明显高于成人,且肝损伤程度更加严重。儿童APAP-DILI程度相对较轻,可能与缺乏伴随危险因素(如大量饮酒),以及体内谷胱甘肽水平相对较高等因素有关。 与儿童DILI相关的危险因素包括既往记录的药物过敏病史和潜在的医学状况;因为儿童合并症较少而且很少用药。因此目前尚不清楚潜在的医学状况是否是真正的危险因素。药物代谢酶的个体发生差异可能是特定药物导致儿童DILI的危险因素。丙戊酸钠DILI病例中,婴儿肝毒性风险增加主要与肝脏细胞色素P450(CYP)2C9的表达较低有关,先天性代谢障碍和线粒体功能不全也可能起重要作用。在大多数情况下,儿童DILI的临床特征与成人相似,但也有例外。 儿童DILI与成人一样,具有一定的发病率和病死率。在DILIN前瞻性研究中,63%的DILI儿童需要住院治疗,24%伴有严重肝功能不全,其中5%患者需要肝移植。以发病6个月是否恢复为判断标准,慢性DILI的发生率为17%。儿童DILI潜伏期较长,尤其是米诺环素用于面部痤疮时多见。米诺环素相关DILI可能具有AIH特征,如自身抗体阳性和血清免疫球蛋白升高。许多米诺环素相关DILI的儿童可能需要皮质类固醇激素治疗。 (关于儿童DILI的)提示点: 1.儿童很少发生DILI。用于治疗面部痤疮的抗菌药物(如米诺环素)和抗癫痫药是美国儿童DILI的最常见原因。 2.儿童DILI可能与需要肝移植或导致死亡的重症DILI的发病率和病死率相关。 3.米诺环素引起的DILI潜伏期可能较长(例如>1年),可具有类似AIH的表现。对于有肝病等自身免疫性疾病表现的青少年,应仔细询问是否使用米诺环素治疗面部痤疮。 2021版ACG《指南》立足临床实际和实用,提出23条提示信息点和16条赋予了推荐强度和证据质量等级的推荐意见。新《指南》专注于对IDILI的诊断和处置,信息量很大,值得深入品读。其中有几个观点和提法需要特别指出和思考。 1.虽然IDILI对单个药物而言多是相对稀少的事件,但在总体上IDILI是临床上一种常见的肝病。 2.虽然新近有数据试图模糊固有型和特异质型DILI之间的区别,但这种划分仍是有用的概念模式。 3.药物的特异质性肝毒性反应不是绝对没有剂量依赖性,而是对剂量的依赖性较小。 4.熟悉常见的和典型的DILI相关药物及其肝损伤特点,有助于临床上更精准地判断DILI。 5.强调基于全面排查肝损伤病因的专家共识观点,认为专家评估意见可能是最好的诊断策略,优于RUCAM等评分量表。 6.包括RUCAM量表在内的DILI因果关系评分系统可作为临床医师诊断DILI的逻辑框架,评估结果仅供参考,不能作为诊断DILI的唯一依据。还需指出,新版《指南》引用的仍是1993版RUCAM量表[3-4],未提及、评论和引用由RUCAM量表主要研发者Danan教授等亲自修订的2016版RUCAM量表[6]。 7.新版ACG《指南》对诊断慢性DILI的病程界定,既不是2014版ACG《指南》[2]和我国2015版《药物性肝损伤诊治指南》[7]建议的肝脏生化指标在起病后6个月仍未恢复至基线或正常水平,也不是欧洲肝病学会(EASL)2019版《EASL临床实践指南:药物性肝损伤》中提出的1年为界[8],而是折中界定为DILI发病6~9个月后,肝酶或胆红素水平仍不能恢复到DILI发病前的基线水平,和/或有肝病进展的其他症状或体征(例如腹水、脑病、门脉高压、凝血功能异常等)。五、肝活检
六、因果关系评估量表
七、预后因素
八、再激发
九、治疗
十、随访
十一、HDS诱导的肝损伤(HDS-DILI)
十二、免疫检查点抑制剂(ICIs)引起的肝损伤
十三、慢性肝病(CLD)患者的药物性肝损伤
十四、儿童药物性肝损伤
十五、对2021版《指南》的思考
