原发性及继发性血色病对心脏结构及功能影响的对比研究
2021-06-08王婉溦武亭王昱李柯鑫刘立伟欧晓娟贾继东赵新颜
王婉溦 武亭 王昱 李柯鑫 刘立伟 欧晓娟 贾继东 赵新颜
铁过载可分为原发性或继发性,前者又称为遗传性血色病,属于常染色隐性遗传性疾病,其特点为过量铁沉积于肝脏、胰腺、心脏、关节、皮肤及生殖系统,导致相应组织器官损伤[1,2]。西方国家以HFE基因变异为主[3],而我国以非HFE基因变异为主[4]。继发性铁过载多见于反复多次输血、红细胞异常、骨髓无效造血或酒精性肝病[5]。
赵新颜等[6]报道,原发性血色病铁负荷的程度更为严重,并且原发性血色病患者肝脏合成功能受损程度更为严重。铁除沉积于肝脏外,心脏是铁沉积的另一重要器官,铁过载导致心脏结构或节律异常报道较少,而且原发性血色病及继发性铁过载心脏受累的程度是否存在差异,存在何种差异,对患者预后存在何种影响,值得进一步研究。
本研究系统比较了原发性血色病及继发性铁过载患者心脏受累情况,包括发生率、损伤类型、程度及其对预后的影响,旨在提高肝病医生对血色病肝外器官受累的了解,及时发现及处理血色病严重心脏并发症,提高患者生存期及生活质量。
资料与方法
一、病例资料
筛选2008年1月至2018年12月期间就诊于首都医科大学附属北京友谊医院诊断为“铁过载”或“原发/继发性血色病”的住院患者。原发性的血色病诊断标准[7]:①具有铁过载的临床表现,如皮肤色素沉着,肝功能异常、糖尿病,关节痛等;②铁蛋白增高、转铁蛋白饱和度>45%;③腹部影像(CT/MRI)或肝脏病理提示肝脏铁过载;④排除可导致铁过载的其他原因;⑤基因检测符合原发性血色病变异特点。继发性血色病的诊断标准[7]:①具有导致铁过载的基础病,如酒精性肝病,反复输血等;②铁蛋白增高,转铁蛋白饱和度增高>45%;③基因检测不支持原发性血色病的基因变异特点。
二、临床数据收集
年龄、性别,主要临床表现;铁代谢指标:血清铁、总铁结合力,计算转铁蛋白饱和度;生化指标:ALT、AST、碱性磷酸酶(alkaline phosphatase,ALP)、谷氨酰转肽酶(glutamyl transpeptidase,GGT)、血清总胆红素(total bilirubin,TBil)、直接胆红素(direct bilirubin,DBil)、白蛋白(albumin,Alb)、胆碱酯酶(cholinesterase,CHE)、肌酐、尿素氮、血糖,心脏指标包括:心电图、心率,心律及心律失常类型,心脏结构测量。并系统随访患者的预后信息。
三、统计方法
应用SPSS 25.0软件进行统计分析;非正态分布的计量数据以M(P25,P75)表示,组间比较采用Kruskal-Wallis H或Mann-Whitney检验。计数资料以例数表示,组间比较采用卡方检验。P<0.05为差异有统计学意义。
结 果
一、原发性血色病及继发性血色病患者人口学特征比较
20例原发性血色病患者平均年龄为45岁,男性为14例。13例可追踪到基因结果,其中SLC40A1基因型5例、HFE基因型4例、非HFE基因型和HJV基因型各2例。按年龄、性别匹配继发性血色病患者20例,平均年龄为47岁,男性15例。其中7例继发于酒精性脂肪性肝病,3例继发于非酒精性脂肪性肝病,3例继发于药物性肝损伤,其他包括慢性丙型肝炎、卟啉病、反复输血、骨髓增生异常综合征、Citrin蛋白缺乏、遗传性球形红细胞增多症及慢性感染等。
二、原发性血色病及继发性血色病患者临床特点比较
原发性血色病中糖尿病患者较多,但差异无统计学意义;有关节炎、性欲减退等临床表现者均为原发性血色病。2组均有一半以上的患者表现为脾大,见表1。
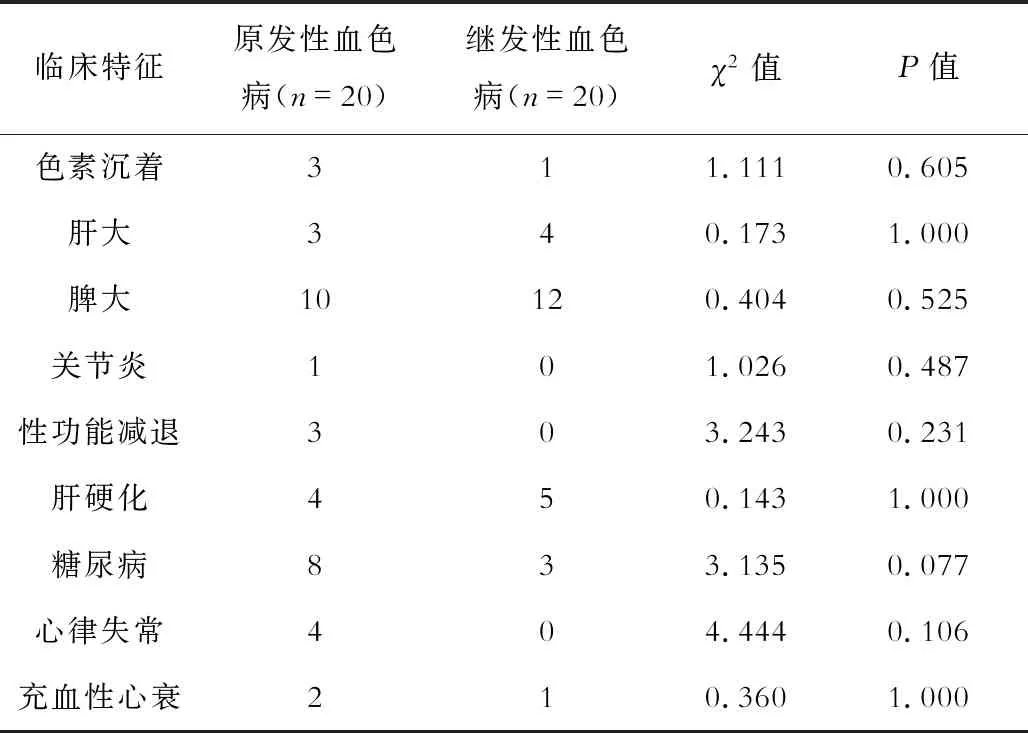
表1 原发性血色病及继发性血色病患者临床特点比较(例)
三、原发性血色病及继发性血色病患者肝肾功能、血常规及铁代谢指标的比较
2 组患者肝脏生化指标ALT、AST、ALP、GGT和反映肝功能储备的指标Alb、INR及CHE比较,差异均无统计学意义(均P>0.05)。与继发性血色病患者相比较,原发性血色病患者 WBC、PLT均显著减少(均P<0.05),HGB和肾功能指标差异无统计学意义(均P>0.05)。与继发性血色病患者比较,原发性血色病患者铁蛋白和血清铁水平显著升高(均P<0.05)。原发性血色病患者转铁蛋白饱和度高于继发性血色病患者,但差异无统计学意义(P=0.054),总铁结合力在2组之间差异无统计学意义(P>0.05),见表 2。
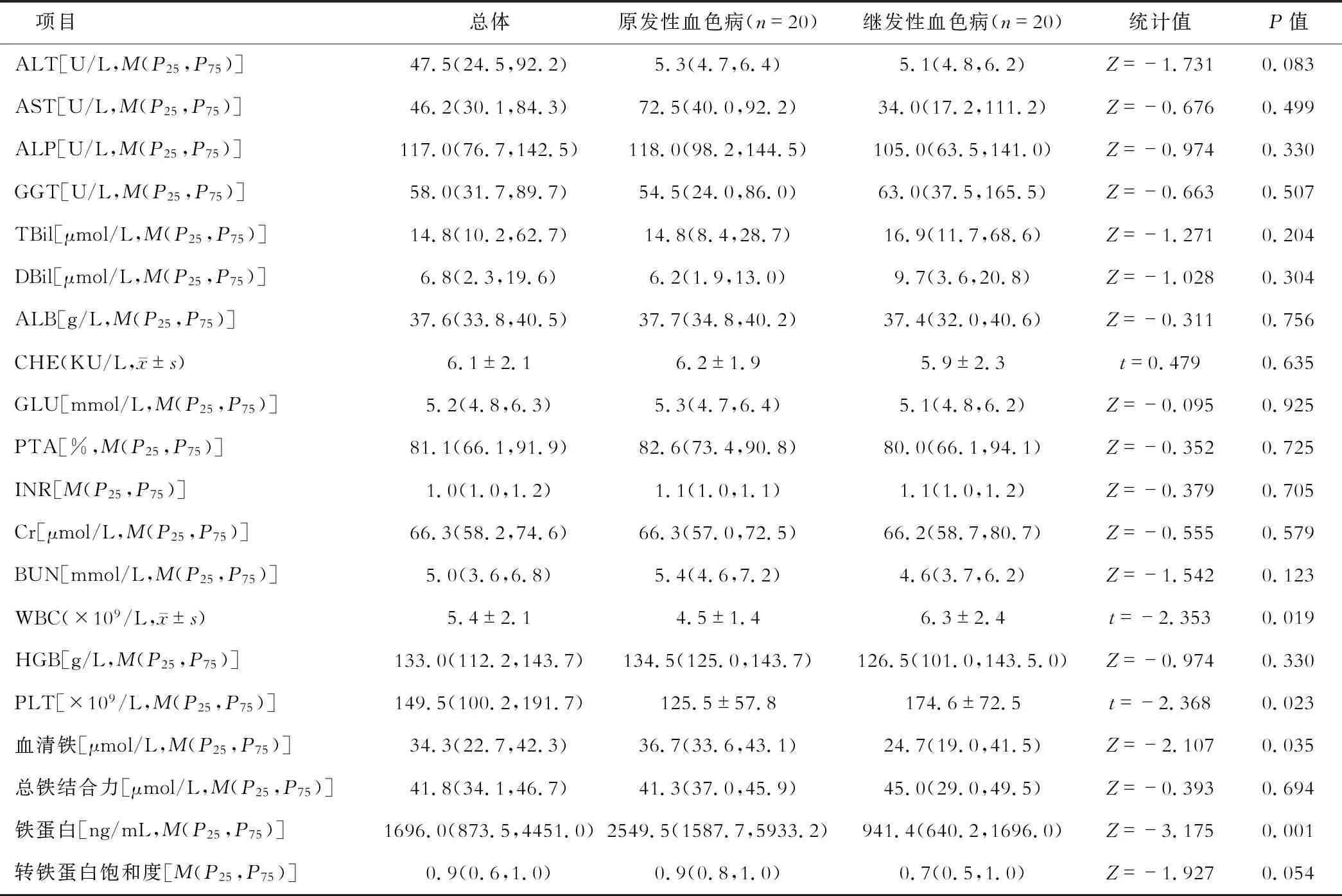
表2 原发性血色病及继发性血色病患者肝肾功能、血常规及凝血的比较
四、原发性血色病及继发性血色病患者心电图比较
与继发性血色病患者比较,原发性血色病患者PR间期较长,但差异无统计学意义(P=0.068),心率、RR间期、QRS间期、QT间期、QTC、RV5、SV1、R+S值相比较,2组之间差异均无统计学意义(均P>0.05),见表 3。继发性血色病和原发性血色病合并心律失常的患者分别为1例和4例,差异无统计学意义(χ2=2.057,P=0.342)。原发性血色病2例心律失常患者中,1例为房颤,1例为频发室早,分别为HFE基因、HJV基因。继发性血色病患者中1例出现房颤,考虑该患者血色病继发于酒精性肝病,最终导致酒精性心肌病。
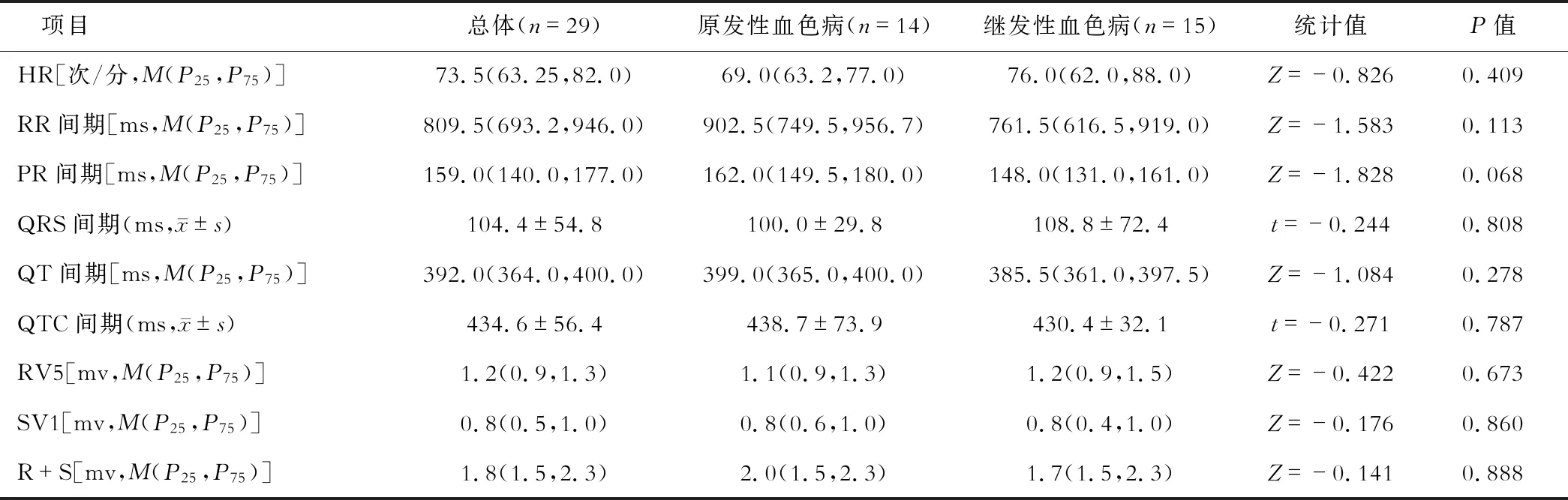
表3 原发性血色病及继发性血色病患者心电图表现比较
五、原发性血色病及继发性血色病两组心脏结构的比较
原发性血色病组、继发性血色病组分别有14、15例患者行超声心动图检查。升主动脉内径、主动脉内径、左心房内径、左室舒张末期内径、左室收缩末期内径、左室舒张末期容量、左室收缩末期容量、每博量、射血分数、短轴缩短率、室间隔厚度、左心室后壁厚度、右心室内径、E峰速、A峰速、左心室流出道流速、肺动脉瓣流速等各项指标在2组之间差异均无统计学意义(均P>0.05),见表 4。

表4 原发性血色病及继发性血色病两组心脏结构的比较
六、原发性血色病及继发性血色病两组预后比较
原发性血色病组有2例因心衰死亡,1例失访,17例行积极治疗,其中规律放血治疗16例,去铁胺降铁治疗1例,预后良好。继发性血色病组,无死亡病例,1例失访,1例行去铁胺将铁治疗,余病例仅治疗原发病,未行放血治疗。
讨 论
本研究对比分析了原发性血色病及继发性血色病的临床病理特点,原发性血色病患者铁过载程度更加明显,肝脏转氨酶增高更多见,铁沉积的肝外表现,如糖尿病、关节痛、性功能减退、皮肤色素沉着更为多见,与既往研究一致[8]。基因结果显示,非HFE基因变异占多数,这也与既往我国血色病报道一致[9]。原发性血色病患者心脏受累更为多见,包括心律失常,心力衰竭均高于继发性血色病,2例患者因心脏原因死亡,提示血色病一旦累及心脏,预后不良。值得注意的是,继发性于酒精性肝病的铁过载患者,心脏亦可以受累,多为酒精性心肌病所致,与原发性血色病导致心脏异常不同。
文献报道,血色病累及心脏,出现症状性心脏异常的发生率约为15%[10],主要包括:充血性心力衰竭、心律失常,后者包括房颤、室性早搏、频发室早、严重者可导致致死性心律失常或心力衰竭,这是原发性血色病肝外因素死亡的主要原因[11]。此外,本研究还提示,原发性血色病患者心脏P-R间期,R-R间期均长于继发性血色病患者,但差异无统计学意义,可能与病例数较少有关。原发性血色病与继发性血色病间心脏主要结构无显著差异。血色病性导致心脏功能异常的主要机制包括:铁在心肌细胞的沉积,导致过氧化损伤,影响心肌收缩力;铁在传导系统沉积,这可能是导致心肌功能异常的主要原因[12]。
原发性血色病和继发性血色病导致心脏功能受累的病例均有报道,原发性血色病中,铁过载心肌病(IOC)以HFE基因突变型最为常见,其中约三分之一的患者在30~40年间将发展为IOC[13-15];在非HFE基因突变血色病患者中,以HJV血色素沉着症为著,HJV基因突变型较其他类型发病年龄早20~30岁,临床症状进展迅速[16]。在继发性血色病中,心肌受累主要与输血治疗相关,其严重程度取决于骨髓无效造血及贫血的程度,地中海贫血、镰状细胞病等遗传性血红蛋白疾病为最常见的原因[5]。此类疾病较原发性血色病临床症状温和、病情发展缓慢,但仍有3%~5%的镰状细胞贫血和地中海贫血的患者心肌病较为明显[17],如果不积极放血、服用铁螯合剂,甚至行脾切除术,患者可能因高输出量型心力衰竭或感染死亡[18]。由此可以得出原发性血色病较继发性血色病更易累及心脏,一旦心脏受累,预后均差,约有三分之一的患者死于心脏疾病[19],这与本研究结果一致,原发性血色病累及心脏的比率高于继发性血色病[20]。
经过放血疗法,本研究大部分血色病患者铁蛋白逐步降低,临床症状及生化指标好转,预后改善。放血疗法通常安全、有效[21];但伴有心脏节律或功能异常的血色病患者,放血时应加强监护,严格掌握好放血量、放血次数,以免血流动力学波动过大而诱发心脏泵功能衰竭。
