亚甲蓝影响异氟烷对老年阿茨海默病小鼠神经毒性的研究
2021-06-08周裕凯张先杰夏乐强
周裕凯,余 茹,张先杰,夏乐强
随着找国人口老龄化,全身麻醉药物对老年患者神经毒性的研究成为麻醉学领域的热点,但因缺乏血液特异性标志物,且受伦理限制无法获得人大脑切片,该类研究多集中在基础领域。
异氟烷(isoflurane,Iso)作为吸入麻醉药,能通过影响淀粉样β(amyloid-β,Aβ)蛋白在细胞外累积和异常表达的磷酸化Tau(phosphorylated tau,p-Tau)蛋白在细胞内形成,加速老年常见神经退行性疾病——阿茨海默病(Alzheimer's disease,AD)的病理过程[1-2]。锂盐、黄芪甲苷和甘草酸苷等均被证实能在动物模型中减轻异氟烷神经毒性,起到保护作用[3-5]。
亚甲蓝(methylene blue,MB)是一种阳离子噻嗪类染色剂,最早在上世纪90年代,被发现能减缓AD病理过程[6],其衍生合成的新药能治疗轻、中度AD[7]。亚甲蓝还能通过NO-鸟苷酸环化酶信号通路和异氟烷产生交互影响[8],但其能否减轻异氟烷神经毒性,目前尚缺乏相关报道。
本研究通过老年AD小鼠模型,观察了行为学表现和蛋白表达,旨在探讨亚甲蓝对异氟烷神经毒性的影响。
1 材料与方法
1.1 实验动物 采用南京生物医药研究院提供的12月龄雄性C57BL/6野生型小鼠(WT鼠)和C57BL/6 AD转基因APP695小鼠(APP鼠),生产许可证为[SCXK(苏)2015-0001]。饲养于重庆威斯腾生物医药科技有限责任公司SPF级动物房,使用许可证为[SYXK(渝)2019-0002]。保持动物房12~12 h昼夜交替,温度23~25℃,自由饮水、进食,适应性喂养1 w后进行实验。本研究通过德阳市人民医院伦理委员会审查,审查号:2020-04-180。
1.2 分组及处理方法 WT鼠和APP鼠共分为4组。WTMB组和APPMB组:经尾静脉注入2 mg/kg亚甲蓝(济川药业集团有限公司,批号为1406012)15 min后,放入有机玻璃盒子(5 cm×5 cm×15cm)吸入100%氧气(1 L/min);APPMB+Iso组:注入2 mg/kg亚甲蓝后吸入1 U最低肺泡浓度(minimum alveolar concentration,MAC)异氟烷(山东鲁南贝特制药有限公司,批号为64140302),氧流量为1 L/min;APPIso组:注射同体积生理盐水后吸入1 U MAC异氟烷。吸入氧气或异氟烷都为4 h,保持小鼠直肠温度在36~38℃。
MAC是指吸入麻醉药在一个大气压下与纯氧同时吸入时,能使50%患者在切皮时不发生反应时的最低肺泡浓度,是不同吸入麻醉药的等效价浓度。为排除亚甲蓝对异氟烷MAC的影响[9],根据Li等[10]报道的方法进行预实验,测得APPMB+Iso组和APPIso组异氟烷的1 MAC均为1.4%。
1.3 Morris水迷宫实验 每组5只小鼠,共20只。采用直径1.2 m,高0.6 m,水深0.4 m的圆形水池(安徽正华生物仪器设备公司),水温为20~22℃,直径0.2 m的逃生平台设在水池西北角,淹没于水下1 cm。定位航行实验:经处理后的第1 d,小鼠被训练从水池4个不同象限边界出发寻找逃生平台,每只小鼠4次,如超过60 s,将人为引导到平台并逗留20 s,连续4 d,每次持续60 s,每次间隔5 min,评估小鼠学习能力。空间探索实验:每天最后一次训练后,将小鼠放入移去平台的水池中,每只小鼠仍从4个不同象限起点出发寻找原平台位置,共4次,以评估记忆能力。摄像系统记录60 s内潜伏时间、速度和穿台次数等行为学数据。
1.4 蛋白印迹实验 每组9只小鼠,共36只。经处理后第1、3、7 d,每组分别取3只处死,提取海马组织萃取蛋白,经10%SDS凝胶电泳(美国Amresco公司)分离转膜,采用含5%脱脂牛奶和0.1%聚山梨酸酯的缓冲盐水(pH7.6)封膜2 h,4℃下与抗体孵化过夜。抗体(美国Abcam公司)包括:多克隆兔p-Tau抗体(1∶500)、多克隆兔Aβ1~42抗体(1∶500)、多克隆兔β-actin(1∶1000)。第2 d,用辣根过氧化物酶复合物(美国Sigma公司)作第二抗体在室温下孵化1.5 h,采用凝胶成像系统(美国Wealtec公司)分析印迹条带积分吸光度。以β-actin为内参蛋白,目的蛋白吸光度与内参蛋白吸光度比值表示目的蛋白表达水平。
1.5 统计学方法 应用SPSS22.0软件分析,计量资料以±s表示。Morris水迷宫实验用重复测量方差分析,组间多重比较采用Games-Howell法;蛋白印迹实验用单因素方差分析,组间多重比较采用Games-Howell法。P<0.05为差异有统计学意义。
2 结果
2.1 学习与记忆能力比较 定位航行实验中,WTMB组学习能力最佳,随训练时间延长,潜伏时间降低最明显,与其余3组有统计学差异(P<0.05);APPIso组学习能力最差,潜伏时间曲线最平缓,较其余组有统计学差异(P<0.05);APPMB+Iso组潜伏时间改善幅度明显差于APPMB组(P<0.05)。见图1A。
所有组在空间探索实验的运动能力未受影响,平均速度无明显差别(P>0.05),见图1B。WTMB组记忆能力最好,表现为穿台次数明显多于其余3组(P<0.05);APPIso组记忆能力最差,穿台次数明显少于其余组(P<0.05);APPMB组和APPMB+Iso组穿台次数无明显差异(P>0.05),见图1C和图2。
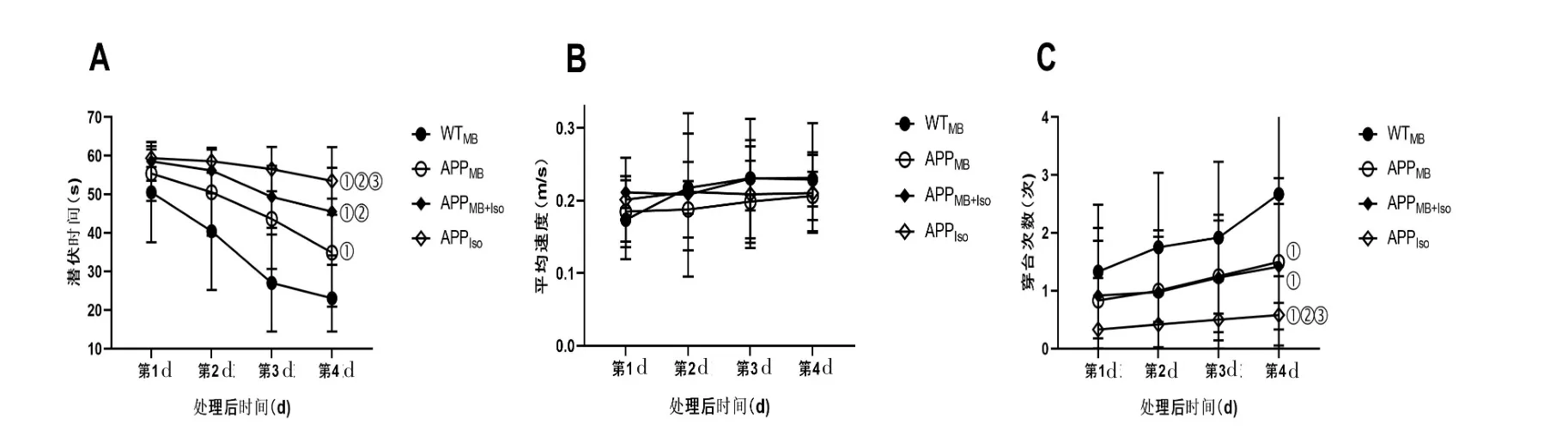
图1 Morris水迷宫实验中学习与记忆能力的比较
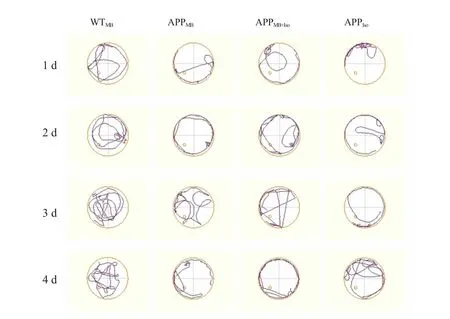
图2 Morris水迷宫空间探索实验小鼠运动轨迹
2.2 Aβ1~42蛋白和p-Tau蛋白比较 WTMB组Aβ1~42蛋白和p-Tau蛋白水平平稳,组内变化随时间延长,无统计学差异(P>0.05);APPMB组蛋白随时间延长明显增加(P<0.05);APPMB+Iso组和APPIso组蛋白水平第1 d达到顶峰,后随时间延长明显明显下降(P<0.05)。见图3和表1。
第1、3 d蛋白水平,4组间有明显差别(P<0.05),WTMB组最低,APPIso组最高,APPMB组明显低于APPMB+Iso组(P<0.05)。第7 d时,APPMB组、APPMB+Iso组和APPIso组间的Aβ1~42蛋白差异无统计学意义(P>0.05);APPMB组和APPMB+Iso组间的p-Tau蛋白差异无统计学意义(P>0.05)。见表1。
3 讨论
为节约研发时间和成本,现代药学倾向于拓宽已批准药物的适应证。近期发现,静脉注射地塞米松也能减轻异氟烷对新生野生大鼠的神经毒性,改善受损神经细胞结构[11]。本研究选用了易透过血脑屏障的亚甲蓝,它被发现能减轻AD、缺血性脑卒中、外伤性脑损伤等神经学损害[12-14]。

图3 蛋白印迹实验Aβ1~42蛋白和p-Tau蛋白表达电泳图
首先,为排除因小鼠性别不同造成神经损伤程度的差异[15],本研究只选用雄性小鼠。静脉注射0.5~4 mg/kg亚甲蓝能缓解AD进程[16-17],但其剂量>5 mg/kg可能会降低异氟烷MAC[9],为排除这一干扰因素,本研究先行预实验发现2 mg/kg亚甲蓝不影响异氟烷MAC,APPMB+Iso组和APPIso组1 U MAC均为1.4%,与Li等[10]报道的同种小鼠异氟烷MAC相同。
定位航行实验中(图1A),4组潜伏时间有统计学差异(P<0.05),说明异氟烷损伤老年AD小鼠学习能力,亚甲蓝能减轻该损伤,发挥神经保护作用。空间探索实验中,异氟烷和亚甲蓝均不影响小鼠运动能力;APPMB组和APPMB+Iso组穿台次数无明显差异(P>0.05),APPIso组穿台次数明显少于其余组(P<0.05)(图1C和图2),说明异氟烷对AD小鼠记忆无负面影响,亚甲蓝能改善AD小鼠记忆。Chen等[18]也发现亚甲蓝能改善AD大鼠学习和记忆能力,海马体注入含36 g亚甲蓝纳米复合体后,潜伏时间明显改善(P<0.05),目标象限停留时间明显延长(P<0.05)且不影响运动能力(P>0.05)。异氟烷对AD小鼠模型行为学的影响尚有争议,Joseph等[19]发现14~16月龄AD小鼠连续5 d吸入1.1%异氟烷2 h,学习能力受损严重(P<0.05),记忆能力无显著影响(P>0.05);赵燕星等[20]则发现7月龄AD双转基因APPswe/PS1dE9小鼠连续5 d吸入1.1%异氟烷2 h后,学习、记忆能力反而有一定提高(P<0.05)。这可能与动物种类、月龄、测试方法等不同有关,其中机理需进一步探索和研究[19]。
蛋白水平的影响比行为学持久,故选择经处理后第1、3、7 d进行检测,结果提示异氟烷的神经损伤也体现在蛋白水平,而亚甲蓝不光能减轻异氟烷的损伤,还能降低APPMB组蛋白水平,改善AD病程(图3和表1)。第7 d时,3组APP鼠间的Aβ1~42蛋白,APPMB组和APPMB+Iso组的p-Tau蛋白已无统计学差异(P>0.05),说明吸入1.4%异氟烷4 h对AD小鼠神经损伤是可逆的,单次静脉注射2 mg/kg亚甲蓝在蛋白水平的保护作用也不持久。
亚甲蓝减轻异氟烷神经毒性,产生保护作用的机理,推测与线粒体有关。线粒体功能失调是异氟烷介导神经损伤的重要靶点,包括改变线粒体形态、降低膜电位、破坏电子传递链复合体Ⅳ和增加活性氧簇,从而触发半胱天冬酶途径的细胞凋亡[21-22]。线粒体也是亚甲蓝治疗AD的关键节点,亚甲蓝可通过增加复合体Ⅳ活性,促进线粒体转运,抑制淀粉样复合乙醇脱氢酶和减少氧化应激标志物,从而降低Aβ蛋白和p-Tau蛋白水平,抑制Aβ寡聚物和Tau蛋白纤维形成[23]。
表1 小鼠海马组织中蛋白和p-Tau蛋白表达水平(−,n=9)
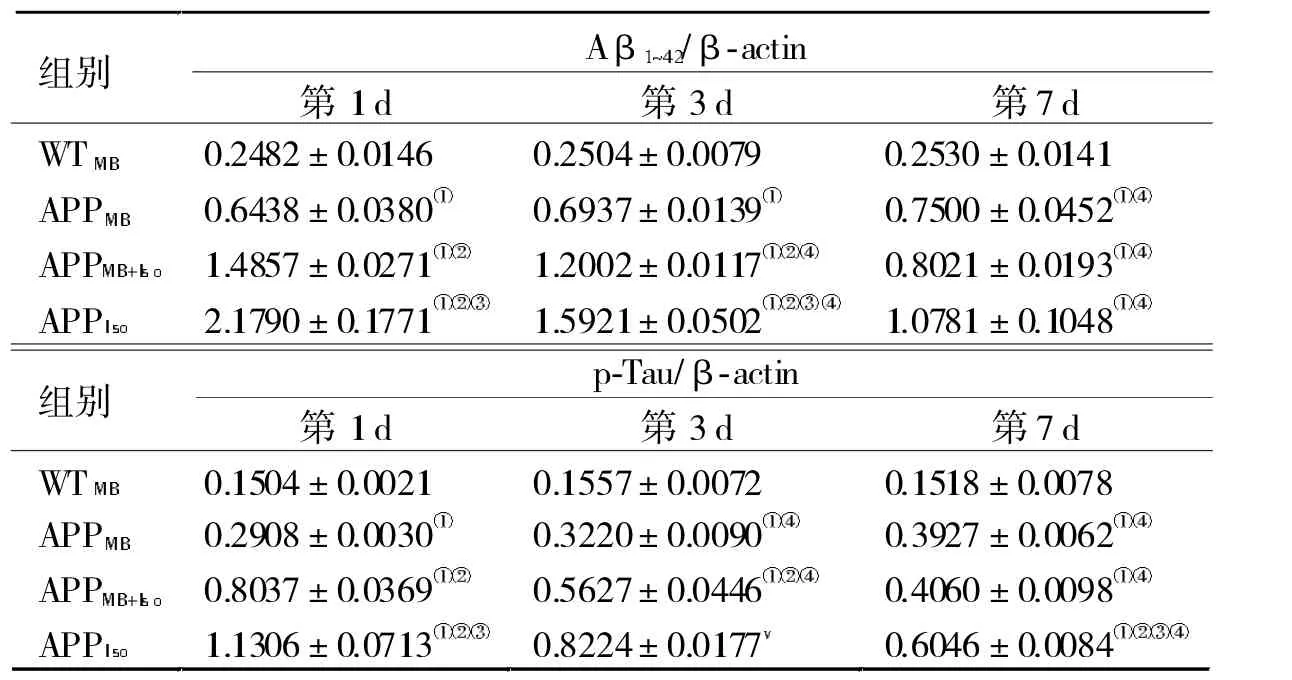
表1 小鼠海马组织中蛋白和p-Tau蛋白表达水平(−,n=9)
注:与同天WTMB组比较,①P<0.05;与同天APPMB组比较,②P<0.05;与 同天组比较,③P<0.05;与组内第1 d比较,④P<0.05
Aβ/β-actin 组别 第1 d 第3 d 第7 d WT 0.2482±0.0146 0.2504±0.0079 0.2530±0.0141 APP 0.6438±0.0380 0.6937±0.0139 0.7500±0.0452 APP 1.4857±0.0271 1.5921±0.0502 1.0781±0.1048 p-Tau/β-actin 组别 第1 d 第3 d 第7 d WT 0.1504±0.0021 0.1557±0.0072 0.1518±0.0078 APP 0.2908±0.0030 0.3220±0.0090 0.3927±0.0062 APP 0.8037±0.0369 0.5627±0.0446 0.4060±0.0098 APP 1.1306±0.0713 0.8224±0.0177 0.6046±0.0084
综上所述,静脉注射2 mg/kg亚甲蓝能减轻异氟烷对老年AD小鼠的神经毒性,但其机制尚需进一步研究。麻醉药物神经毒性的研究需要拓宽思路,发现更多有潜在保护机制的药物,以期待未来能用于临床中。
