临床级人脐带间充质干细胞资源库的构建
2021-06-07赵庆辉白志慧贾文文汤红明刘中民
赵庆辉 白志慧 贾文文 汤红明 刘中民
同济大学附属东方医院干细胞转化医学产业基地,国家干细胞转化资源库,上海干细胞临床转化研究院,上海市干细胞临床诊疗工程研究中心,上海 200123
0 引 言
干细胞疗法正在突破传统医学,对于一些人类重大难治性疾病[1-2]的治疗表现出独特优势,近年来已受到全球范围内关注,成为国际前沿战略性研究领域。
人脐带间充质干细胞(human umbilical cord mesenchymal stem cells,hUC-MSCs)是一类存在于新生儿脐带组织中的具有较高分化潜能的多能干细胞[3]。在一定条件下,hUC-MSCs可分化成多种功能组织和器官。因具有多向分化潜能、低免疫原性和黏附特性[4-7]以及材料来源丰富和较少伦理学争议,hUC-MSCs逐渐成为再生医学疗法和组织工程移植的理想种子细胞之一[8-9],越来越受到研究者的青睐。
截至2020年12月20日,以“hUC-MSCs”为关键词,在全球最大的临床试验数据库ClinicalTrials.gov网站检索,结果显示全球约有275项关于hUCMSCs移植治疗相关疾病的临床试验。在国家卫生健康委员会和国家食品药品监督管理总局备案的100项干细胞临床研究项目中,选择hUC-MSCs作为干细胞制剂的有45项,占比达45%,治疗的适应证包括新型冠状病毒肺炎(新冠肺炎)、心血管疾病、糖尿病、骨科疾病、神经系统疾病及自身免疫性疾病等人类重大疾病。2008至2019年期间,在中国临床试验注册中心注册的354项干细胞相关临床试验中,选择hUC-MSCs作为干细胞制剂的有56项,占比达16%。鉴于此,建立临床级hUC-MSCs(可达到用于临床的相关质量标准)资源库尤为关键,其不仅可为干细胞临床研究和应用服务,也可为高校、科研院所、企事业单位等提供满足科学研究所需的干细胞资源[10]。
作为国家干细胞转化资源库承建单位,同济大学附属东方医院早在2017年便启动了临床级hUCMSCs的制备和建库工作。本研究旨在通过分离、培养、扩增、传代、冻存等操作流程,并对hUC-MSCs进行生物学特性、安全性与稳定性等质量检测,建立临床级hUC-MSCs资源库三级库,以期为科学研究、临床转化与应用以及国家应急等提供资源保障和支撑[11]。
1 材料与方法
1.1 主要材料与仪器
质量浓度为9 g/L的NaCl溶液(国药集团化学试剂有限公司),冻存液(加拿大Stemcell公司),α-MEM培养基、台盼蓝染色液、MesenCultTM成脂分化培养基、MSCgoTM成骨诱导分化试剂、StemPro成软骨分化试剂盒(美国Gibco公司),UltraGROTMAdvanced完全培养基(美国Helios公司),鲎试剂(湛江博康海洋生物有限公司),MSC Phenotyping Kit(间充质干细胞表型检测试剂盒,上海优宁维生物科技股份有限公司),GoTaq qPCR Master Mix(支原体荧光定量PCR检测试剂盒,美国Promega公司),茜素红、阿利新蓝、油红O(赛业生物科技有限公司),基质胶(美国BD公司),CCK-8试剂盒(美国MCE公司)。
雄性非肥胖糖尿病/重症联合免疫缺陷(nonobese diabetes/serve combined immunodeficiency,NOD/SCID)小鼠6只,无特定病原体级,5~8周龄,体质量约15 g,购自北京维通利华实验动物技术有限公司,生产许可证号SCXK(京)2021-0011。饲养条件为温度18~22℃,相对湿度50%~60%,每周更换2次垫料,饲养环境干净整洁。本研究的动物实验已通过同济大学医学院实验动物中心审查。
人脐带组织来源于同济大学附属东方医院产科,要求捐赠者身体健康,无系统性疾病及其他遗传性疾病,相关病原学检查结果均为阴性,合格者纳入。目前本研究共纳入捐赠者247例(计划500例)。脐带组织采集前,捐赠者均签署知情同意书,并统一编码,保护捐赠者个人隐私。采集完成后,将脐带组织浸入质量浓度为9 g/L的NaCl溶液中,并低温运输至药品生产质量管理规范(GMP)实验室。本研究已通过同济大学附属东方医院伦理委员会审查,伦理批件号为[2017]体临审第(001)号修正1。
1374生物安全柜、371细胞培养箱、7500 Fast荧光定量PCR仪(美国Thermo公司),TS100倒置显微镜(日本尼康公司),IC1000细胞计数仪(上海睿钰生物科技有限公司),Bact Alter梅里埃微生物培养系统(法国梅里埃公司),FACSCantoⅡ流式细胞仪(美国BD公司),DHP-9162恒温培养箱(上海一恒科学仪器有限公司)。
1.2 方法
1.2.1 hUC-MSCs建库流程
按照《中华人民共和国药典》及干细胞相关规范和指南等,结合hUC-MSCs特性,依次建立种子细胞库(选取P1代细胞)、主细胞库(选取P3代细胞)和工作细胞库(选取P5代细胞),并进行相关质量检测(图1)。

图1 hUC-MSCs建库流程
1.2.2 hUC-MSCs种子细胞库的建立
冲洗采集的人脐带组织,将其剪成1~2 cm小段,并剔除其中的3根血管(2根动脉和1根静脉)。将剔除血管的脐带剪成1~2 mm3的组织块,采用无血清培养基进行贴壁培养。经消化后获得P0代细胞,再进行传代、扩增获得P1代细胞,放行检验合格后即为hUC-MSCs种子细胞。
1.2.3 hUC-MSCs主细胞库的建立
对P1代种子细胞进行逐级传代、扩增,获得P3代细胞,放行检验合格后形成hUC-MSCs主细胞库。
1.2.4 hUC-MSCs工作细胞库的建立
对P3代细胞再次进行传代、培养、扩增,获得P5代细胞,放行检验合格后形成hUC-MSCs工作细胞库。
1.2.5 hUC-MSCs质量检测
根据国家卫生计生委与国家食品药品监督管理总局颁发的《干细胞制剂质量控制及临床前研究指导原则(试行)》、国家食品药品监督管理总局颁发的《细胞治疗产品研究与评价技术指导原则(试行)》以及行业协会发布的《干细胞制剂制备与质检行业标准(试行)》《干细胞通用要求》等相关质量控制技术规范要求,按照相关检测方法[11-13],对建库的hUC-MSCs进行生物学特性、安全性与稳定性等检测,内容包括但不限于细胞鉴定、存活率及生长活性检测、纯度和均一性检测、细胞内外源致病因子检测、无菌和支原体检测、内毒素检测、成瘤性检测、生物学效力检测、异常免疫学反应检测等,以确保hUC-MSCs细胞株质量可控。
(一)细胞鉴定
采用显微镜观察不同代次细胞的状态并拍照。
(二)细胞存活率检测
将质量浓度为40 g/L的台盼蓝染色液与细胞悬液混合,采用细胞计数仪进行计数,并计算细胞存活率。
(三)细胞纯度和均一性检测
将P5代细胞悬液以2.5×105个/管均分至EP管中,单染抗体CD11、CD19、CD34、CD45、人类白细胞抗原DR(human leukocyte antigen-DR,HLA-DR)各取5μl,CD73、CD90、CD105各取1.25μl加入对应的EP管中进行染色,弃上清,杜氏磷酸盐缓冲液重悬后转移至流式管中,最后采用流式细胞仪进行检测。
(四)细胞内外源致病因子检测
采用定量PCR方法检测细胞培养上清中是否含有细胞内外源致病因子,具体操作参见文献[12]。
(五)无菌和支原体检测
取适量P1、P3、P5代细胞培养上清,分别加入需氧培养瓶和厌氧培养瓶中,再置于全自动微生物培养检测系统,37℃培养5 d。
取适量P1、P3、P5代细胞培养上清,采用支原体荧光定量PCR检测试剂盒检测支原体,具体操作按试剂盒说明书进行。
(六)内毒素检测
取适量P1、P3、P5代细胞培养上清,采用鲎试剂(凝胶法)检测内毒素,具体操作按试剂盒说明书进行。
(七)成瘤性检测
将P5代细胞悬液加入EP管中,再加入100μl基质胶混匀,置于4℃冰盒待用。5~8周龄NOD/SCID雄鼠,称质量分为2组,每组3只。剃除小鼠背部被毛,用预冷的胰岛素针在其中一组小鼠背部两点进行皮下注射HeLa细胞(每点2×106个),另一组小鼠皮下注射样本细胞(每点2×106个)。2个月后观察小鼠注射部位是否有成瘤组织。(八)生物学效力检测
按相应的试剂盒说明书对P5代细胞进行成骨、成脂、成软骨诱导分化21 d,再分别用茜素红、油红O、阿利新蓝进行成骨、成脂、成软骨染色观察。(九)异常免疫学反应
将P5代细胞与淋巴细胞按照细胞数量1∶5共培养7 d,然后采用CCK-8试剂盒检测淋巴细胞增殖情况。
2 结果
本研究共分离制备出247株hUC-MSCs。以其中一根脐带制备的hUC-MSCs(编号ZB09AH)结果为例,本研究制备的hUC-MSCs具有以下特性。
2.1 细胞鉴定
显微镜下观察可见,不同代次(P1、P3、P5代)的hUC-MSCs均呈梭形,生长良好,详见图2。

图2 显微镜观察人脐带间充质干细胞(编号ZB09AH)的细胞形态(×40)
2.2 细胞存活率检测
台盼蓝染色结果显示,hUC-MSCs的细胞存活率>95%。
2.3 细胞纯度和均一性检测
流式细胞术检测结果见图3,CD73、CD90、CD105阳性细胞比例均>95%,CD11、CD19、CD34、CD45、HLA-DR阳性细胞比例均<2%,表明制备的hUC-MSCs的纯度和均一性良好。

图3 流式细胞术检测hUC-MSCs(编号ZB09AH)P5代细胞表面标志
2.4 细胞内外源致病因子检测
荧光定量PCR检测结果显示,细胞内外源致病因子乙型肝炎病毒、丙型肝炎病毒、Epstein-Barr病毒、巨细胞病毒均为阴性表达。
2.5 内毒素检测
鲎试剂(凝胶法)检测结果显示,内毒素含量≤0.5 EU/ml。
2.6 无菌和支原体检测
分别采用全自动微生物培养检测系统和荧光定量PCR技术进行无菌和支原体检测,结果均为阴性。
2.7 成瘤性检测
NOD/SCID小鼠皮下注射hUC-MSCs不成瘤,详见图4。
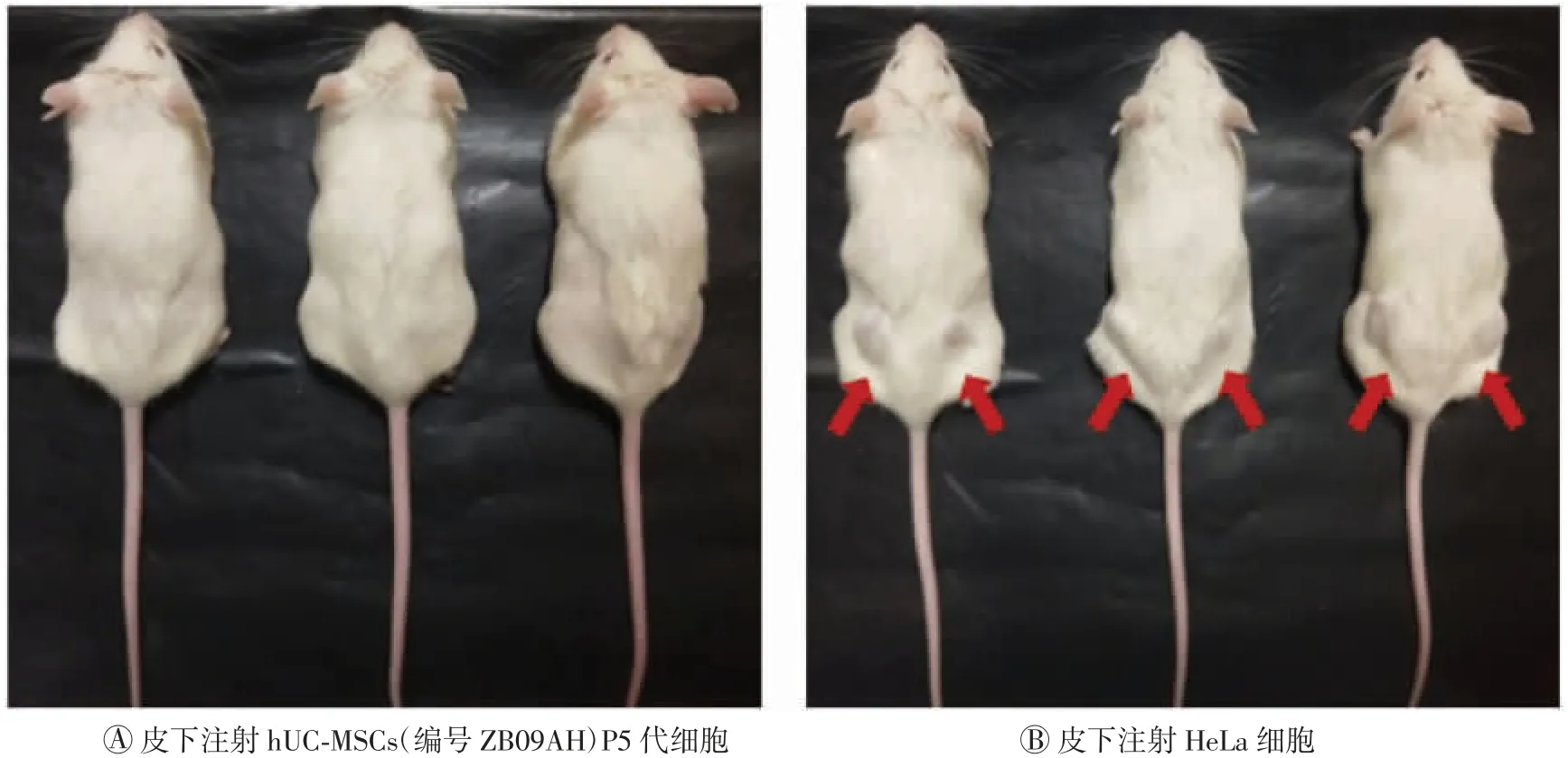
图4 非肥胖糖尿病/重症联合免疫缺陷小鼠成瘤结果
2.8 生物学效力检测
染色结果显示,体外诱导培养21 d后,hUCMSCs具有分化成骨、成脂、成软骨的能力(图5)。
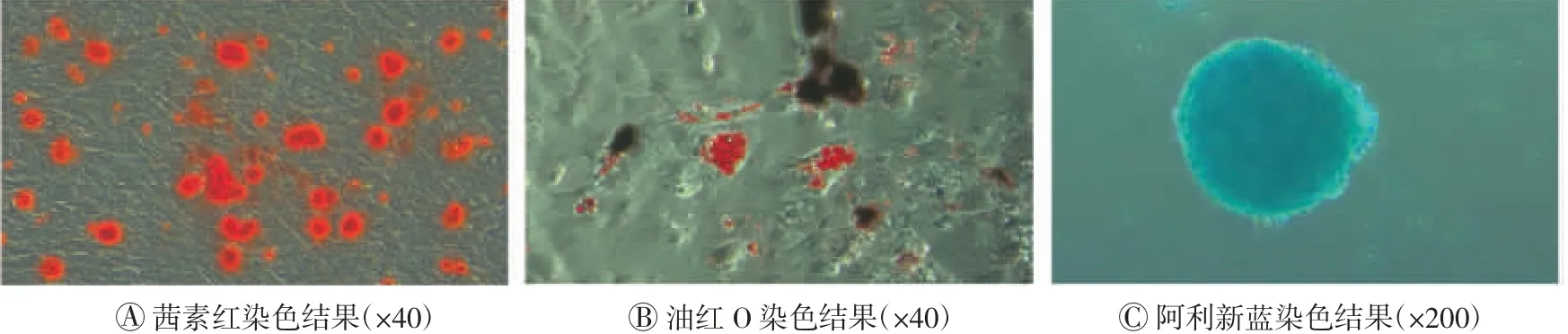
图5 hUC-MSCs(编号ZB09AH)P5代细胞的成骨、成脂、成软骨分化结果
2.9 异常免疫学反应
hUC-MSCs(编号ZB09AH)P5代细胞与淋巴细胞共培养结果显示,ZB09AH P5代细胞对免疫细胞增殖抑制率为76%,表明ZB09AH P5代细胞具有抑制免疫细胞增殖的能力。
3 讨论与结论
本研究通过分离、培养、传代、扩增、冻存及质量检测等一系列标准化操作流程,制备了247株hUC-MSCs细胞株(细胞数量规模近1万份,后期可根据研究需求规模化扩增),建立了hUC-MSCs资源库三级库,即种子细胞库、主细胞库和工作细胞库。三级库中细胞数量分别为1×106个/管(冻存管规格为2 ml)、5×106个/管(冻存管规格为2 ml)和5×107个/袋(血袋规格为10 ml),并存储于高效气相液氮罐中。
本研究所用工艺制备的hUC-MSCs通过了中国食品药品鉴定研究院质量复核检验(报告编号为SH201903852和SH201903853),达到了质量控制相关规定要求。同时已按照相关流程纳入国家干细胞转化资源库,并在国家科技资源共享服务平台共享,为干细胞相关科技创新活动提供了资源。
质量检测合格的P5代细胞可用于临床研究,使用前应对细胞制剂进行放行检验,包括但不限于无菌和支原体检测、内毒素检测等,检测合格后方能使用。为保证临床研究中干细胞制剂可溯源,本研究记录了细胞流转相关信息,包括捐赠者信息、样本采集信息、细胞制备信息、细胞检测信息、细胞入库和出库信息等。
目前,hUC-MSCs资源库支撑1项科技部应对新冠肺炎应急攻关项目“应对新冠肺炎的间充质干细胞治疗研究”(入组37例受试者,无1例不良反应)和2项国家干细胞临床研究备案项目(“人脐带间充质干细胞治疗心衰的临床研究”和“脐带间充质干细胞治疗2型糖尿病肾病的多中心临床研究”),为临床研究提供了hUC-MSCs资源及技术保障,并取得了初步进展。其中在应对新冠肺炎的干细胞临床研究中,hUC-MSCs因具有重要的免疫调控与损伤修复调节作用,在辅助治疗新冠肺炎(危)重症患者时表现出独特优势,有效提高了病患的治愈率。该研究在2020年3月17日国务院联防联控机制新闻发布会上获国家科技部生物中心肯定[14]。基于新冠肺炎、心衰和2型糖尿病肾病的hUC-MSCs临床研究初探,有效加快了我国的干细胞临床转化与应用步伐。
众所周知,干细胞资源库作为干细胞与转化研究的基石,在再生医学研究、药物研发与疾病诊疗等方面起到重要作用。而hUC-MSCs作为再生医学和组织工程理想的种子细胞,在人类重大疾病治疗中表现出独特的优势,受到了广泛关注。本研究建立的hUC-MSCs资源库和应用初探势必加速我国干细胞资源库的标准化建设以及干细胞的临床转化,其不仅可为干细胞临床研究和应用服务,也可为基础科学研究和国家应急等提供资源保障和支撑。这对于现阶段我国全力推进干细胞产业化,加快医疗新技术在临床中的转化与应用具有重大现实意义。
利益冲突所有作者均声明不存在利益冲突
