汉麻籽分离蛋白提取技术优化及其组成和乳化性表征
2021-06-07曾剑华李美莹王子玥杨宏哲石彦国朱秀清
孟 妍,曾剑华,李美莹,王子玥,杨宏哲,石彦国,朱秀清
(哈尔滨商业大学食品工程学院 黑龙江省普通高等学校食品科学与工程重点实验室黑龙江省谷物食品与谷物综合加工重点实验室 哈尔滨150076)
汉麻又称大麻、火麻。我国汉麻品种繁多,主要包括巴西火麻、云南汉麻、甘肃清麻、六安寒麻等。其籽仁中蛋白质和脂质含量丰富,分别约占20%~25%和50%~55%。此外,其籽仁中还含有人体所必需的钙、钾、磷、镁、铁和锌等矿物质元素,营养价值很高[1-2]。随着市场对健康食品的需求不断增加,汉麻籽蛋白成为新兴的植物蛋白源。
汉麻籽蛋白(Hemp protein isolate,HPI)由球蛋白和白蛋白组成,其中球蛋白含量高达65%[3],其分子是由酸性亚基和碱性亚基通过二硫键连接组成的六聚体[4]。白蛋白含量较少,约占35%。HPI富含20 种氨基酸,包括8 种人体必需氨基酸[3],其中精氨酸含量最为丰富[5]。目前,国内外对汉麻籽蛋白的研究主要在提取技术以及功能性这两方面。提取技术主要包括胶束提取法和碱溶酸沉法。Murray 等[6]采用胶束提取法提取HPI,在胶束化过程中去除非蛋白质类物质,得到的分离蛋白纯度高达98.8%。Tamara 等[7]采用碱溶酸沉法提取HPI,蛋白纯度达到91.44%。张维等[8]提取所得HPI 的蛋白质纯度为83.8%。张涛[9]尝试采用碱溶酸沉法提取HPI,纯度达92.39%。虽然胶束法提取得到的HPI 蛋白质纯度高于碱溶酸沉法,但是其操作较繁琐,不利于工业生产,而碱溶酸沉法操作简单,便于工业化生产,故本试验选取碱溶酸沉法提取HPI,旨在优化提取技术获得蛋白质纯度较高的HPI。
国内外学者对汉麻籽蛋白的功能性研究主要集中在溶解性、凝胶性、起泡性和乳化性等。乳化性是HPI 重要的功能特性,具有广泛的用途。目前对于HPI 乳化性的研究主要是在不同蛋白质浓度和盐离子添加量等方面。Malomo 等[10]研究在相同蛋白质浓度下,球蛋白在pH 3.0 和5.0 时乳化稳定性高于白蛋白,而在pH 7.0 时乳化稳定性低于白蛋白。在高盐浓度条件下,HPI 乳状液会形成强有力的界面膜,乳化稳定性处于稳定状态。低盐浓度时HPI 乳化活力下降,乳化稳定性增大;高盐浓度时乳化活力上升,乳化稳定性减弱[11]。目前,pH值协同热处理对HPI 乳化性的影响研究尚未见报道,本文通过响应面法优化提取工艺获得蛋白质纯度较高的HPI,在此基础上,采用pH 值协同热处理对HPI 乳化性进行系统研究,旨在为HPI 深加工利用奠定基础。
1 材料与方法
1.1 材料与试剂
汉麻籽籽仁,广西巴马县;浓硫酸、盐酸、氢氧化钠、硫酸钾、硼酸、硫酸铜、磷酸氢二钠、磷酸二氢钠(均为分析纯级),天津市天力化学有限公司。
1.2 设备与仪器
FW100 粉碎机,天津泰斯特仪器有限公司;HH-S4 恒温水浴锅,巩义市予华仪器有限公司;PCE-E3000 恒温振荡器,苏州凯特尔仪器有限公司;DHG-912A 电热鼓风干燥箱,上海科技有限公司;TG16-WS 离心机、Alpha 1-2 LDplus 冷冻干燥机,湘仪实验室仪器开发有限公司;HFVP-Ⅱ消化炉,上海纤检科技有限公司;220V-AC 电炉,上海树立仪器仪表有限公司;XHF-DY 高速分散器,宁波新芝生物科技股份有限公司;BS224S 分析天平,赛多利斯科学有限公司;DYY-6D 型电泳仪,北京六一生物科技有限公司;Alpha-1506 分光光度计,上海谱元仪器有限公司;pHS-25 pH 计,杭州杰源仪器科技有限公司;Nazo Zetasizer 90马尔文激光粒度仪,英国马尔文仪器有限公司。
1.3 方法
1.3.1 脱脂汉麻籽饼粕的制备 称取一定量的汉麻籽,按料液比1∶8 加入正己烷,室温振荡脱脂8 h,烘干备用。
1.3.2 汉麻籽分离蛋白提取 称取脱脂汉麻籽饼粕与去离子水以一定的料液比混合,调节料液pH值至8.5,振 荡(200 r/min,60 min,25℃)碱 提1 h,于4 000 r/min 转速下离心20 min,获取上清液,用1 mol/L HCl 调节pH 值至4.7,室温下(25℃)静止30 min,离心(10 000 r/min,20 min)后弃去上清液获得汉麻籽蛋白凝乳。调节汉麻籽蛋白凝乳pH 值为7.0,冷冻干燥得到汉麻籽分离蛋白,备用。

1.3.3 单因素试验 以蛋白提取率为指标,分别对料液比、提取时间、提取温度、提取pH 值、酸沉pH 值5 个因素进行单因素试验。设定料液比为1∶10,1∶15,1∶20,1∶25,1∶30,提取温度为30,35,40,45,50℃,提取时间30,60,90,120,150 min,提取pH 8.0,8.5,9.0,9.5,10.0,酸沉pH 4.5,4.6,4.7,4.8,4.9,5.0。
1.3.4 响应面法优化试验 通过单因素试验选取主要影响因素料液比(A)、提取时间(B)、提取温度(C)、提取pH 值(D),以汉麻籽分离蛋白提取率(R)为响应指标,采用Box-Benhnken 中心组合设计进行四因素三水平响应面优化试验,因素水平设计见表1。
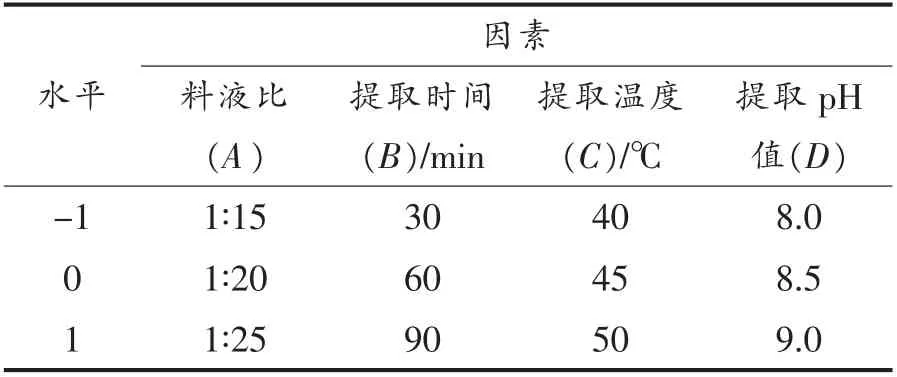
表1 响应面分析因素水平表Table 1 Factors and levels of the response surface methodology
1.3.5 汉麻籽分离蛋白理化指标测定 蛋白质含量测定:参照GB 5009.5-2016《食品安全国家标准 食品中蛋白质的测定》中的凯氏定氮法;灰分的测定:参照GB 5009.4-2016《食品安全国家标准 食品中灰分的测定》;水分含量测定:参照GB 5009.3-2016《食品安全国家标准 食品中水分的测定》。
1.3.6 SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)电泳检测 取0.5 mL 质量浓度为2 mg/mL 样品溶液加入0.5 mL 样品缓冲液(含有0.2 mL 10%SDS 和50 μL 0.01 mol/L β-巯基乙醇)混匀后,沸水浴10 min,上样量为20 μL(Marker 上样量5 μL)。样品进入5%浓缩胶时电压为120 V,进入12%分离胶时电压为100 V。样品跑至距底部1 cm 处时停止电泳取出凝胶,采用考马斯亮蓝染液染色,30 min 后用脱色液脱色,多次更换脱色液,直至背景清晰[12-13]。
1.3.7 汉麻籽分离蛋白功能特性测定 设置pH 7.0,水浴加热30 min 为固定条件,考察温度(25,35,45,55,65,75,85,95℃)对汉麻籽分离蛋白溶解性、乳化性及乳化稳定性的影响。
设置温度55℃,水浴加热30 min 为固定条件,考察pH 值(2.0,3.0,4.0,5.0,6.0,7.0,8.0,9.0,10.0,11.0,12.0)对汉麻籽分离蛋白溶解性、乳化性及乳化稳定性的影响。
设置温度55℃,pH 7.0 为固定条件,考察加热时间(0,15,30,45,60,75,90,105,120 min)对汉麻籽分离蛋白溶解性、乳化性及乳化稳定性的影响。
1.3.8 汉麻籽分离蛋白溶解性测定 参照文献[14]的方法并稍作修改。配制2 mg/mL 蛋白溶液,用0.5 mol/L HCl 溶液调节pH 值分别为2.0,3.0,4.0,5.0,6.0,7.0,8.0,9.0,10.0,11.0,12.0,于4 000 r/min 离心15 min 后备用。取20 μL 样品溶液加水至100 μL,之后加入5 mL 考马斯亮蓝,在涡旋振荡器上混匀,于波长595 nm 处测定吸光度,以pH值为横坐标、蛋白质量浓度(mg/mL)为纵坐标,绘制蛋白质量浓度-pH 值标准曲线。蛋白溶解性按式(2)计算:

1.3.9 汉麻籽分离蛋白乳化性测定 配制1%的汉麻籽分离蛋白溶液,分别以温度、pH 值、加热时间和静置时间变量测定汉麻籽分离蛋白的乳化性。取10 mL 汉麻籽分离蛋白溶液加入20 mL 大豆色拉油中,在高速分散机上均质(12 000 r/min,3 min)形成均匀的乳化液然后静置。分别在静置后的第0 分钟和第10 分钟从底部吸取100 μL 乳化液,用5 mL 0.1%的十二烷基硫酸钠(SDS)稀释,在波长500 nm 条件下测定吸光值。乳化活性(EAI)用第0 分钟的样品吸光值A0 表示[14-15]。

式中,N——稀释倍数;c——蛋白质质量浓度,g/mL;Φ——光程长,取值0.01;Ø——体积分数,取值0.65。
1.3.10 乳化稳定性测定取1.3.9 节的乳化液[16-17]进行高速离心之后,用Nazo Zetasizer 90马尔文激光粒度仪测其粒径大小。仪器设置为自动测量每个乳化液的粒径大小,3 次平行。将乳化液室温保存30 min 后,再次测其乳状液粒径,得其乳化稳定性。

1.3.11 乳液形态表征 先将汉麻籽蛋白-大豆油乳化体系均质,再从底部取100 μL 乳液滴在干净载玻片上,确保没有气泡产生,用盖玻片盖紧后,放置于光学显微镜下,在10 倍目镜、40 倍物镜的条件下,观察形态特征并拍照。
1.4 统计分析
所有测定重复3 次,试验数据以“平均值±标准差”表示,数据采用Origin 8.5 与Design Expert 8.0.6 进行分析和绘制。用SPSS 19.0 进行ANONA单因素方差分析,并采用Ducan 检验(P<0.05)数据的差异显著性。
2 结果与分析
2.1 单因素试验分析
2.1.1 料液比对汉麻籽分离蛋白提取率的影响随着料液比的增大,蛋白提取率呈现升高的趋势。当料液比为1∶20 时,蛋白提取率达到36.37%。料液比继续增大,蛋白提取率为36.42%和36.54%,趋于平衡状态,没有明显变化(P>0.05)。当料液比低于1∶20 时,体系黏稠度较大,分子扩散速率较低,提取液分布不均,降低了传质效率[18];当料液比增大时,稀释作用加强,溶液体系黏度下降,传质效率提高,蛋白质溶出率增大,因而HPI 提取率增大;当料液比大于1∶20 时,蛋白质溶解达到饱和,提取率不再升高。考虑到后续试验的处理过程,本试验选择料液比1∶20 作为最佳的料液比参数。

图1 料液比对HPI 提取率的影响Fig.1 Effects of ratio of water to material on extraction rate of HPI
2.1.2 提取时间对汉麻籽分离蛋白提取率的影响 因为脱脂汉麻籽饼粕的溶胀需要一定的时间,所以随着提取时间的延长,蛋白提取率逐渐升高。根据斐克扩散定律,物料中可溶性物质的溶出量与浸提时间成正比[19]。当提取时间为60 min 时,蛋白提取率达到36.3%。时间继续延长,汉麻籽蛋白溶解度不再升高,提取率趋于平衡,说明可溶性蛋白基本已经全部浸出。考虑到后续试验的处理过程,本试验选择60 min 作为最佳提取时间。

图2 提取时间对蛋白提取率的影响Fig.2 Effects of extraction time on extraction rate of protein
2.1.3 提取温度对汉麻籽分离蛋白提取率的影响 随着提取温度升高,蛋白提取率逐步升高。当提取温度达到45℃时,蛋白提取率达到37.22%。温度继续上升,溶液体系黏度下降、传质速度增大,使HPI 提取率增大;同时温度升高,分子的扩散速率增加,提取率上升。若提取温度过高,蛋白质分子结构的伸展使疏水核心暴露,通过疏水作用聚集沉淀;此外高温会引起部分蛋白发生变性,生成不溶性聚集体,降低了蛋白提取率[20],并且50℃的提取率与45℃相比没有显著差异(P>0.05)。综合各个因素考虑,选择45℃作为最佳提取温度。
2.1.4 提取pH 值对汉麻籽分离蛋白提取率的影响 随着提取pH 值的增大,蛋白提取率逐渐升高。当提取pH 值为8.5 时,蛋白提取率达到最高33.21%。适当提高pH 值有利于增大蛋白表面电势,增强静电引力从而促进蛋白溶解,提高蛋白提取率。由于提取pH 值太高会导致赖氨酸与丙氨酸或胱氨酸之间发生缩合反应[20],故选择pH 8.5为最佳提取条件。

图3 提取温度对蛋白提取率的影响Fig.3 Effects of extraction temperature on extraction rate of protein

图4 提取pH 值对蛋白提取率的影响Fig.4 Effects of extraction pH value on extraction rate of protein
2.1.5 酸沉pH 值对汉麻籽分离蛋白提取率的影响 蛋白质是两性电解质,在酸性溶液中呈阳离子,在碱性溶液中呈阴离子,蛋白质分子所带净电荷为零时的pH 值为蛋白质等电点。由图5可以看出,当pH=4.7 时,汉麻籽蛋白含量最高,此时酸沉效果最好;当pH<4.7 时,蛋白提取率较低;当pH>4.7 时,随着pH 值的增加,蛋白提取率有下降的趋势。综上,选择pH 4.7 为汉麻籽蛋白的等电点。

图5 酸沉pH 值对蛋白提取率的影响Fig.5 Effects of pH value of acid precipitation on extraction rate of protein
2.2 响应面分析
2.2.1 响应面试验结果分析 综合单因素试验结果,选取料液比、提取时间、提取温度和提取pH值利用Design-Expert 8.0 软件按照Box-Behnken原理设计四因素三水平响应面试验。根据试验设计确定的试验方案对HPI 提取进行优化,试验设计方案及结果见表2。

表2 响应面设计方案及结果Table 2 Design proposal and experiment result of response surface
利用Design Expert 8.0.6 软件对试验结果进行方差分析,结果见表3。将试验数据进行多元回归拟合,得到蛋白提取率(Y)与料液比(A)、提取时间(B)、提取温度(C)、提取pH(D)的二次响应面回归方程为:
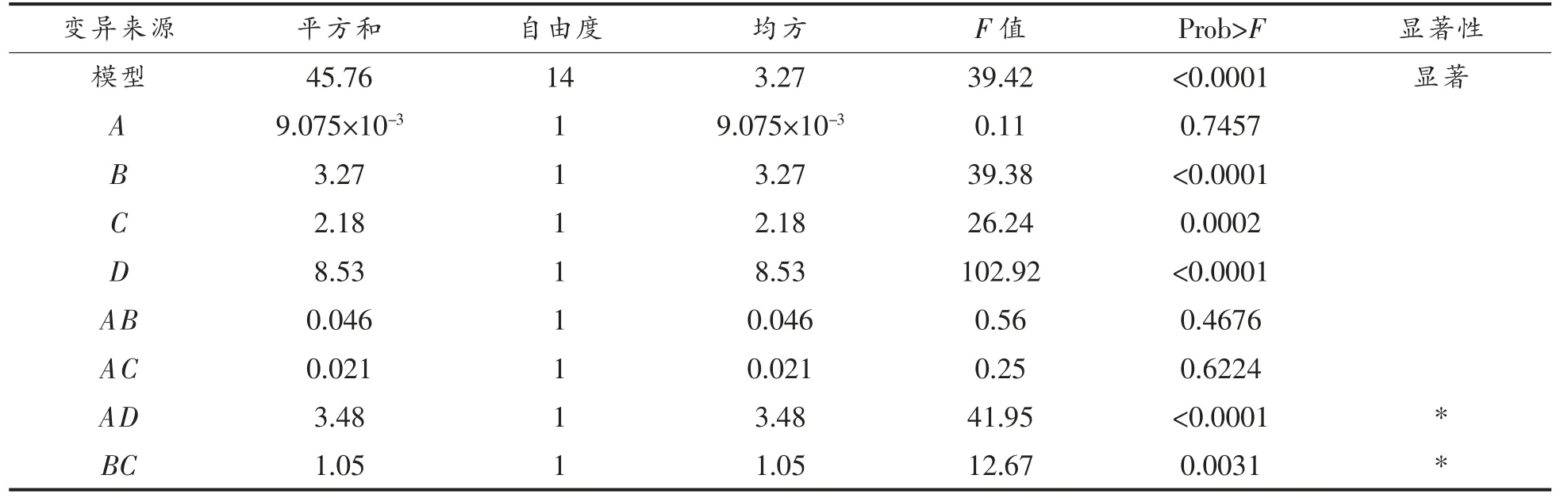
表3 方差分析表Table 3 Analysis of variance table
Y=35.33-0.027A+0.52B-0.43C-0.84D-0.11AB-0.072AC-0.93AD-0.51BC-1.39BD+0.49CD-0.96A2-1.30B2-0.96C2-0.93D2。

(续表3)
表3可知,模型在P≤0.001 时水平极其显著,表明试验设计是可靠的,试验的相关系数R2=0.9803,说明模型的预测值和试验值相关性较好,模型对试验结果的描述很好。从回归模型系数显著性检验结果可以看出,模型的一次项B,C,D 差异极显著;交互项AD,BD 差异极显著,BC 较显著;二次项A2,B2,C2,D2极显著。说明各影响因素对汉麻籽分离蛋白的影响不是简单的线性关系。对回归方程进行中心标准化处理,回归方程Y 一次项回归系数的绝对值大小依次为D,B,C,A,表明4 个因素对蛋白提取率影响顺序为:提取pH值>提取时间>提取温度>料液比。
分别将模型中的料液比(A)、提取时间(B)、提取温度(C)、提取pH 值(D)的其中1 个因素固定在0 水平,得到另外2 个因素交互作用对蛋白提取率Y 的模型,并根据模型分别绘制响应面图,见图6。
2.2.2 各因素对汉麻籽蛋白提取率的影响 响应面图形是响应值对各试验因子所构成的曲面图,分析曲面图可以看出各参数之间的相互作用和最佳参数[21]。如图6c,6d,6e,较为明显的反映了各因素对汉麻籽蛋白提取率的影响。
图6c 为料液比和提取pH 值对蛋白提取率的影响。当提取时间60 min,提取温度45℃时,由图6c 的曲面图可知,提取时间越长,提取率随着提取pH 值增大而先升高后下降;提取pH 值越大,提取率随着料液比增大而先升高后下降。
图6d 为提取时间和提取温度对蛋白提取率的影响。当料液比1∶20,提取pH 8.5 时,由图6d的曲面图可知,料液比升高,提取率随着提取pH值增大,曲面图先升高后下降的趋势越显著;提取pH 越大,提取率随着提取时间越长呈现先升高后下降的趋势。
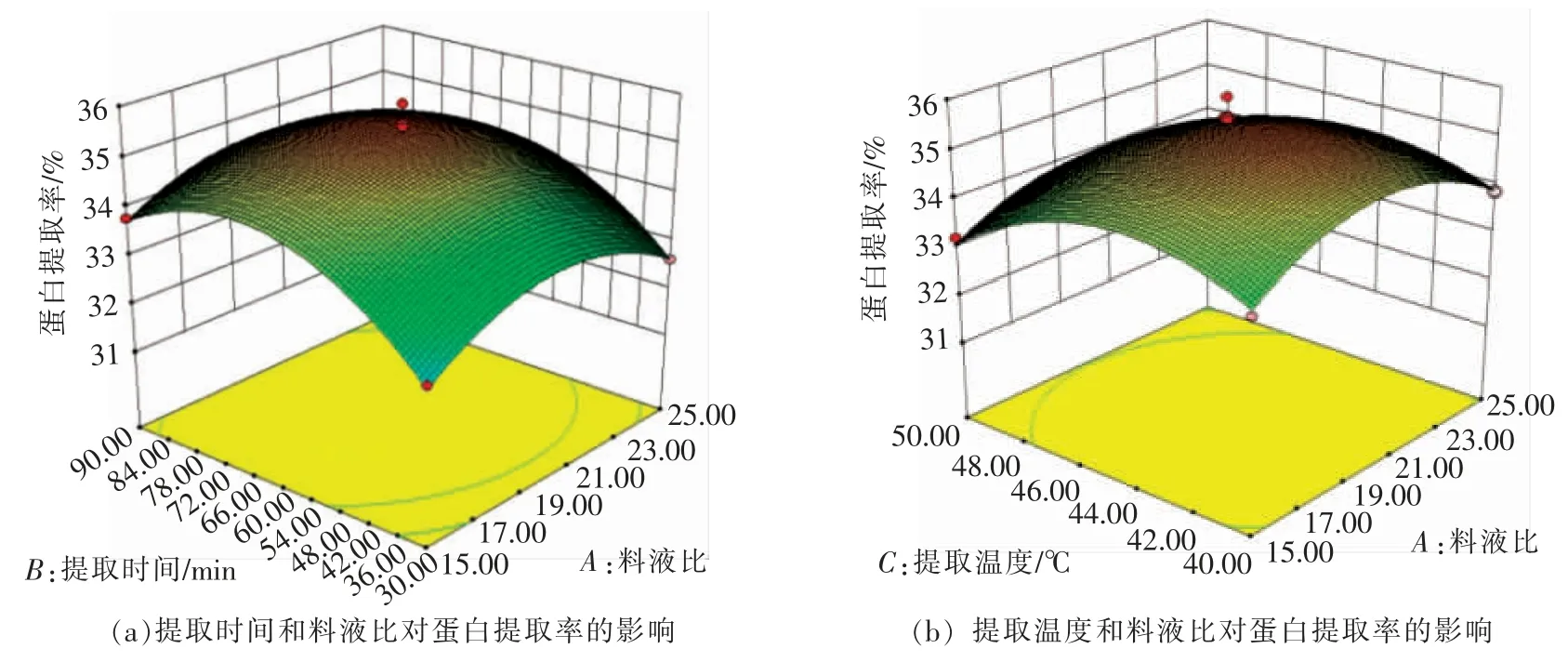
图6e 为提取时间与提取pH 值对蛋白提取率的影响。当料液比1∶20,提取温度45℃时,由图6e 的曲面图可知,提取时间越长,提取率随着提取pH 增大,曲面图呈现先升高后下降的趋势越明显;提取pH 越大,提取率随着提取时间增大先升高后下降的趋势越明显。
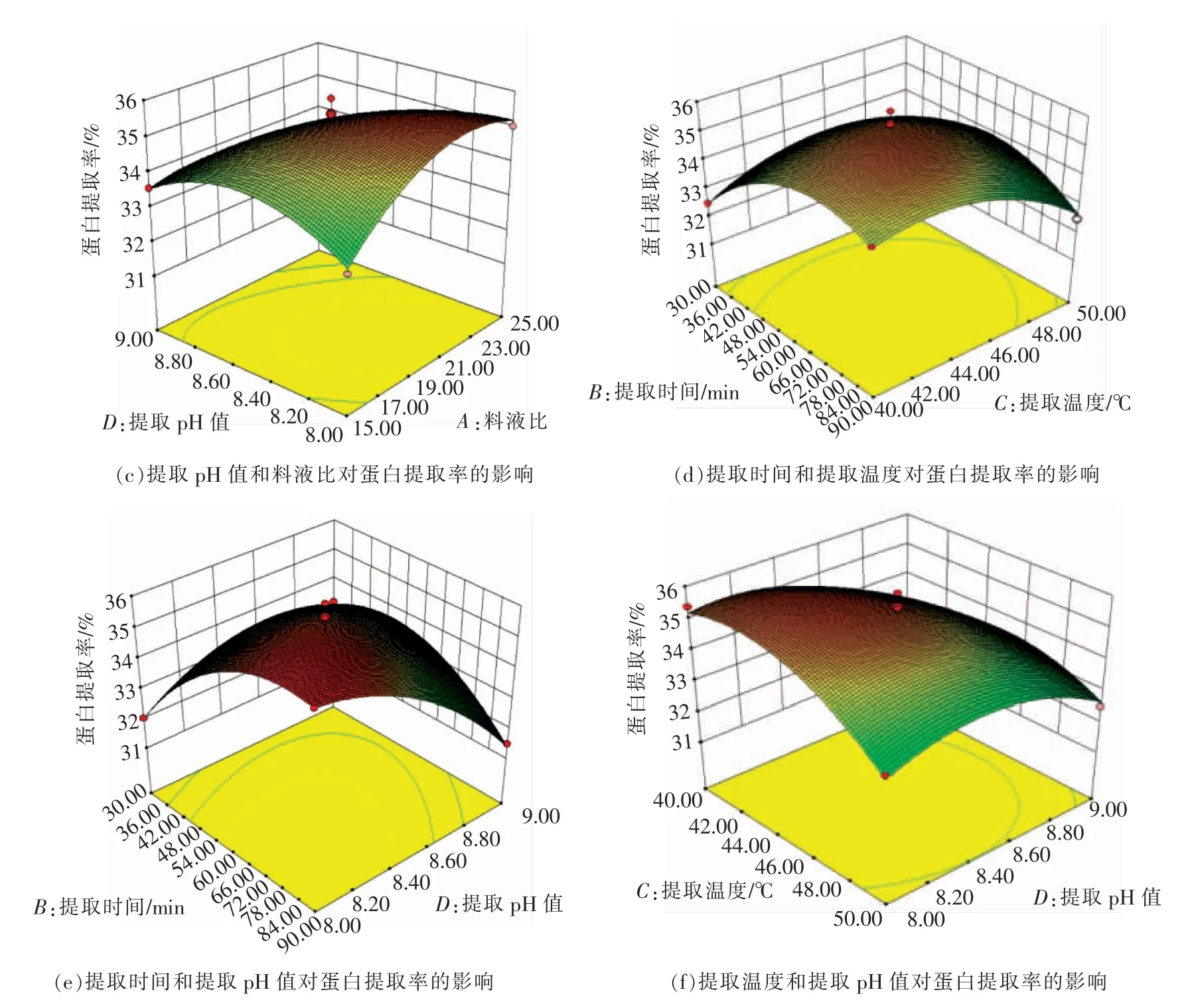
图6 两因素交互作用响应面图Fig.6 Respose surface of interaction between two factors
由图6可知,Y 随着各因素值的增加而呈上升趋势,达到一定值后,Y 开始逐渐下降。提取时间、提取温度、提取pH 值对蛋白提取率影响显著,曲线相对较陡,料液比与之相比较,曲线较平滑,响应值变化较小,其中料液比对蛋白提取率的影响最不显著。
2.2.3 最佳提取条件及验证 对简化后的回归模型进行分析,在试验所取的水平范围内求蛋白提取率最优值,得到最佳工艺参数为:料液比1∶20.48,提取时间70.74 min,提取pH 8.32,提取温度43.63℃,此条件下蛋白提取率为35.92%。
为验证最佳工艺参数的可靠性,结合试验的可行性,选取料液比为1∶20、提取时间70 min、提取pH 8.3、提取温度44℃。在此条件下进行3 次重复验证试验,得到汉麻籽蛋白提取率为(34.9 ±0.62)%,与理论值的偏差为0.4%,没有显著性差异,这说明响应面法优化的模型回归方程及最佳条件可靠,该回归方程可以应用。
2.2.4 提取次数对汉麻籽分离蛋白提取率的影响 在获得响应面最佳工艺条件的基础上,考察提取次数对HPI 提取率的影响。如图7所示,随着提取次数的增加,蛋白提取率有所上升。提取1 次与提取2 次之间比较,提取率增加较为明显;分别为34.9%和39.15%。提取2 次与提取3 次之间比较,提取率增加较平缓,说明可溶性蛋白几乎全部提取出来。考虑到节省电能、时间和提取液用量等综合因素,选取提取次数2 次作为HPI 提取的最佳条件。

图7 提取次数对蛋白提取率的影响Fig.7 Effect of extraction times on extraction rate of protein
2.3 汉麻籽蛋白的理化性质
对通过响应面优化试验得到的汉麻籽分离蛋白进行理化指标测定,其蛋白质含量为(93.54 ±0.54)%,水分(2.82 ±0.12)%,灰分(2.38 ±0.23)%。
2.4 汉麻籽蛋白SDS-PAGE 分析
由图8可知,以大豆分离蛋白为参照,通过聚丙烯酰胺凝胶电泳分析可知HPI 主要组分为麻仁球蛋白,其含有2 个亚基,分别为酸性亚基和碱性亚基,分子量为37 ku 和21 ku。通过Densi-tometric 扫描技术对HPI 组分进行分析,麻仁球蛋白组分占HPI 76.41%,白蛋白占23.59%左右。除酸性亚基和碱性亚基条带外,51 ku 左右有一条明显的条带,分子质量小于12 ku 也有部分条带,可能与HPI 中白蛋白成分相对应,此结论与Tang 等[22]的研究结论一致。

图8 电泳分析图Fig.8 SDS-PAGE of HPI
2.5 HPI 溶解特性表征
蛋白质水化作用的指标之一是蛋白质在水中的溶解性,蛋白质-蛋白质、水-水、蛋白质-水相互作用的综合结果,分析蛋白质的溶解性是研究蛋白其它功能特性的前提。
2.5.1 pH 值对HPI 溶解性的影响由图9可知,不同pH 值条件下,蛋白质溶解性PDI 存在很大差异。在pH 4~5 之间,HPI 溶解性最低;pH=4.7时,HPI 溶解度达到1.47%,由此判断HPI 等电点为4.7,在等电点附近蛋白溶解性最低,与酸沉条件相一致。HPI 处于等电点时,其自身的静电荷为零,蛋白质之间的静电排斥力较低,导致蛋白质相互聚集而产生沉淀[12];远离等电点时,HPI 溶解性较高。由于碱性条件下有利于HPI 中球蛋白分子解离,故在pH 大于12 时,HPI 溶解度高达80%以上,说明HPI 是一种典型的碱溶性蛋白[10,23]。
2.5.2 加热温度对HPI 溶解性的影响 加热可以分解蛋白质,使蛋白质的溶解度增高。由图10可知,当温度低于55℃时,PDI 随着温度的升高而逐渐增大;当温度为55℃时,HPI 的PDI 达到最大;当温度高于55 时,PDI 随温度升高而降低,这是由于热运动的增加导致汉麻籽蛋白结构展开,疏水基团暴露,使得蛋白质分子发生聚集而产生沉淀,导致溶解度降低[14,24-25]。
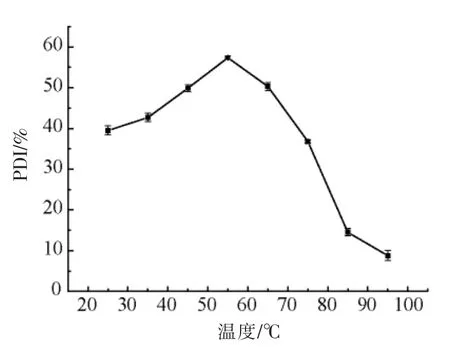
图10 加热温度对PDI 的影响Fig.10 Effects of temperature on PDI
2.5.3 加热时间对汉麻籽分离蛋白溶解性的影响 适当的加热可以使蛋白质分子伸展,增加蛋白质溶解度。然而,加热时间过长,小分子可溶性蛋白聚集成大分子蛋白,从而使溶解度降低。适当控制加热时间可避免蛋白溶解度的降低。由图11可知,随着加热时间的增加,汉麻籽蛋白溶解性逐渐升高。当加热时间为60 min 时,HPI 溶解性达到最大;继续增大加热时间,溶解性降低[26]。

图11 加热时间对溶解性的影响Fig.11 Effects of heating time on PDI
2.6 HPI 乳化性表征
乳化性是蛋白质的重要功能性质之一。在食品乳化体系中,添加适量蛋白质有助于降低油水界面张力,避免油滴聚集,从而提高体系稳定性[27-29]。影响蛋白质乳化性的因素有温度,蛋白质溶解度、pH 值等。
2.6.1 pH 值对HPI 乳化性及乳化稳定性的影响 由图9可知,HPI 等电点为4.7,PDI 为1.47%,由于蛋白质自身静电荷为零,蛋白质之间的静电排斥相互作用较弱,溶解性最小,吸附在油水界面的蛋白质含量减少,所以乳化性较低。偏离等电点时,HPI 溶解性升高,利于蛋白界面载量的提高和高黏弹膜的形成[30-31],乳化性升高,表现出良好的乳化性能,蛋白质乳化性和溶解性呈现正相关。pH 7.0 时,乳化稳定性最好(78.3%),说明蛋白质在中性条件下能体现优良的乳化稳定性。

图9 pH 值对PDI 的影响Fig.9 Effects of pH value on PDI
2.6.2 温度对HPI 乳化性及乳化稳定性的影响 温度对HPI 乳化性及乳化稳定性的影响见图13,HPI 溶解性随着温度的升高,先升高后降低在55℃时HPI 溶解性达到最高(57.36%)。由图13可知,HPI 乳化性和乳化稳定性随着温度的升高先升高后降低,其乳化性和乳化稳定性与溶解性趋势相同,在55℃时达到最高(265.88 m2/g)。温度升高使蛋白质分子伸展程度变大,更易吸附在油水界面。温度继续升高,蛋白质受热过高产生聚集,导致溶解度降低。加热能降低吸附在界面上的蛋白质膜的黏度和硬度,且高温使乳化颗粒运动加剧,因此乳化性和乳化稳定性均下降[32-33]。

图12 pH 值对HPI 乳化性及乳化稳定性的影响Fig.12 Effects of pH value on emulsification and emulsification stability
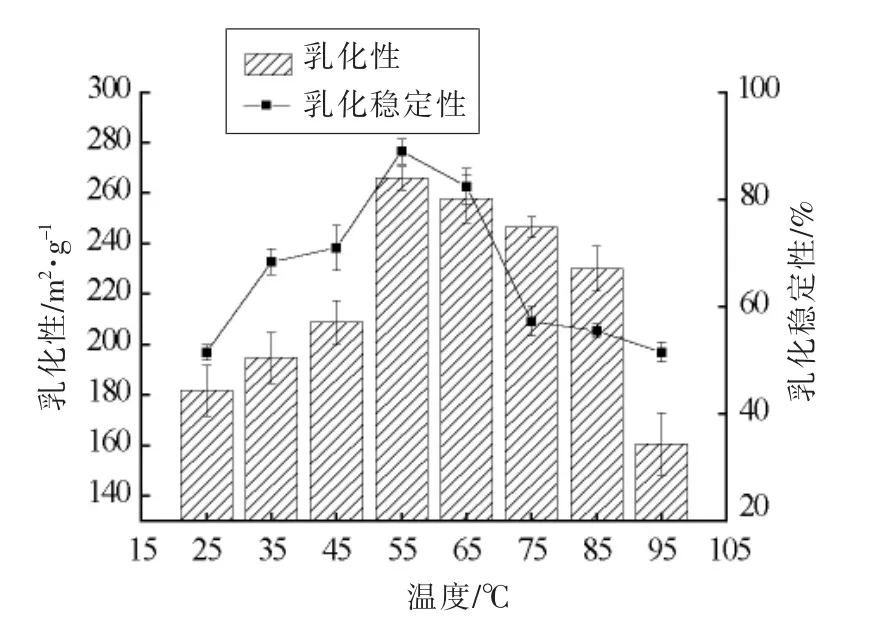
图13 温度对乳化性及乳化稳定性的影响Fig.13 Effects of different temperature on emulsification and emulsification stability
2.6.3 加热时间对HPI 乳化性及乳化稳定性影响 选择55℃,pH 7 的条件下对HPI 进行加热,加热时间对HPI 乳化性及乳化稳定性的影响如图14所示。随着加热时间的增长,HPI 溶解性升高,可溶性蛋白增多,形成界面膜,使得蛋白乳化性逐渐升高。当加热60 min 时,蛋白乳化性达到最高(257.42 m2/g),继续延长加热时间,蛋白乳化性降低,可能是由于蛋白质分子在加热过程中发生部分变质使得溶解度降低所致。

图14 加热时间对HPI 乳化性及乳化稳定性的影响Fig.14 Effects of heating time on emulsification and emulsification stability
2.6.4 静置时间对HPI 乳化性及乳化稳定性影响 选取55℃,pH 7,加热时间60 min 的HPI,其静置时间的延长对乳化性及乳化稳定性影响如图15所示。随着时间的增加,乳化性及乳化稳定性逐渐降低,在40 min 时乳化性及乳化稳定性虽最低,但是与大豆分离蛋白的乳化性(80 m2/g)[34-36]相比,汉麻籽分离蛋白具有很好的乳化性,可作为较好的乳化剂原料。

图15 不同静置时间对乳化性及乳化稳定性影响Fig.15 Effects of different standing time on emulsification and emulsification stability
2.7 乳状液光学显微镜观察
采用光学显微镜观察乳化液液滴颗粒分布情况。由图16可知,HPI 变性前后乳液粒径变化较大,未经处理的乳液液滴颗粒较大且分布不均,最优乳化条件处理后形成的乳液液滴颗粒较小且分布较为均匀,没有产生明显的液滴聚集现象。乳液发生聚集或絮凝现象可判断乳液稳定性,因此在汉麻籽蛋白乳液的制作过程中,控制温度、pH 值、加热时间范围有助于蛋白乳化体系的形成。蛋白乳化性越好,其形成的乳液粒径越小[37]。

图16 乳状液形态特征Fig.16 Photomicrographs of hempseed protein emulsions
3 结论
本试验通过单因素试验和响应面法建立以汉麻籽蛋白提取率为响应值,料液比、提取时间、提取温度、提取pH 值为因变量的汉麻籽蛋白提取工艺理论模型,模型拟合度良好。方差分析得出,四因素对蛋白提取率影响大小为:提取pH 值>提取时间>提取温度>料液比,最终确定最佳提取工艺条件为:料液比1∶20,提取时间70 min,提取pH 8.3,提取温度44℃,测得蛋白质实际提取率为(39.15 ±0.28)%。用该工艺提取汉麻籽分离蛋白,其蛋白质含量达到(93.54 ±0.54)%,水分为(2.82 ±0.12)%,灰分为(2.38±0.23)%,分子质量主要分布在20~50 ku 之间。研究发现,汉麻籽蛋白的溶解特性和乳化特性与经典的植物蛋白变化相符,汉麻籽蛋白乳化性在pH 2~10 条件下先降低后升高,随着温度的升高和加热时间的延长,乳化性先升高后降低。在pH 10,温度55℃,加热时间60 min 时,汉麻籽蛋白乳化性及乳化稳定性达到最高,分别为305.53 m2/g 和92.04%。与最优乳化条件处理后的汉麻籽蛋白相比,未处理的汉麻籽蛋白乳状液粒径大小分布不均匀,有大液滴存在;最优条件处理后的汉麻籽蛋白乳液粒径分布均匀,粒径变化不大,乳化稳定性较好,并且其乳化性在不同条件下均优于大豆蛋白,可作为一种优质蛋白原料,具有一定的开发价值。
