二母散对博来霉素诱导大鼠肺纤维化模型FGF、CTGF和Collagen Ⅰ表达的影响*
2021-06-07李想刘畅
李 想 刘 畅
(中国医科大学肿瘤医院 辽宁省肿瘤医院,沈阳 110042)
二母散来源于《景岳全书》卷五十七,川贝母6 g(去芯),知母6 g,上药水煎服,贝母化痰泻肺火,知母滋肾清肺金,润能去燥,苦能泄热,主治肺热咳嗽,喘急咳嗽[1]。中医把肺纤维化归为肺痿、肺痹,主要涉及肺、脾、肾三脏,常因病情日久,出现虚实夹杂,主要是气虚、阴虚、阳虚或者肺肾阴虚。所以在肺纤维化的治疗中,常常采用补虚、扶正的方法。肺纤维化也分为急性期和缓解期,在缓解期时会采用补肺、补肾的方法,二母散的功效为滋阴清肺,止咳化痰,与肺纤维化的干咳、乏力、呼吸困难等常见症状相适应。研究表明化痰类中药川贝母对肺纤维化有明显的干预作用,川贝母可从氧化应激、炎症反应、血管新生等多途径对大鼠肺纤维化模型产生影响。湖北省中医院杨毅教授常用二母散治疗感染后咳嗽、慢性咳嗽、支气管哮喘、肺炎、慢性阻塞性肺疾病等急慢性呼吸道疾病常获良效[2]。渠乐等[3]研究表明二母散对稳定期肺阴亏虚型老年COPD患者临床疗效显著,可显著降低炎症指标水平,改善患者肺功能,缓解临床症状。北京中医药大学东直门医院姜良铎教授治疗肺间质纤维的常以具有扶正以补益肺、脾、肾气阴虚的紫河车、赤芍、白芍、知母、贝母等药物为主[4]。本研究以二母散为研究对象,探索其对博来霉素诱导肺纤维化模型的影响,为肺纤维化的防治及其中药新药的研制提供实验依据。
1 材料与方法
1.1 受试药物
川贝母粉,购自江阴天江药业有限公司(批号:19071351,每袋1 g);知母配方颗粒,购自江阴天江药业有限公司(批号:19102311,每袋2.5 g相当于10 g生药);盐酸泼尼松片,购自遂成药业股份有限公司(批号1812132,5 mg/片,60 mg/d)。
1.2 实验动物及饲养环境
SPF级SD大鼠50只,雄性,体质量180~220 g,购自辽宁长生生物有限公司,实验动物生产许可证号:SCXK(辽)2015-0001。中国医科大学附属盛京医院实验动物使用许可证号:SYXK(辽)2017-0004。相对湿度55%~60%,温度22~25 ℃,昼夜交替12 h/12 h。实验期间大鼠自由摄食及饮水。
1.3 仪器设备及试剂
烤片机和摊片机,购自阳光神琦医用科技有限公司;BX53型奥林巴斯光电显微镜;电热恒温培养箱,购自厦门医疗电子仪器厂;TP1020型自动徕卡脱水机;德国徕卡切片机;赛默飞世尔全自动免疫组化染色机;无水乙醇,购自沈阳市新化试剂厂(批号:20190711);PBS磷酸盐缓冲盐,购自北京Solarbio科技有限公司(批号:20190215);多聚甲醛(批号:20190428)和乙醚(批号:10009318),购自国药集团化学试剂有限公司;Ⅰ型胶原蛋白抗体试剂盒(Anti-Collagen Ⅰ antibody,批号:09030578R)、成纤维细胞生长因子抗体试剂盒(Anti-FGF antibody,批号:09022123483R)和结缔组织生长因子抗体试剂盒(Anti-CTGF antibody,批号:09040743R),购自北京博奥森生物技术有限公司;枸橼酸缓冲盐(批号:19012613)、TMS-P超敏试剂盒(批号:190425382l)和DAB显色试剂盒(批号:1904240412B),购自福建迈新生物技术开发有限公司。
1.4 方法
1.4.1动物造模及给药:50只SD大鼠,按体质量随机分为假手术组(SC组)、模型对照组(M组)、二母散低剂量组(1.08 g生药/kg,EL组)、二母散高剂量组(2.16 g生药/kg,EH组)(注:二母散的每日拟用量为12 g生药,根据人与大鼠用药量转换方法:200 g大鼠的每日用药量=人用量×0.018。即大鼠给药量为12 g生药×0.018/200 g×1 000 g=1.08 g生药/kg;高剂量组给药量为为低剂量给药组的2倍即1.08 g生药/kg×2=2.16 g生药/kg)、泼尼松对照组(5.4 mg/kg,PR组),每组10只。大鼠适应饲养一周后,乙醚麻醉,切开颈部皮肤,暴露气管,经气管内滴注博莱霉素溶液0.2 mL(50 mg/mL)[5],为了使博莱霉素溶液能够在肺内均匀分布,滴注后立即将大鼠直立并左右摇晃20 s[6]。假手术组滴入等体积的生理盐水。造模3 d后开始灌胃给药,给药剂量为10 mL/kg,假手术组和模型对照组灌胃等体积的蒸馏水, 1次/d,连续给药4周。实验结束大鼠禁食不禁水12 h,称体质量,乙醚麻醉,取肺脏称质量,计算肺脏指数(肺脏指数=肺质量/体质量×100%)[7],取右肺中叶,多聚甲醛溶液固定,用于HE染色和免疫组化染色。
1.4.2HE染色方法:将肺组织从固定液中取出脱水,石蜡包埋,制作5 μm石蜡切片,常规HE染色。光学显微镜下观察各组大鼠肺组织病理改变。根据Szapiel标准对肺泡炎症及肺纤维化进行病理分级评价[8]:1级,无炎症,0分;2级,轻度炎性细胞浸润和纤维化,范围小于20%,1分;3级,中度肺炎和纤维化,肺泡间隔增厚,20%~50%,2分;4级,重度肺炎和纤维化,病变范围大于50%,3分。
1.4.3免疫组化染色方法:石蜡切片于60 ℃烘烤4 h,常规梯度脱蜡至水,PBS漂洗15 min,3% H2O2孵育10 min,PBS漂洗15 min,将切片置于pH 7.0的枸橼酸缓冲液中高压修复5 min。5%的BSA室温下孵育15 min,PBS稀释的一抗(FGF 1∶200,CTGF 1∶150,Collagen Ⅰ 1∶250),于37 ℃孵育2 h。PBS漂洗15 min。滴加生物素标记的二抗,37 ℃孵育30 min,PBS漂洗15 min。滴加链霉亲和素-过氧化物酶,37 ℃孵育30 min。PBS漂洗15 min。滴加DAB显色剂,苏木素复染,中性树胶封片,图片采用ImageJ软件进行半定量分析,检测灰度值。将白色与黑色之间按对数关系分成若干级,灰度值范围从0~255,白色为255,黑色为0,因此抗体表达越强,组织染色越深,灰度值越小[9]。然后采用灰度值计算光密度值(optical density,OD),OD=log(背景区灰度值/抗体阳性反应区灰度值)。
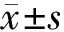
2 结果
2.1 二母散对大鼠肺纤维化模型肺脏指数的影响
结果见表1所列。与SC组相比,M组大鼠肺脏指数显著增加(P<0.01);与M组相比,EL组、EH组、PR组肺脏指数显著降低(P<0.01)。

表1 各组大鼠肺脏指数的比较Table 1 Comparison of lung index of rats in each group
2.2 二母散对大鼠肺纤维化模型肺组织HE染色病理分级的影响
结果见图1、表2。与SC组相比,M组HE染色病理分级显著增加(P<0.01);与M组相比,EL组HE染色病理分级明显降低(P<0.05),EH组、PR组HE染色病理分级显著降低(P<0.01)。

表2 各组肺组织HE染色病理分级的比较Table 2 Comparison of HE staining pathologicalgrading of lung in each group

图1 各组肺组织HE染色(×200)Fig.1 HE staining of lung tissue in each group (× 200)
2.3 二母散对大鼠肺纤维化模型肺组织FGF、CTGF和Collagen Ⅰ表达的影响
结果见表3及图2~图4。与SC组相比,M组肺组织细胞FGF表达显著增加(P<0.01);与M组相比;EL组、EH组肺组织细胞FGF表达未见显著性差异(P>0.05),PR组显著降低(P<0.05)。与SC组相比,M组肺组织细胞CTGF表达显著增加(P<0.01);与M组相比,EL组、EH组、PR组肺组织细胞CTGF表达显著降低(P<0.01)。与SC组相比,M组肺组织细胞Collagen Ⅰ 表达显著增加(P<0.01);与M组相比,EL组、EH组肺组织细胞Collagen Ⅰ 表达明显降低(P<0.05),PR组显著降低(P<0.01)。

表3 各组免疫组化染色肺组织细胞FGF、CTGF和Collagen Ⅰ表达的比较Table 3 Comparison of the expressions of FGF, CTGF and Collagen Ⅰ in immunohistochemical staining in lung of each group
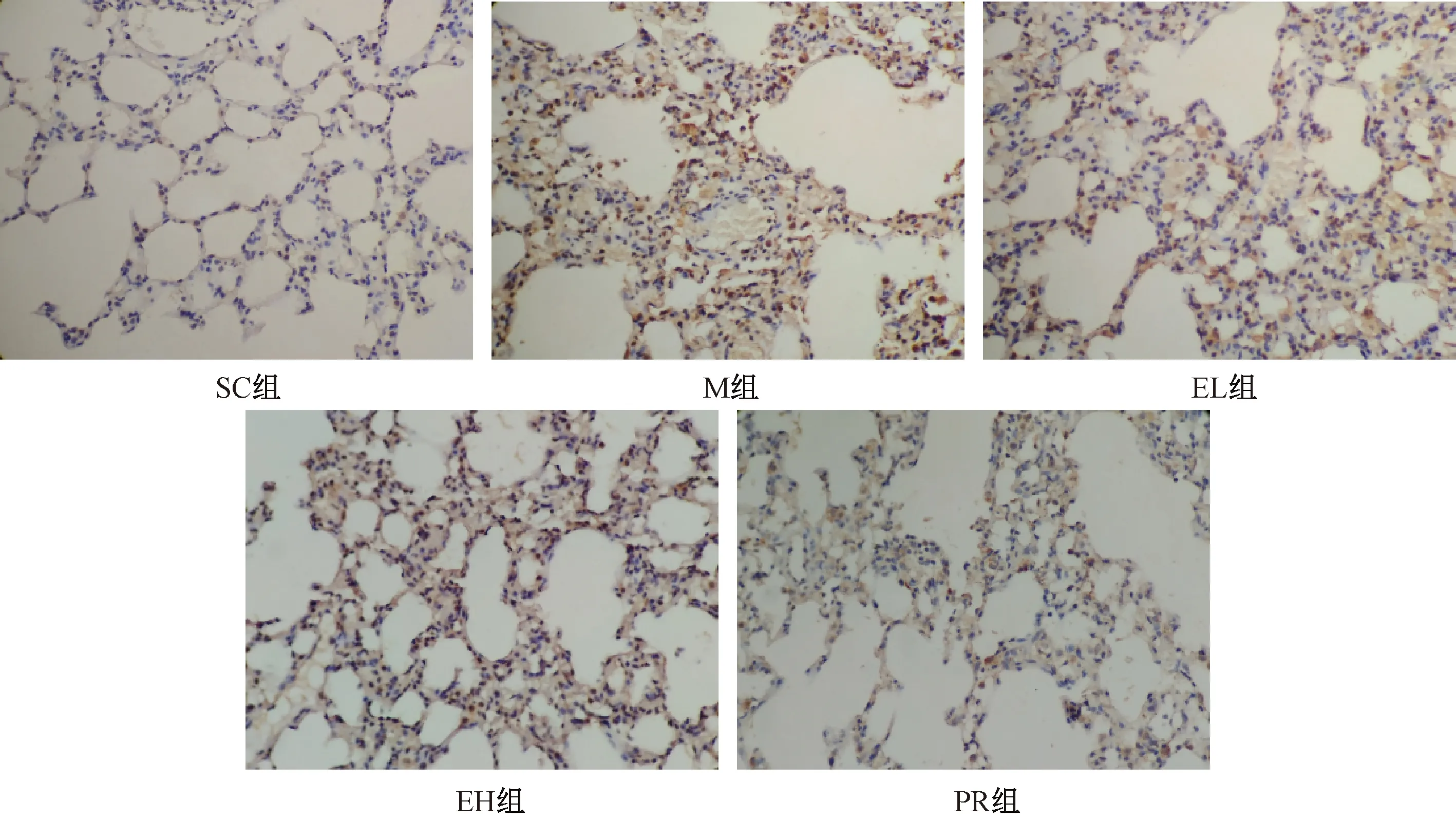
图2 二母散对大鼠肺纤维化模型肺组织FGF表达的影响(×200)Fig.2 The effect of Ermu Powder on the expression of FGF in lung (× 200)
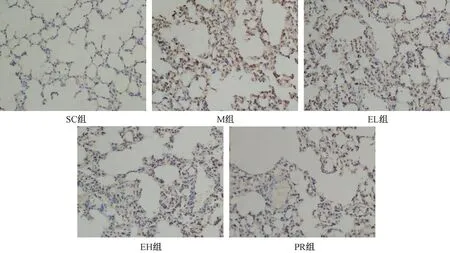
图3 二母散对大鼠肺纤维化模型肺组织CTGF表达的影响(×200)Fig.3 The effect of Ermu Powder on the expression of CTGF in lung (×200)
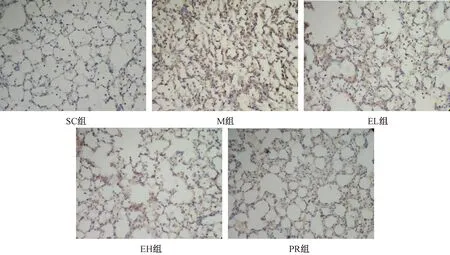
图4 二母散对大鼠肺纤维化模型肺组织免疫组化染色Collagen Ⅰ表达的影响(×200)Fig.4 The effect of Ermu Powder on the expression of Collagen Ⅰ in lung (×200)
2.4 EL组、EH组大鼠肺脏指数、FGF、CTGF及Collagen Ⅰ表达相关性分析
Pearson相关分析显示EL组和EH组大鼠肺脏指数与FGF表达之间不具有相关性(P>0.05);EL组和EH组大鼠肺脏指数与CTGF及Collagen Ⅰ表达之间具有相关性,呈正相关(P<0.05);EL组和EH组大鼠肺组织FGF表达与CTGF及Collagen Ⅰ表达之间不具有相关性(P>0.05);EL组和EH组大鼠肺组织CTGF表达与Collagen Ⅰ表达之间具有相关性,呈正相关(P<0.05),见表4~表6所列。

表4 EL组、EH组大鼠肺脏指数与FGF、CTGF和Collagen Ⅰ表达相关性分析Table 4 Correlation analysis of lung index and expressionof FGF, CTGF and Collagen Ⅰ in EL group and EH group
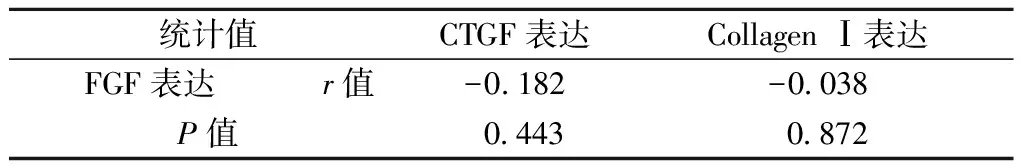
表5 EL组和EH组大鼠肺组织FGF表达与CTGF和Collagen Ⅰ表达相关性分析Table 5 Correlation analysis of the expression ofFGF and CTGF and Collagen Ⅰ in the lung tissuesof rats in EL and EH groups

表6 EL组和EH组大鼠肺组织CTGF表达与Collagen Ⅰ表达相关性分析Table 6 Correlation analysis of CTGF expression andCollagen Ⅰ expression in lung tissue of ELgroup and EH group
3 讨论
川贝母有清热润肺、化痰止咳以及散结消肿的功效,可用于肺虚久咳、燥热咳嗽等症状的治疗[10],现代药理研究表明贝母可降低博莱霉素致肺纤维化大鼠的MEK1/2、ERK1/2及其磷酸化水平[11],提高肺纤维化大鼠模型SOD、MDA及GSH的含量可能是其抗纤维化的作用机理。知母清热泻火、生津润燥。二母散由川贝母和知母组方而成,贝母和知母为治疗肺间质纤维化的临床常用药物[12]。
肺纤维化进程分为三个阶段,急性损伤阶段、炎症反应阶段和自我修复阶段[13],早期呈现急性肺损伤,肺泡内液体与血浆蛋白漏出,随时间推移肺内胶原蛋白引起肺组织纤维化[14]。本研究中治疗4周后与SC组相比,M组大鼠肺脏指数显著增加、病理分级显著增加;与M组相比,EL组、EH组肺脏指数显著降低、病理分级显著降低,根据肺脏指数与病理分级相关性分析结果可以得出炎症及纤维化反应越强肺脏指数越大,说明二母散可能通过减少肺泡内液体与血浆蛋白渗出,降低炎症及纤维化反应级别,进而产生降低肺脏指数的作用。
机体器官是由间质和实质两部分构成,间质主要起连接和机械支撑作用,由间质细胞和细胞外基质构成。细胞外基质还参与多种生理病理过程,在组织创伤后修复和纤维化过程中起重要的作用[15]。如果组织损伤较大超出了损伤实质细胞的再生能力时,间质纤维结缔组织将会大量增生进而对缺损组织进行修复,即发生纤维化的病理改变,引起器官的纤维化[16]。多种器官均可发生纤维化,其病理改变为实质细胞减少,并伴有组织内纤维结缔组织增多,可导致器官因结构破坏而功能减退。肺泡组织被炎症损伤后,其恢复为正常的肺组织还是产生纤维化取决于坏死的组织碎片能否被完全吸收[17],如果坏死的组织碎片不能被完全吸收就会被纤维组织取代。成纤维细胞是功能活动旺盛的细胞,具明显的蛋白质合成和分泌活动,在炎症损伤等刺激下,部分纤维细胞可重新转变为成纤维细胞,参与组织损伤后的修复[18]。FGF是参与肺纤维化的重要细胞因子具有广泛生物活性[19],FGF可以由巨噬细胞、内皮细胞分泌,它的作用是促进内皮细胞的游走,促进新血管形成,FGF被认为是病灶形成促进因子,FGF可增强TGF-β1诱导的肺成纤维细胞增殖,促进成纤维细胞增生和胶原纤维合成,促进肺组织的纤维化[20]。CTGF对成纤维细胞具有趋化及促有丝分裂作用,CTGF还具有促细胞增殖及分化等作用[21],CTGF与包括肺、肝、心脏、肾脏、胰腺等在内的许多组织器官纤维化发生发展密切相关[22]。肺组织在炎症损伤等刺激下,肺间质成纤维细胞被激活,转换为肌成纤维细胞,肌成纤维细胞可分泌细胞外基质,产生Collagen Ⅰ,促使Collagen Ⅰ合成增多,而Collagen Ⅰ是构成肺组织纤维的主要成分[23],Collagen Ⅰ是主要的细胞外基质,Collagen Ⅰ的过度沉积可导致不可逆肺纤维化进程,因此抑制Collagen Ⅰ合成,可有效降低肺纤维化的形成[24]。本研究表明与SC组相比,M组肺组织FGF、CTGF和Collagen Ⅰ表达显著增加;与M组相比,EL组、EH组FGF表达未见显著性差异,二母散组肺组织细胞CTGF和Collagen Ⅰ表达显著降低。说明二母散可能通过抑制CTGF和Collagen Ⅰ在模型肺组织的表达而产生抑制博来霉素诱导大鼠肺纤维化形成的作用,而与FGF表达无关。
综上所述,二母散可能通过抑制CTGF和Collagen Ⅰ在肺组织的表达,进而降低肺纤维化模型肺组织炎症及纤维化病理级别,最终产生抑制博来霉素诱导大鼠肺纤维化形成的作用。
