纳米炭混悬注射液用于乳腺癌光热治疗的研究
2021-06-06唐小海唐可欣黄源芳曾广富杨金梅杨胜韬
唐小海,唐可欣,黄源芳,曾广富,杨金梅,辛 倩,杨胜韬,3
(1.四川瀛瑞医药科技有限公司,四川 成都 610041;2.西南民族大学化学与环境学院,青藏高原污染控制化学与环境功能材料国家民委重点实验室,四川 成都 610041;3.西南民族大学化学与环境学院,化学基础国家民委重点实验室,四川 成都 610041)
光热治疗是通过光热转换剂将近红外光高效转化为热量实现治疗目的的方法[1].光热治疗是一种无损的治疗手段,副作用小,效率高,因此在肿瘤治疗中具有重要的应用前景[2].光热治疗研究的关键是发展更为高效安全的光热转换剂.理想的光热转换剂应该具有较大的吸收截面、较高的光热转换效率、良好的光热稳定性、较低的毒性和易于化学修饰等特点.目前,有机分子、高分子、纳米材料和金属有机框架等都被广泛用于光热转换剂,取得了重要的进展[3-6].
近年来,sp2杂化的碳纳米材料在光热治疗中展现了巨大的优势[7].碳纳米材料的sp2杂化区对近红外光有强吸收,并高效地将吸收的光能转化为热量.Lu等人用聚乙二醇修饰的碳纳米管实现了光学成像指导下的光热治疗,对原位胰腺癌具有很好的疗效[8].Li等制备了红细胞膜包覆的氧化石墨烯,实现了肿瘤内的阿霉素递送和光热治疗[9].Dong等利用竹炭纳米颗粒向肿瘤递送阿霉素,并进行光热治疗,获得了协同治疗效果[10].尽管实验室研究取得了重要进展,碳纳米材料尚未被用于临床光热治疗中,主要的难点有两个.首先,大多数材料均匀性较差,批次之间的差异显著,不能满足临床研究的需求[11].第二,碳纳米材料是新兴材料,其生物安全性尚未得到充分验证.
纳米炭混悬液(carbon nanoparticle suspension injection,CNSI,商品名卡纳琳)是目前唯一被临床应用的碳纳米药物,其主要功效是在瘤内注射后将肿瘤引流淋巴结染黑,有助于实现彻底的淋巴结清扫[12].CNSI在胃癌、乳腺癌、甲状腺癌等手术中效果良好,每年有超过10万例病人使用CNSI[13-15].长达十余年的临床应用和前期的实验室研究都证明CNSI具有良好的生物安全性.同时,CNSI的生产已形成了成熟的工艺,批次间的差异小,符合临床应用的要求.因此,CNSI很大程度上克服了其他碳纳米材料在光热治疗中难以临床应用的难题.前期研究中,笔者发现CNSI具有sp2杂化结构,对近红外光吸收显著,光热转换效率较高[16].初步研究表明,CNSI可以用于甲状腺癌的光热治疗,能显著抑制肿瘤体积增长.为了进一步推动CNSI光热治疗应用,需要测试CNSI对更多肿瘤模型的治疗效果,同时对提高生存率的效果进行评价.
本文以细胞和裸鼠为模型,评价CNSI光热转换杀死乳腺癌细胞的效果,并对荷瘤鼠的肿瘤组织进行病理观察,从而实现将CNSI用于乳腺癌肿瘤光热治疗的目的.
1 实验部分
1.1 试剂与材料
CNSI(浓度50 mg/mL)购自重庆莱美药业股份有限公司.聚乙烯吡咯烷酮K30(PVPK30)和枸橼酸三钠购自成都市科龙化工试剂厂.DMEM高糖培养基购自赛默飞世尔生物化学制品北京有限公司.胎牛血清和细胞消化液胰酶购自Gibco公司.纳米炭用透射电子显微镜(TEM,H-600IV,日本日立公司)、吸收光谱仪(U-4100,日本日立公司)和激光粒度仪(ZS90,英国马尔文公司)分析表征.
1.2 纳米炭分散液的体外光热实验
称取20 gPVPK30,加入适量0.9%氯化钠注射液溶解,并加枸橼酸钠调节pH值为7.0,再用0.9%氯化钠注射液定容至1 000 mL,得到pH值为7.0的PVP溶液.用PVP溶液稀释CNSI,得到10个不同浓度的CNSI溶液(1~5 000μg/ml).每个样品用称量瓶装1.0 mL,用近红外激光热疗仪照射一定时间(808 nm,连续激光,功率为100~3 000 mW/cm2),用TempSens测温器测量溶液的起始温度和激光照射后的温度,计算溶液上升的温度.
1.3 纳米炭光热治疗杀死癌细胞
收集对数生长期的MDA-MB-231乳腺癌细胞,调节细胞密度为3×104个/mL.分别取1 mL细胞悬液加入到25 mm×25 mm的称量瓶中,分为阴性组、激光照射1次(NIR 1)组、激光照射3次(NIR 3)组、CNSI组、CNSI+NIR 1组和CNSI+NIR 3组.阴性组和NIR组换上新的培养液,CNSI组和CNSI+NIR组换上含有CNSI的培养液(50μg/mL),孵育24 h.CNSI+NIR组用激光功率密度为0.67 W/cm2的激光分别照射至所需温度(48℃、50℃和52℃),并使温度分别维持1 min、2 min和5 min.照射完后,换成新培养液继续培养72 h,随后细胞用胰酶消化并计数.NIR组采用相同的照射条件,阴性组和CNSI组不进行照射.
1.4 纳米炭光热治疗荷瘤裸鼠
为了验证动物水平的肿瘤升温,取12只5~6周龄的裸鼠饲养观察一周,每只裸鼠右上肢皮下注射0.1 mLMDA-MB-231乳腺癌细胞悬液(2×106个细胞).当肿瘤大小达150~200 mm3时,将裸鼠分成2组(6只/组),即NIR 1组和CNSI+NIR 1组,其中CNSI+NIR 1组通过瘤内注射CNSI(50 mg/mL,50 μL/只).两组小鼠均用0.5 W/cm2的激光照射3 min,同时用红外热像仪(Fluke Ti400,USA)监测肿瘤温度变化.
另取60只裸鼠接种肿瘤,分为6组(10只/组):阴性组、NIR 1组、NIR 3组、CNSI组、CNSI+NIR 1组和CNSI+NIR 3组,其中CNSI+NIR 1组和CNSI+NIR 3组通过瘤内注射CNSI(50 mg/mL,50μL/只).每组中,8只用于观察肿瘤变化及裸鼠生存率,2只用于做病理学检查.激光功率密度设置为0.5 W/cm2,照射时间为3 min.记录裸鼠照射前后的肿瘤长、宽,计算肿瘤体积.每天观察肿瘤变化及裸鼠死亡情况,计算裸鼠生存率.治疗后48 h,取肿瘤及周围皮肤做病理学检查.
2 结果与讨论
2.1 纳米炭的表征
透射电镜下CNSI呈现为平均直径29 nm的小颗粒(图1),部分颗粒之间有团聚现象.动态光散射测定显示CNSI的水合粒径为189 nm.使用紫外-可见-近红外分光光度计检测发现,CNSI在近红外取有明显吸收,峰值位于972 nm处.考虑到生物组织在650~900 nm窗口的弱吸收,避免激光加热对正常组织造成损伤,后续实验均采用808 nm激光照射,该波长下CNSI同样具有一定吸光性.

图1 纳米炭的表征(a)TEM照片;(b)紫外-可见-近红外吸收曲线Fig.1 Characterization of CNSI(a)TEM image;(b)UV-vis-NIR spectrum
由图2可以看出,CNSI溶液在808 nm激光照射下迅速升温,而且照射功率越大升温越快.大约4 min后,各功率照射下的CNSI溶液温度达到平衡,功率越大溶液的平衡温度越高.激光功率密度为2 W/cm2和3 W/cm2时,溶液温度上升太快,溶液蒸发而大量减少,因此未照射足10 min.同时,在相同的功率条件下(0.5 W/cm2),CNSI溶液浓度越高,溶液的升温越快,平衡温度越高.由于肿瘤热消融温度阈值为50~55℃,因此选择功率密度为0.5 W/cm2进行后续试验.

图2 CNSI溶液在808 nm激光照射下的温度变化情况(a)不同功率;(b)不同CNSI浓度Fig.2 Temperature increases of CNSI under the irradiation of 808 nm(a)Different irradiation power;(b)Different CNSI concentrations
2.2 细胞水平的光热治疗
设定阴性组细胞存活率为100%,CNSI组细胞存活率为97.6±3.5%,与阴性组无显著性差异,说明CNSI没有明显的细胞毒性.在CNSI+NIR组不同温度的相同照射条件下,仅激光照射时,各组细胞存活率无明显区别(p>0.05),且照射1~5 min均无明显杀死作用(图3底部).CNSI+NIR组中(图3顶部),除45°C下维持1 min和3 min,其余各组均呈现显著性的杀死作用,MDA-MB-231细胞活力下降明显(p<0.05).随着维持温度的升高,CNSI+NIR组的治疗效果越好.在相同维持温度下,照射时间越长,CNSI+NIR组的治疗效果越好.这说明照射时间和升温幅度是影响CNSI+NIR组光热治疗效果的两个关键因素.
2.3 动物水平的光热治疗
将CNSI注射到肿瘤内同样具有光热转换的能力.从图4中可以看出,仅激光照射时肿瘤温度上升缓慢,照射结束时裸鼠肿瘤区域的平均温度为39.8±1.2℃,该温度不会对组织造成明显损伤.瘤内注射CNSI后再用激光照射肿瘤,肿瘤温度上升快速,照射0.5min时为43.8℃,1 min时温度即达到53.5℃,照射结束时裸鼠肿瘤区域的平均温度达到61.4±2.2℃.温度为50~60℃时细胞内的蛋白质变性、凝固,细胞死亡,而温度低于45℃时则呈现的是可逆性细胞损伤,仅有极少数细胞凋亡[17].CNSI+NIR组能将肿瘤加热至61.4℃,有望杀死肿瘤.

图3 细胞水平CNSI光热治疗杀死MDA-MB-231乳腺癌细胞Fig.3 Photothermal therapy of MDA-MB-231 breast cancer cells by CNSI under 808 nm irradiation
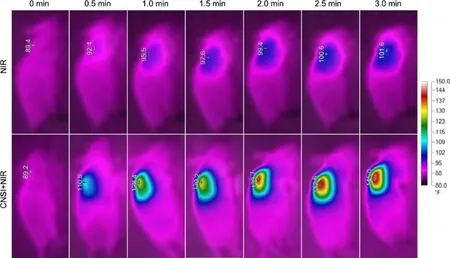
图4 808 nm激光照射不同时间后荷瘤鼠的红外热像图Fig.4 IR thermal images of tumor bearing mice under 808 nm irradiation
在光热治疗实验中CNSI+NIR 1组裸鼠肿瘤温度为59.4±3.8℃,而NIR 1组的温度仅为40.1±1.5℃.CNSI+NIR 3组照射结束时肿瘤温度分别为58.9±5.1℃、58.7±3.3℃和58.9±2.9℃;NIR3次温度分别为41.4±0.8℃、41.0±1.1℃、41.1±1.0℃.不同批次温度的差异源于实验误差,且波动幅度小于2℃,可以满足光热治疗需求.首次照射2天后,CNSI+NIR 1组和CNSI+NIR 3组的肿瘤全部消失,但CNSI+NIR在1周后出现复发.CNSI+NIR组有6只裸鼠肿瘤复发,分别出现在8天(3只)、10天(1只)和14天(2只).CNSI+NIR 3组仅只有1只在第19天肿瘤复发.NIR1组和NIR3组的肿瘤在照射结束的前2天停止生长,但第4天时肿瘤变大,随后持续生长.这表明激光照射后,有少量肿瘤细胞死亡.阴性组和CNSI组裸鼠肿瘤持续生长,肿瘤变大,说明CNSI无抗肿瘤活性,与文献报道的结果吻合.各组裸鼠肿瘤体积变化见图5.CNSI+NIR1组在治疗后2-6天时肿瘤体积为0,随着肿瘤的复发,肿瘤体积变大.CNSI+NIR3组在观察的14天内肿瘤体积为0.14天时,按照肿瘤体积计算的抑制率分别为:CNSI组5.0%,NIR 1组6.2%,NIR 3组16.4%,CNSI+NIR 1组69.6%,CNSI+NIR 3组100%.

图5 CNSI光热治疗对乳腺癌肿瘤的抑制(a)肿瘤体积;(b)生存率Fig.5 Inhibition of breast cancer tumor by photothermal therapy with CNSI(a)Tumor volume;(b)Survival rate
与阴性组相比,CNSI+NIR3组的生存率显著延长,到实验结束的60天时仍有50%裸鼠存活且无肿瘤复发.CNSI+NIR1组只有25%裸鼠存活,且死亡小鼠均为肿瘤复发.各组裸鼠的中位生存期分别为:阴性组26天(95%置信区间22~30)、CNSI组28天(95%置信区间24~32)、NIR1组25天(95%置信区间22~28)、NIR3组22天(95%置信区间15~29)、CNSI+NIR1组29天(95%置信区间18~40)和CNSI+NIR3组58天.除了CNSI+NIR 3组,其他各组的生存期无显著性差异,说明采用三次照射的方式有效抑制复发,延长了荷瘤鼠的生存期.
随后进行了肿瘤组织和相应位置皮肤的病理切片研究(图6).6组小鼠的皮肤均基本正常,表皮组织各层结构正常,真皮中仅可见少量炎性细胞浸润.瘤内注射后,CNSI主要分布在肿瘤癌灶间隙中.经激光照射后,光热效应导致肿瘤组织固缩,CNSI沿细胞间隙分布.阴性组、CNSI组、NIR1组和NIR3组肿瘤组织仅有少量局灶性坏死和炎性细胞浸润.CNSI+NIR1组中肿瘤组织广泛坏死,细胞核固缩,胞浆蛋白降解,坏死区伴炎性细胞浸润;CNSI+NIR3组中肿瘤组织细胞坏死,细胞结构消失,可见炎性细胞浸润,组织中有空泡形成.组织病理学研究证明了CNSI光热治疗的有效性.

图6 肿瘤组织的病理学切片(a)CNSI组;(b)CNSI+NIR 1组;(c)CNSI+NIR 3组;(d)CNSI组;(e)CNSI+NIR 1组;(f)CNSI+NIR 3组;(g)阴性组;(h)NIR 1组;(i)NIR 3组Fig.6 Histopathological observations of tumor tissues(a)CNSI;(b)CNSI+NIR 1;(c)CNSI+NIR 3;(d)CNSI;(e)CNSI+NIR 1;(f)CNSI+NIR 3;(g)control;(h)NIR 1;(i)NIR 3
3 结论
本论文评价了CNSI用于光热治疗杀死乳腺癌细胞的效果,发现CNSI在近红外光照射下能将光能转化为热量,引起溶液、细胞和肿瘤组织温度升高,从而将乳腺癌细胞杀死.CNSI注射后3次激光照射肿瘤能有效抑制肿瘤复发,大幅提高观察期内的生存率.瘤内注射后CNSI聚集在肿瘤细胞周围,光热治疗将肿瘤组织微观结构破坏,因此具有良好的光热治疗效果.作为一个临床应用十余年的纳米药物,CNSI可以通过超适应症用药(off label use)进入临床使用,从而推动纳米光热治疗的应用和发展.此外,CNSI的药物递送、示踪成像、降低辐射伤害等功能有望将其发展为一个多功能、多用途的诊断治疗平台[18-21].
