烟草bZIP基因家族的鉴定及其在不同成熟度烟叶中的表达分析
2021-06-05杨佳翰张炳辉顾钢杨玄松秦明月谢小芳
杨佳翰,张炳辉,顾钢,杨玄松,秦明月,谢小芳*
1 福建农林大学生命科学学院,福州 350002;
2 福建省烟草专卖局烟草科学研究所,福州 350003;
3 福建省作物设计育种重点实验室,福州 350003
转录因子是一类重要的调控蛋白,它能与特定DNA序列(顺式作用元件)结合,从而激活或抑制特定基因的转录表达[1]。碱性亮氨酸拉链转录因子(Basic region/leucine zipper,bZIP)是真核生物中广泛存在的一个重要基因家族[2]。bZIP转录因子具有一个长度约为60~80个氨基酸的保守bZIP结构域,该结构域由碱性区和亮氨酸拉链区组成[3],其中,碱性区高度保守,长约16个氨基酸,包含一个核定位信号和一个识别并结合启动子特定核酸序列的保守N-X7-R/K基序;亮氨酸拉链区的保守性较低,靠近碱基区的C端,它由多个七肽重复序列组成,每七个氨基酸的第七位含有一个亮氨酸,亮氨酸具有被其他疏水性氨基酸所取代的特性,如异亮氨酸、缬氨酸、蛋氨酸等。该区域通过两个bZIP转录因子之间的疏水力缠结形成同源或异源二聚体疏水性氨基酸,参与bZIP蛋白与DNA结合前的二聚反应。
迄今为止,已有许多真核生物的bZIP基因家族成员在全基因组范围内被成功鉴定。例如:拟南芥(75个)[4],水稻(89个)[3],玉米(125个)[5],蓖麻豆(100个)[6],苹果(114个)[7],甘薯(41个)[8],番茄(69个)[9]和大豆(131个)[10]等植物。已有研究表明:bZIP转录因子参与种子萌发过程、幼苗的产生和形成、花芽分化和花器诱导等[11-13]。与此同时,bZIP转录因子广泛参与了盐胁迫,干旱胁迫,冷胁迫等非生物胁迫响应和生物胁迫防御等生物学过程。例如,拟南芥AtbZIP17对盐胁迫响应明显,可以直接或间接地激活盐胁迫应答基因的表达,对提高植物的耐盐性具有重要作用[14];在水稻中,干旱处理下OsbZIP20和OsABA45的表达都大幅上调,过表达OsbZIP71可显著提高水稻的抗旱性[15-16];在低温胁迫中,Liu等[17]在水稻中鉴定出8 个与苗期低温抗性相关的bZIP 基因(OsbZIP08、OsbZIP35、OsbZIP38、OsbZIP46、OsbZIP63、OsbZIP72、OsbZIP73和OsbZIP76);此外,小麦TabZIP1[18],辣椒CabZIP1等基因参与了病原菌侵染的防御响应[19-20]。在烟草中,Kusano等鉴定了一个受低温诱导的bZIP基因(tbz17)[21],Yang等[22]研究发现tbz17及其家族成员tbzF与烟叶的衰老紧密相关,这两个基因在衰老的烟叶中大量表达,其转录本主要位于衰老叶片中的保卫细胞和微管组织中。另外,Kuhlmann等[23]发现烟草bZIP 转录因子BZI-1在烟草的病原防御响应和生长素介导的信号转导中具有重要作用。
烟草是我国的重要经济作物之一。烟草收获的主要器官是烟叶,因此叶片的生长发育、叶色转换等非常重要。烟叶的成熟衰老常常被当作一种逆境,其实质是各类细胞的程序性死亡,从而适应外界环境改变带来的生存胁迫,在基因调控下细胞自主选择终结生命历程的过程[24-25]。一些转录因子会激活或抑制逆境基因的表达,从而影响植物的抗逆性和生长发育[26-29]。大量研究证明:bZIPs家族广泛参与植物的生长发育、果实成熟和颜色转化、植物正常衰老过程和逆境胁迫响应[23,30],因此,在烟草中系统研究bZIP转录因子对研究烟叶的生长发育成熟具有重要意义。本研究拟通过生物信息学方法在全基因组范围内对烟草bZIP转录因子家族成员进行系统分析,结合不同成熟度烟叶的转录组数据,探究该家族成员在不同成熟度烟叶中的表达情况,研究结果将为相关bZIP转录因子的功能研究提供参考。
1 材料和方法
1.1 烟草bZIP基因家族成员的鉴定和理化性质预测
从拟南芥公共资源TAIR(http://www.arabidopsis.org/)中下载拟南芥75个bZIP基因的蛋白质序列[4],以拟南芥bZIP的蛋白质序列作为母序列,利用blast程序在茄科植物基因组数据库(https://solgenomics.net/)搜索烟草的bZIP候选蛋白序列,将相似度≥30%,并且E值≤-10的序列确定为最初的候选蛋白。进一步利用NCBI(https://www.ncbi.nlm.nih.gov/)的CDD程序分析烟草bZIP候选蛋白序列的结构域。将包含bZIP转录家族特有保守结构域的序列确定为最终的候选蛋白,利用ExPASy软件(https://www.expasy.org)对烟草bZIP候选蛋白相关的理化性质进行预测分析,将对应的基因号,基因的染色体定位信息和蛋白质信息构建列表。
1.2 烟草bZIP基因进化分析
运用Clustal X软件[31]对最终确认的候选bZIP蛋白序列进行多序列比对,运用软件MEGA-X[32]构建烟草bZIP蛋白家族的进化树,使用的算法为邻接法(Neighbor-joining model;NJ),Bootstrap值设定为1000。
1.3 烟草bZIP基因结构和蛋白结构域分析
利用Edwards等人发布的普通烟草K326的基因组数据库(2017)(https://solgenomics.net/organism/Nicotiana_tabacum/genome),下载烟草bZIP基因结构的相关信息文件(包括GFF 文件、核酸序列文件以及蛋白序列文件),利用在线的软件工具Gene
Structure Display Server(GSDS)(http://gsds.cbi.pku.edu.cn/)[33]分析烟草bZIP基因外显子/内含子(intron/exon)的分布情况并绘制基因结构图。利用软件DNAman 6.0(Lynnon Biosoft,Quebec,Canada)对烟草bZIP家族成员的bZIP保守域氨基酸组成进行可视化分析,默认参数。进一步通过MEME(http://meme-suite.org/tools/meme)[34]在 线工具分析烟草bZIP蛋白的保守基序(motif),设置参数为:20个motif,最小和最大长度分别设定为5和200 bp。
1.4 不同成熟度烟叶bZIP基因的表达分析
以福建三明尤溪大田生长的普通烟草品种翠碧一号的中部叶(从下往上数8~10叶位)为材料,在同一田块且种植间隔7天的两批植株中选择长势相对均匀一致的烟株,由三位熟悉烟叶成熟度判定的专业人员根据叶色,叶脉和绒毛等外观特征[35]共同衡量后,在同一时间段分别采收5个成熟度(M1、M2、M3、M4和M5)的叶样。每3个叶片为一个样品,3个生物学重复。采用打孔器沿着叶片主脉均匀打孔取样,迅速置于-80℃液氮保存备用。采用百泰克植物总RNA提取试剂盒(离心柱型)分别提取各档成熟度烟叶样品总RNA。采用Illumina HiSeqTM 2000平台开展烟叶样品转录组测序分析,其中,文库构建和测序工作由百迈克生物科技有限公司完成,利用基因的FPKM值衡量基因表达水平[36]。从转录组数据中获得烟草bZIP家族各成员的FPKM值(log2转换),利用R语言gplots包的heatmap功能[37]绘制不同成熟度烟叶的bZIP基因表达热图。采用SYBR Premix Ex Taq(Takara)两步法进行qRT-PCR测定,分析烟草部分bZIP基因成员在不同成熟度烟叶中的表达情况,qRT-PCR扩增引物序列和烟草Actin内参基因引物见表1。每个样品3次技术重复和3次生物学重复。相对表达水平衡量采用2-△△Ct方法[38],以M1成熟度的基因表达量为参照,计算bZIP基因家族成员在不同成熟度烟叶中的相对表达量,根据 3次生物学重复结果计算标准差。
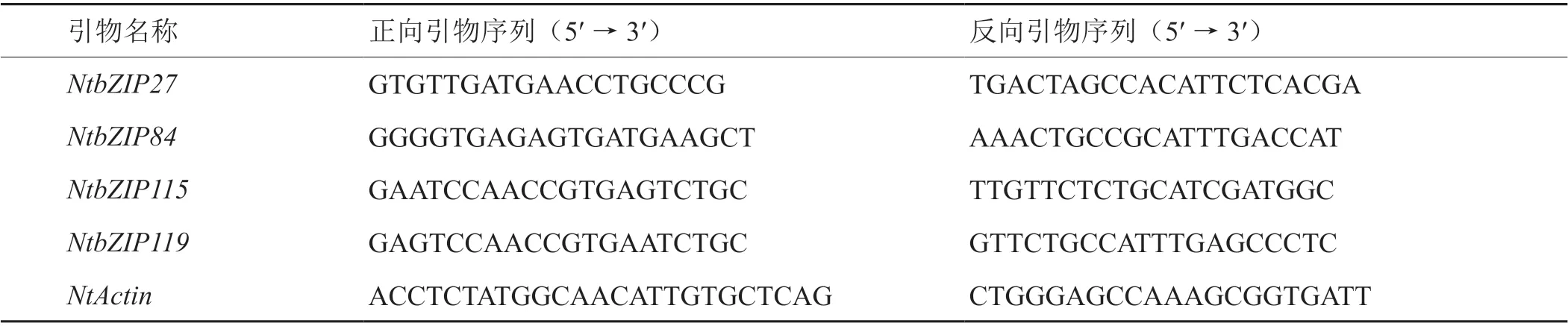
表1 烟草NtbZIP基因qRT-PCR分析特异引物Tab. 1 NtbZIP gene-specific primers of tobacco used for qRT-PCR analysis
2 结果与分析
2.1 烟草bZIP基因家族成员理化性质及其染色体定位
通过相似性搜索和结构域判定,在烟草中共鉴定出126个bZIP基因,依次重新编号命名为NtbZIP1~NtbZIP126,基因的具体信息列于表2,包括基因的ID,物理位置,外显子数目,蛋白长度、分子量和等电点等。由表2可知:烟草NtbZIP基因的外显子数目、蛋白长度和分子量等差异较大。其中,NtbZIPs外显子数目最小的仅为1,最大达到13个,含有1个和4个外显子的基因数量最多,分别达到26和33个;编码蛋白质长度最大达812 aa(NtbZIP22),最小仅为112 aa(NtbZIP117);相对分子质量最小为12913.63 Da(NtbZIP117),最 大 的 为87319.33(NtbZIP22);理 论 等 电 点在5.03(NtbZIP123)~9.79(NtbZIP6)之间。染色体定位结果显示,126 个NtbZIP基因中有58个NtbZIP定位于染色体中,且基因在各染色体上的分布不均匀,其中第19号和第24号染色体最多,各含7个NtbZIP基因,而第8、14、18和20号染色体上未发现NtbZIP基因。另外的68个NtbZIP基因定位到Scafford上,目前尚无法确定这些基因在染色体上的具体位置。

表2 烟草bZIP基因家族成员信息Tab. 2 The characters of bZIP gene family members of Nicotiana tabacum
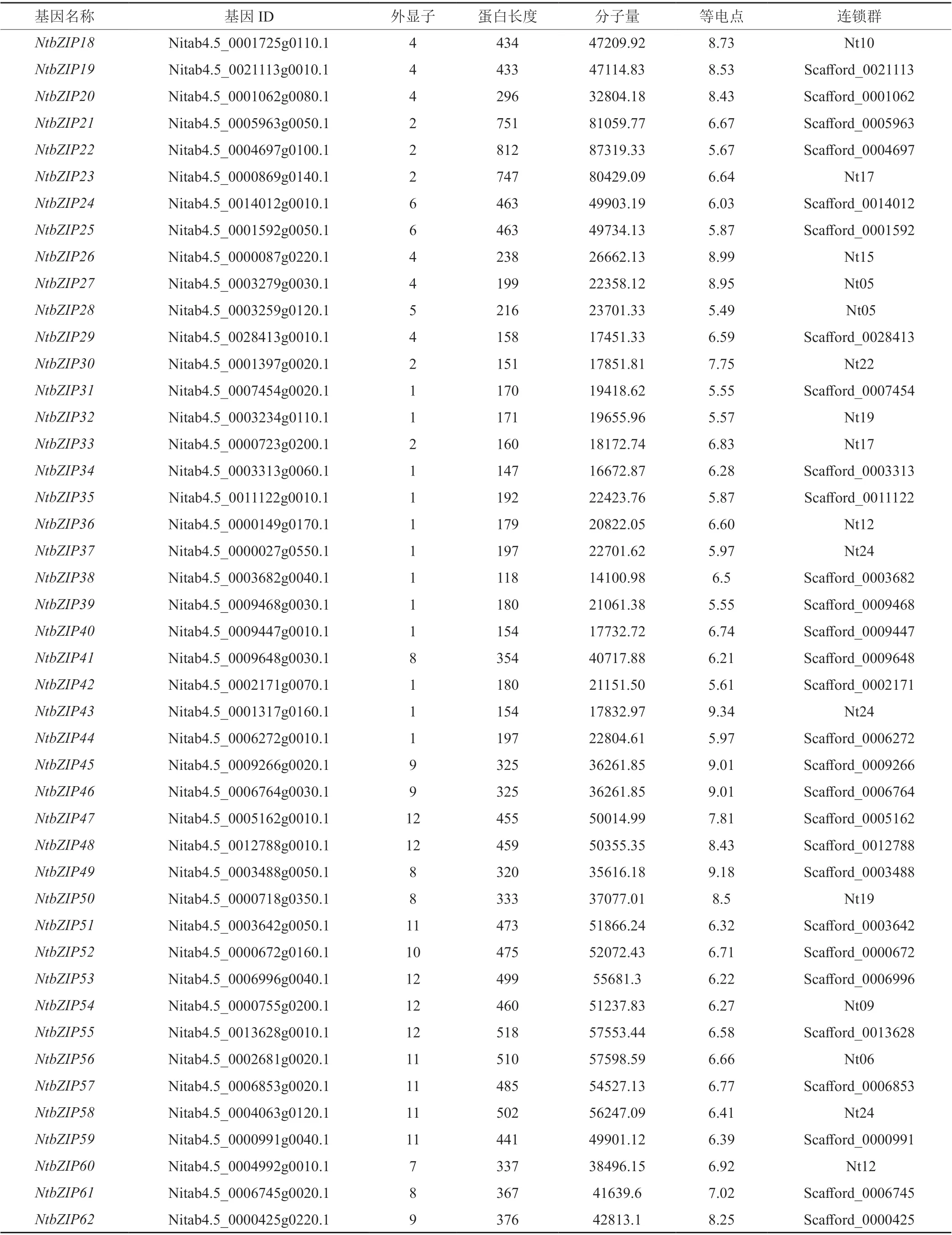
表2(续1)
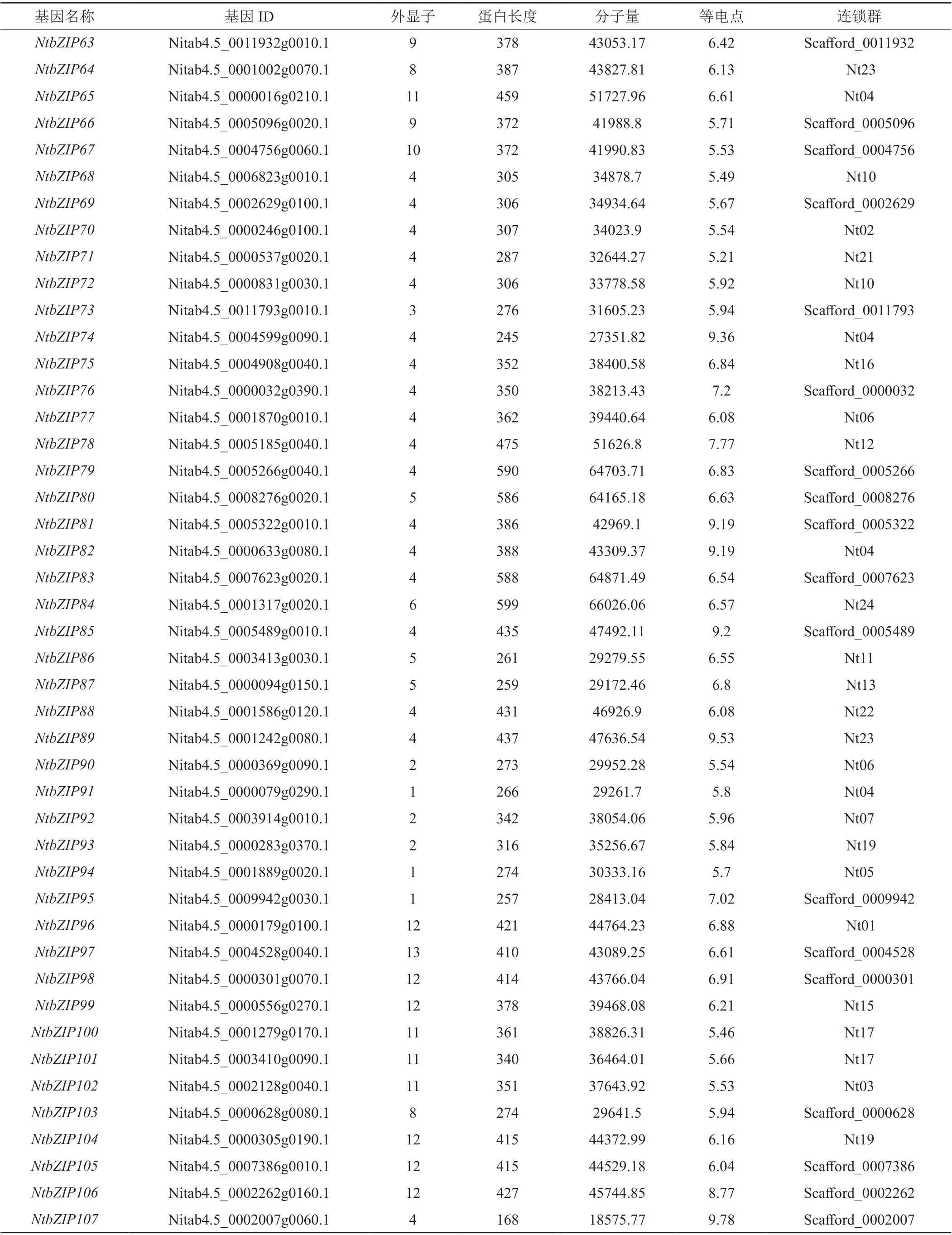
表2(续2)
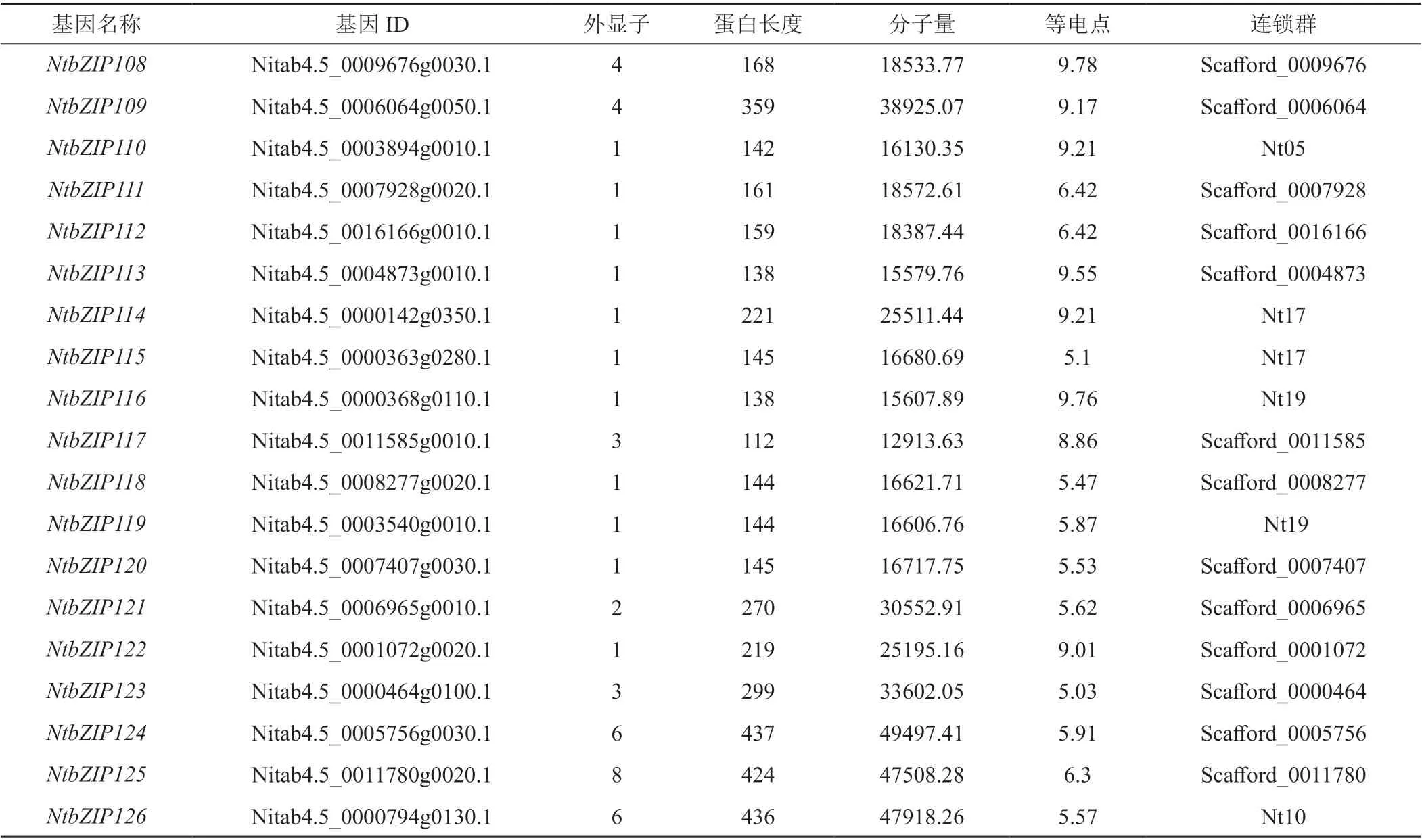
表2(续3)
2.2 烟草bZIP基因的结构与进化
利用126个NtbZIPs基因的蛋白序列构建系统进化树,结果发现(图1a):烟草的bZIP基因家族可分为11个亚族(bootstrap≥80%),分别为A、B、C、D、E、F、G、H、I、J和S亚族,其中,由于bootstrap值太低,NtbZIP123未能归到任何一个亚族。在11个亚族中,S是最大的亚族,包含28个成员。与此同时,D、A、I和G的成员也较多,分别含有23,20,17和11个成员,这5个亚族成员的总和为NtbZIP家族成员总数的78.6%。此外,B亚族的成员最少,仅有2个,亚族J和H也仅含有3个成员。基因结构分析表明(图1b):NtbZIP基因序列的长度、内含子/外显子的数量和分布差异较大。综合结构和进化分析结果(图1)可以发现:在同一亚族中的大多数成员具有相似的基因结构。例如:在最大的S亚族成员中,大多数基因的长度较短,在28个成员中有23个仅含有1个外显子,占该亚族总数的82.1%;而在D亚族中,NtbZIP家族成员的基因长度较大,外显子数目较多(7-12个)。由此可以推测:该家族基因的结构与进化关系密切,家族成员的扩张与内含子的插入或缺失有关。
2.3 烟草bZIP蛋白保守结构
为分析烟草bZIP家族成员蛋白的结构域组成,进一步利用DNAman软件对126个NtbZIP蛋白中的结构域进行多序列比对分析,并将其可视化(图2)。结果发现:烟草bZIP结构域非常保守,在其N端都含有一个碱性区域(N-X7-R/K),随后具有保守的RK或KK以及亮氨酸拉链区域,该结构参与形成bZIP蛋白与 DNA 结合之前的二聚体化过程,此外,发现部分亮氨酸被其他疏水残基(异亮氨酸、缬氨酸核甲硫氨酸等)取代的现象,该结果与前人的研究一致[4, 39]。

图2 烟草bZIP家族蛋白保守结构域序列比对Fig.2 Alignment of conserved domain of the bZIP family proteins in Nicotiana tabacum
利用在线工具MEME分析NtbZIPs基因的蛋白序列中Motif组成的多样性,结果表明(图3):在126条烟草的bZIP蛋白序列中共鉴定出20个Motif(表3),同一亚族的成员大多含有相同的基序组成和排列顺序。例如:D亚族成员都含有Motif1、Motif6、Motif2、Motif5、Motif15和Motif3;E亚族和I亚族,大多数成员含有Motif1和Motif4,该结果与基因结构的分析情况(图1)一致。与此同时,不同亚族中的蛋白序列Motif组成和分布存在较大差异,有些Motif只出现在特定的亚族中,例如Motif2、Motif3和Motif5只出现在D亚族中,Motif13和Motif7只出现在F亚族中,Motif12和Motif17只存在于A亚族,Motif9只存在于I亚族;而一些基序是几个亚家族共有的,例如:Motif4存在于E和I亚族,Motif18存在于A、G和I亚族等。由这些结果可以推测:NtbZIPs基因在进化过程中出现了功能分化。
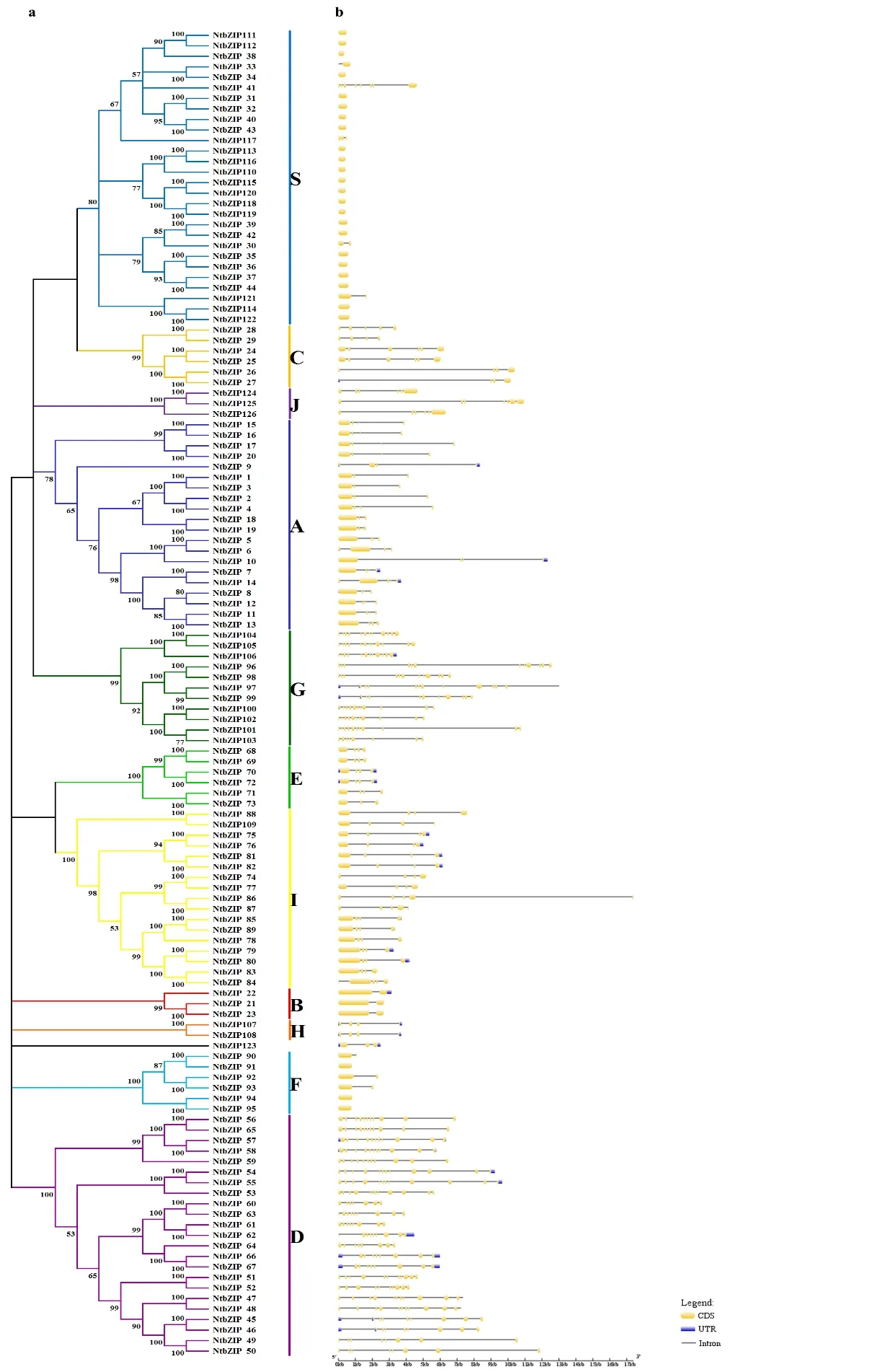
图1 烟草bZIP家族基因结构与进化Fig. 1 Gene structure and evolution of bZIP family in Nicotiana tabacum

表3 烟草bZIP蛋白的20个预测保守基序Tab. 3 Sequences of 20 predicted motifs of NtbZIP proteins
进一步利用CDD对20个基序进行鉴定,其中,Motif1注释为bZIP结构域组成部分,在126条NtbZIPs蛋白中,除NtbZIP38和NtbZIP124外,其余124条蛋白序列均含有Motif1。此外,Motif2注释为DOG1结构域组成部分,该结构域与种子的休眠有关[40-41]。Motif16被注释为MFMR结构域,Motif10被注释为bZIP_C结构域的组成部分。
2.4 烟草bZIP基因家族的系统进化分析
为了探究烟草bZIP转录因子的进化历程,整合126条烟草的bZIP蛋白序列和75条拟南芥的bZIP蛋白序列构建系统发育树,并对照Jakoby 等在拟南芥的分组规则分类[4],将bZIP蛋白共聚成11个分支(图4),每个分支中都含有烟草和拟南芥的bZIP成员,而且每个亚族基因数量分布比例相似,说明这两个物种的bZIP 转录因子家族成员并未因物种差异而单独聚类。在这11个分支中,S分支是含有成员最多的亚族,共有43个的成员,其中烟草28个,拟南芥15个,而H包括的bZIP成员最少(5个),其中烟草2个,拟南芥3个。与拟南芥相比[4],本研究新增加的一个亚族J,该亚族共有6个成员,包括烟草3个成员和拟南芥3个成员。除J亚族外,拟南芥bZIP的聚类与前人研究结果基本一致,只有少数成员在聚类中分到不同的分支,说明bZIP基因家族在进化上相对保守。在整个系统发育树中共发现 77对同源姐妹对,其中4对为直系同源蛋白,73对为旁系同源蛋白(烟草53 对,拟南芥20对),由此可见,烟草的旁系同源蛋白数目是拟南芥的两倍多,该结果可能是由于普通烟草源于绒毛烟草和林烟草的染色体加倍进化而来,因此存在大量的相似序列。
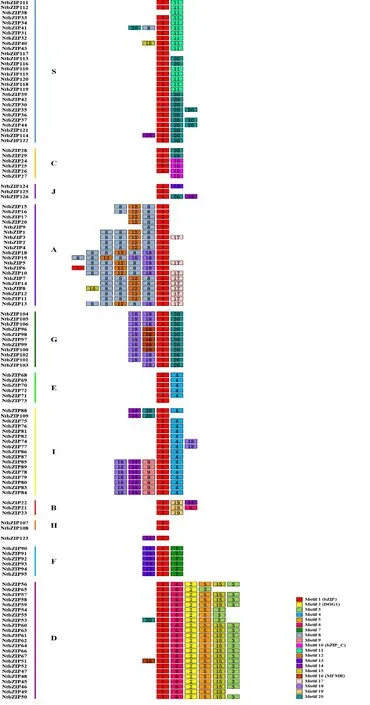
图 3 bZIP蛋白质保守基序组成与分布Fig. 3 Conserved motifs for bZIP proteins in Nicotiana tabacum
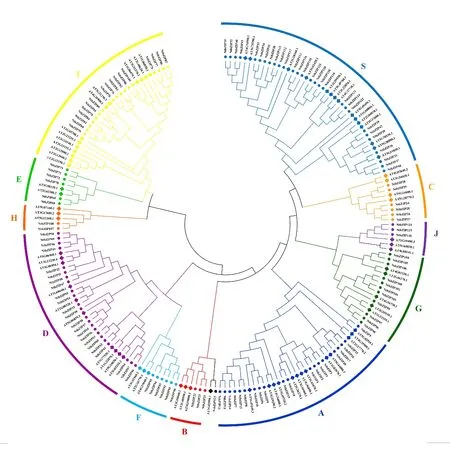
图4 烟草与拟南芥bZIP基因家族系统进化分析Fig. 4 Phylogenetic analysis of Nicotiana tabacum and Arabidopsis thaliana bZIP genes
2.5 不同成熟度烟叶中NtbZIP基因的表达情况
为分析NtbZIPs在不同成熟度烟叶中的表达变化,本研究采集了5个成熟度(M1-M5)烟叶。从5档成熟度烟叶的转录组数据中获取NtbZIPs基因的表达值,剔除部分未表达或低表达的基因(PFKM<0.5),进一步绘制NtbZIPs基因(77个)的表达热图。由图5可知:不同NtbZIP基因的表达量差异较大,其中,分支Ⅲ中的27个NtbZIP基因在5个成熟期表达量较低,而分支Ⅱ的10个NtbZIP基因表达量较高,包 括NtbZIP82,NtbZIP27,NtbZIP111,NtbZIP76,
NtbZIP32,NtbZIP120,NtbZIP115,NtbZIP119,NtbZIP123和NtbZIP31等基因。值得注意的是:NtbZIP84,NtbZIP120,NtbZIP119和NtbZIP115等基因的表达量随着成熟度的提高呈现规律性下降趋势。这些结果暗示了烟草NtbZIP家族成员间在功能上可能具有多样性。
进一步挑选表达变化比较明显的NtbZIP27,NtbZIP84,NtbZIP115和NtbZIP119等4个 基 因 开展RT-PCR验证,由结果可知(图6):NtbZIP27基因在M1-M4等4个成熟期的表达变化不大,在M5成熟期表达量下降近5倍。与M1成熟期相比,NtbZIP84,NtbZIP115和NtbZIP119等基因的表达随着成熟度的提高呈现明显下降趋势,这3个基因在M1和M5成熟期的表达量差异近10倍。此外,随着烟叶成熟度提高,这4个NtbZIP基因的表达在qRTPCR分析(图6)和转录组测序分析(图5)中表现出类似的变化趋势,说明转录组测序结果较可靠。
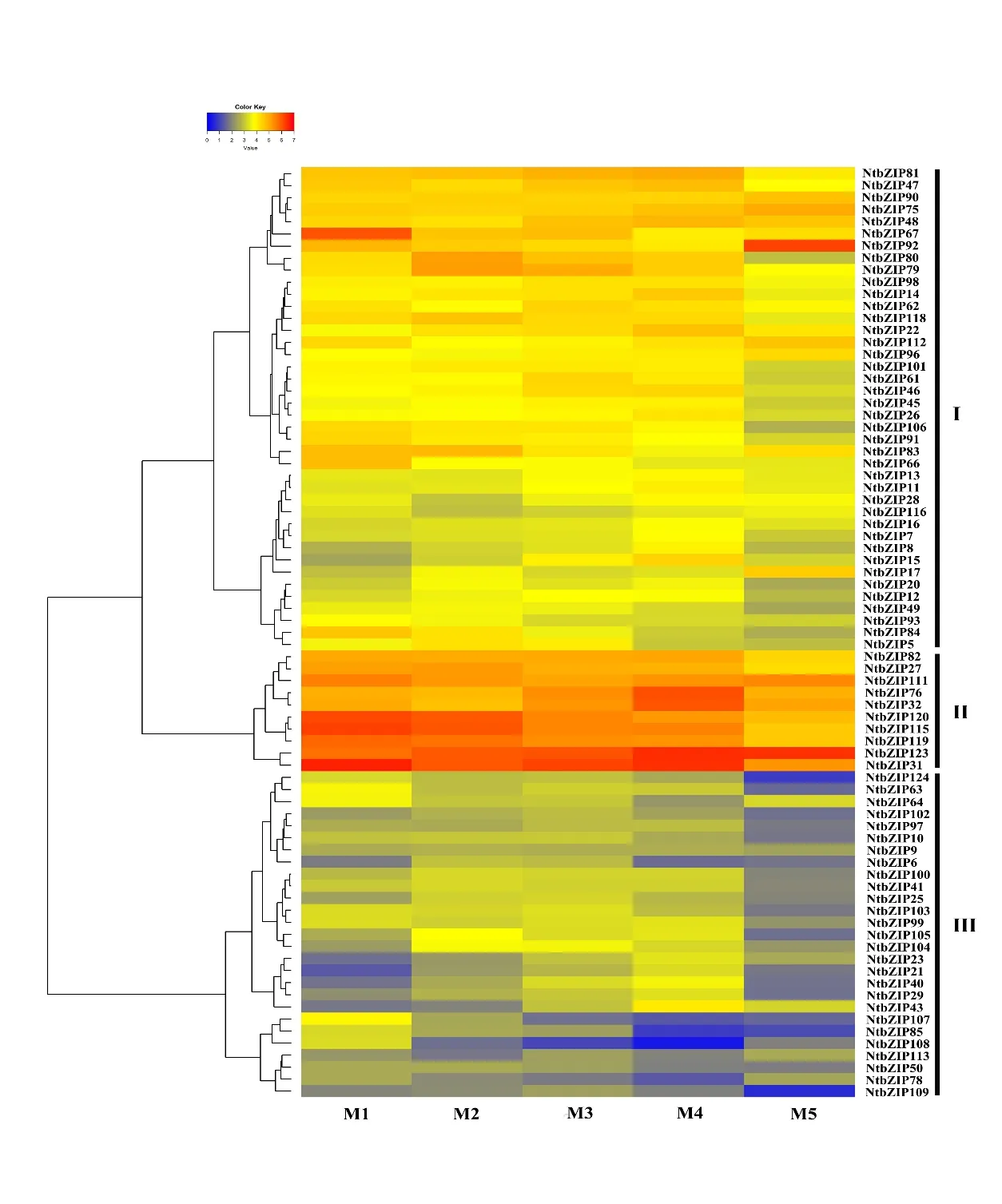
图5 NtbZIPs基因在不同成熟度烟叶中的表达情况Fig. 5 The expression of NtbZIPs in tobacco leaves at different stage of maturity
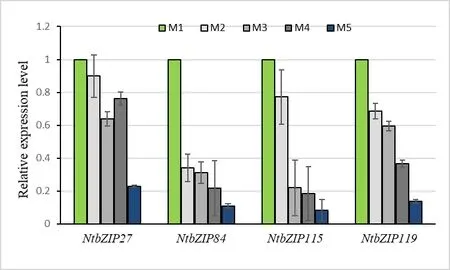
图6 NtbZIPs基因在不同成熟度烟叶中的表达情况Fig. 6 Relative expression level of 4 NtbZIPs in tobacco leaves at different stage of maturity
3 讨论
在全基因组测序完成的前提下,全基因组范围内的基因鉴定为基因功能研究提供了一条便捷有效的途径。bZIP转录因子是真核生物中普遍存在的一个大基因家族,许多物种在全基因组水平上开展了bZIP基因家族的鉴定。本研究对烟草中bZIP基因家族的成员进行了全基因组水平上鉴定和分析,最终获得了126个NtbZIP基因。由于烟草基因组主要通过基因富集区测序获得,且其全基因组测序尚未完成,可能存在未被鉴定的NtbZIP基因。因此,烟草中实际存在的bZIP将超过本研究鉴定的126个。显然,烟草中bZIP基因数量高于拟南芥(75个)[4],水稻(89个)[3],甘薯(41个)[8]和番茄(69个)[9]等物种中的bZIP基因数量,该结果主要源于普通烟草是异源四倍体,其存在两套异源基因组,分别来自于S基因组供体林烟草和T 基因组供体绒毛烟草两个祖先种,大约在 20 万年前经过一次种间杂交产生[42]。因此,在本研究鉴定的126个bZIP基因中存在大量的旁系同源基因(53对)。研究表明,基因倍增后,最初的结果是出现两个完全相同的基因,在选择压作用下,其中一个基因保持原有的功能,而另一个基因更容易产生突变积累,从而变成假基因或产生新的功能[43]。因此,多倍化可能是产生新基因的主要途径,这可能是导致烟草中bZIP基因扩张的重要原因。
基因的表达模式是基因功能的重要体现。已有的研究表明,bZIPs家族广泛参与植物的生长发育、颜色转化和植株的正常衰老过程[30]。本研究中不同成熟期烟叶NtbZIPs基因的表达分析发现:NtbZIPs基因在不同成熟度中广泛表达,而且大多NtbZIPs基因在烟叶的不同成熟期表现出差异性表达,其中NtbZIP84,NtbZIP115,NtbZIP119和NtbZIP120等基因表达量较高,且随成熟度提高表现出规律性变化下降趋势,暗示这些基因随着烟叶成熟度的提高,物质转化和降解的完成,表达量逐渐下降。与此同时,部分基因随着成熟度提高表达量呈现上升趋势(NtbZIP123),前人研究中也发现类似现象,例如Yang等[22]研究发现:烟草bZIP家族成员tbzF和tbz17基因的表达量与烟叶中的叶绿素含量呈负相关。此外,在不同成熟度NtbZIP基因表达的分析发现(图5):分支Ⅱ的10个NtbZIP基因表达量很高,值得注意的是:这10个基因中,除了NtbZIP82,NtbZIP27和NtbZIP123外,其余7个均分布在S亚族中(图1),暗示该亚族中的这些基因可能在不同成熟度中烟叶中发挥重要作用,并且可能具有类似的功能,但具体生物学功能还需要进一步的验证。
通常认为,聚类中关系越密切则其相似性就越大,因此,聚在同一亚族中的基因在结构与功能上往往有一定的相似性。已有研究表明:拟南芥中的AT2G35530基因主要通过调控光、GA及 ABA等基因的应答[44];拟南芥中的 AT5G06950与AT5G06960为bZIP转录因子家族的 TGA 亚族,参与拟南芥的抗逆调控[45-46]。因此,我们推测在系统树G亚族中(图4)与拟南芥AT2G35530聚类距离较近的NtbZIP96,NtbZIP97,NtbZIP98和NtbZIP99等基因可能参与调控光、GA与ABA激素的代谢;D亚族中与拟南芥AT5G06950和AT5G06960聚类距离较近的NtbZIP45,NtbZIP46,NtbZIP49和NtbZIP50等基因可能在逆境响应中发挥作用,具体有待进一步的实验验证。本文所提供的NtbZIPs基因的表达和进化信息,可为NtbZIPs基因的进一步功能研究奠定基础。
4 结论
本研究在烟草基因组中共鉴定了126个NtbZIP基因。NtbZIP成员基因结构多样,蛋白质长度差异较大,共分为11个亚族。进化分析显示NtbZIP基因分化的时间早于拟南芥与烟草分化的时间,异源四倍体的普通烟草中存在大量的NtbZIP旁系同源基因对(53对)。本研究中NtbZIPs在不同成熟度烟叶中广泛表达,其中NtbZIP84,NtbZIP115,NtbZIP119和NtbZIP120等基因表达量随成熟度提高而逐渐降低。系统分析基因家族各成员的序列特征、进化关系和表达模式等可为基因的功能研究提供指导。
