饲粮氯化胆碱含量对湖羊瘤胃菌群和血浆氧化三甲胺含量的影响
2021-06-05梅士俊毛胜勇
周 阳 梅士俊 毛胜勇,2 金 巍,2*
(1.国家动物消化道营养国际联合研究中心,江苏省消化道营养与动物健康重点实验室,南京农业大学消化道微生物研究室,南京 210095;2.南京农业大学动物科学类国家级实验教学中心,南京 210095)
反刍动物的饲粮含有丰富的胆碱,研究已经证实胆碱在瘤胃中能够被微生物快速降解,生成三甲胺,能够到达小肠的饲粮源胆碱很少[5-6]。目前,关于饲粮胆碱含量对瘤胃微生物和血浆TMAO含量的影响还鲜有报道。因此,本试验拟通过在湖羊饲粮中添加氯化胆碱,结合高通量测序方法和靶向代谢组学技术,研究饲粮氯化胆碱含量变化对瘤胃菌群和血浆TMAO含量的影响,为反刍动物的健康养殖提供理论基础。
1 材料与方法
1.1 试验材料
试验用氯化胆碱未包被,含量99%,购自苏州某生物科技有限公司。
1.2 试验动物与饲养管理
本试验于2018年12月19日至2019年1月24日在江苏徐州苏羊羊业有限公司进行。试验选用12只育肥期健康公湖羊,体重(30.2±2.0) kg,随机分为2组,每组6只羊,单栏饲养。对照组饲喂基础饲粮;参考前期的研究结果和氯化胆碱在生产中的添加剂量,试验组饲粮在基础饲粮中添加0.05%的氯化胆碱。2组饲粮均制成全混合颗粒料,基础饲粮组成及营养水平见表1,参照《肉羊饲养标准》(NY/T 815—2004)中育肥肉羊营养需要量配制。试验预试期5 d,正试期28 d。试验期间,每天饲喂2次(08:00和16:00),自由采食和饮水。每天记录采食量,每周晨饲前称重1次。

表1 基础饲粮组成及营养水平(风干基础)
1.3 样品采集
正式期第27天于早晨饲喂前用装有肝素钠的真空采血管通过颈静脉取血,1 125×g离心15 min,取上清备测血浆TMAO含量。正试期第28天于早晨饲喂前屠宰采集瘤胃内容物用于细菌测序;采集瘤胃液经4层纱布过滤,滤液一部分用于测定pH,另一部分用于挥发性脂肪酸和氨氮含量的测定。
1.4 测定指标及方法
1.4.1 瘤胃液挥发性脂肪酸和氨氮含量的测定
瘤胃液中挥发性脂肪酸含量参照Jin等[7]方法,利用安捷伦7890B(Agilent, California, USA)气相色谱仪测定,色谱柱采用Fused silica capillary column (Supelco, Bellefonte, USA)。测定氨氮含量时,先将瘤胃液样品4 000 r/min离心10 min(Scientific Sorvall Legend Micro 21R微量离心机,德国Thermo Fisher公司)取上清,参照Weatherburn[8]描述的方法,使用氯化铵作为标准品,利用比色法测定。
1.4.2 血浆TMAO含量的测定
体重管理除了控制饮食外还需适量的运动,运动和饮食就像一对双胞胎,一个都不能少,孕妇需要适量的运动和合理的饮食才能控制整个孕期的增重量,把宝宝的体重控制在3千克左右,为自然分娩、母乳喂养和宝宝一辈子的健康打下良好的基础。
血浆中TMAO的含量参照Xin等[9]的方法,利用LC-MS测定。100 μL血浆与200 μL乙腈混合沉淀蛋白,14 000×g离心10 min,2 μL上清液注入U3000 DGLC系统(Thermo Fisher Scientific, Waltham,美国)和Q Exactive质谱仪(Thermo Fisher Scientific, Waltham,美国),TMAO在Waters BEH Amide column色谱柱上分离。检测数据利用Xcalibur和TraceFinder 4.1(Thermo Fisher Scientific, Waltham,美国)收集和分析。
1.4.3 瘤胃微生物DNA提取
瘤胃微生物的DNA提取参照Jin等[7]方法。采用十六烷基三甲基溴化铵(CTAB)结合酚-氯仿-异戊醇法提取。使用NanoDrop ND-2000(Thermo Fisher Scientific,美国)测定DNA浓度和纯度,保证提取的样品DNA的OD260/OD280在1.80~2.00,保存DNA样品于-80 ℃冰箱备用。
1.4.4 实时荧光定量PCR

1.4.5 细菌16S rRNA基因的高通量测序及数据分析
对细菌16S rRNA基因的V3~V4区进行PCR扩增,引物序列为341F(5′-CCTAYGGGRBGCASCAG-3′)和806R(5′-GGACTACNNGGGTATCTAAT-3′)[12]。扩增产物利用Illumina MiSeq PE250平台进行测序(凌恩生物科技有限公司)。测序原始数据已经上传到NCBI的SRA数据库,登录号为SRP271556。
高通量数据分析参照Xie等[13]方法,利用QIIME软件(1.9.0版)进行。利用UPARSE在0.03水平上聚类操作分类单元(OTUs)[14],α和β多样性分析在序列深度29070上进行。基于Unweighted UniFrac metric进行主成分分析(PCoA)[15]。基于SILVA数据库(Release132 http://www.arb-silva.de)对OTUs的代表性序列进行系统分类[16]。利用相似性分析(ANOSIM)评估组间菌群差异。利用线性判别(LDA)分析和LDA效应大小分析(LEfSe)找出导致组间菌群变化的生物标志物[17]。
1.5 数据处理
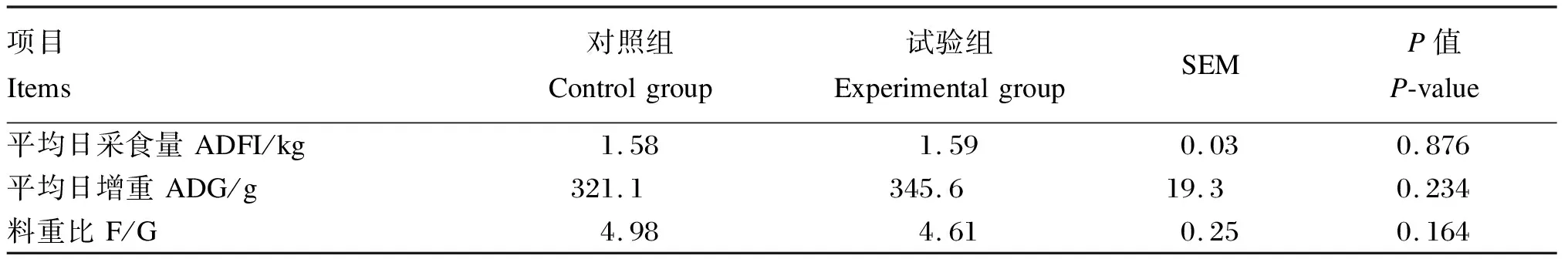
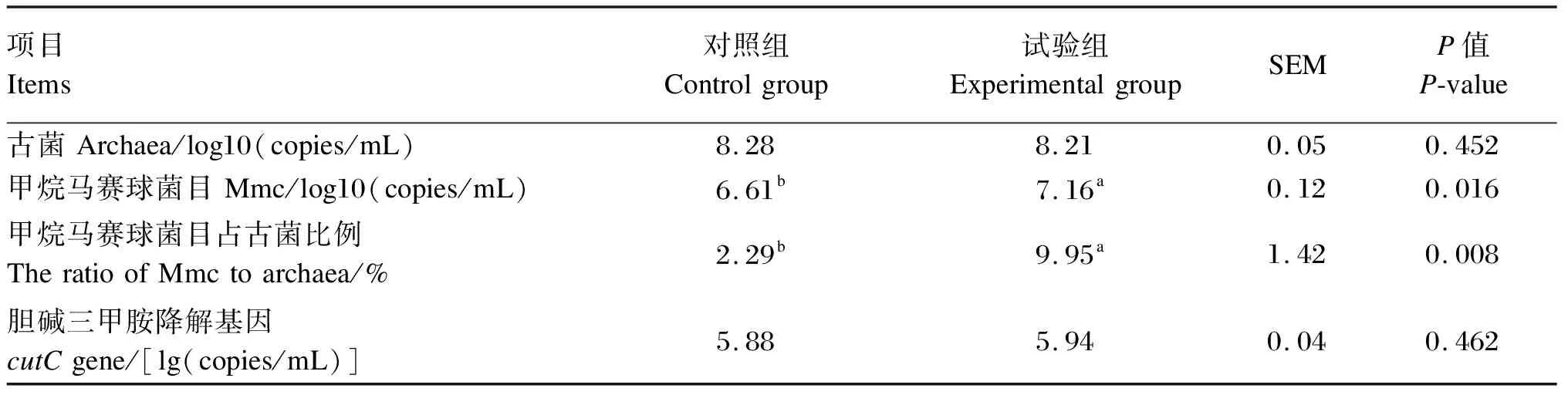
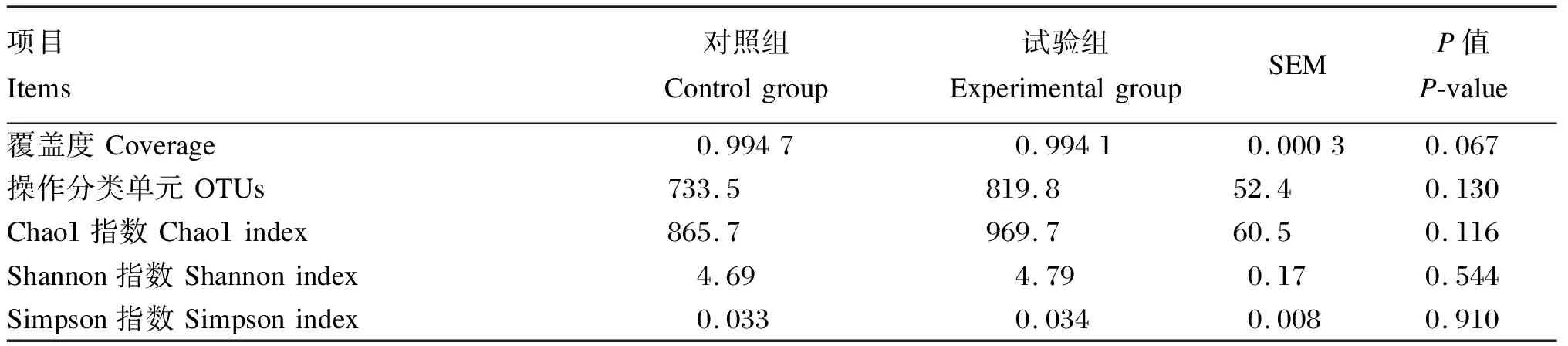
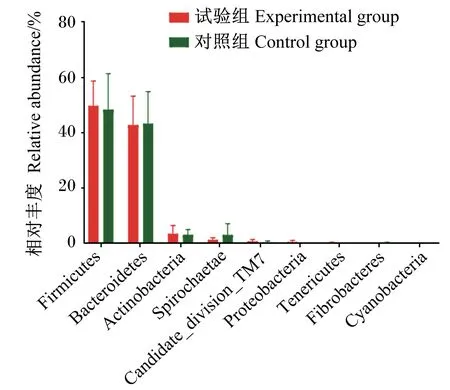
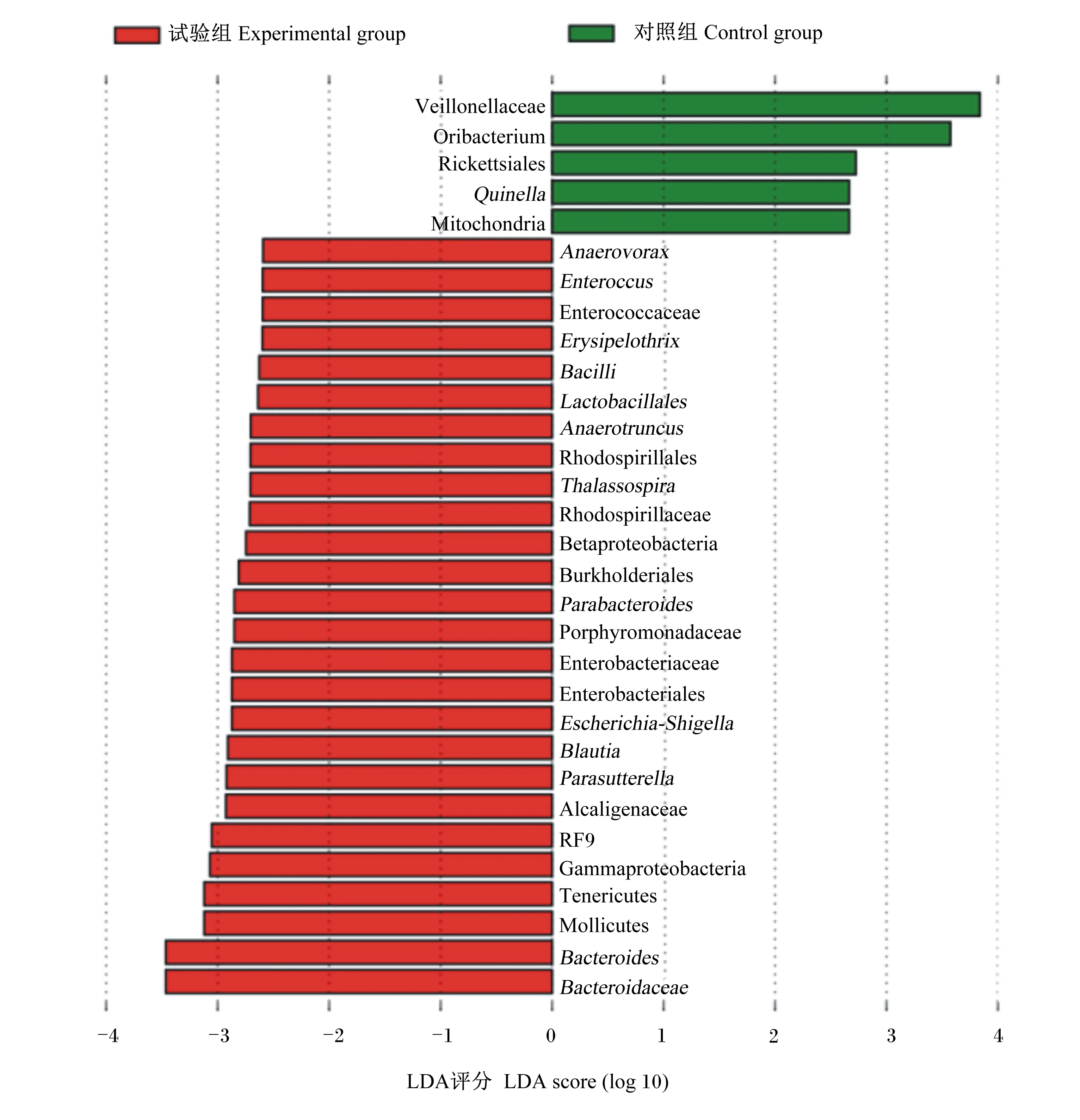
利用SPSS 22.0软件进行数据分析。平均日采食量、平均日增重、料重比、瘤胃发酵参数、血浆TMAO含量以及实时荧光定量PCR数据利用独立样本t检验进行分析。微生物数据采用Kruskal-Wallis H(K)非参数检验分析。P<0.05表示差异显著,0.05 如表2所示,添加0.05%的氯化胆碱对湖羊平均日采食量(P=0.879)、平均日增重(P=0.234)和料重比(P=0.164)没有显著影响。 表2 添加氯化胆碱对湖羊生长性能的影响 如表3所示,添加氯化胆碱对瘤胃液pH没有显著影响(P=0.817),也没有显著影响瘤胃挥发性脂肪酸(P>0.05)和氨氮含量(P=0.883),但有增加血浆TMAO含量的趋势(P=0.075)。 表3 添加氯化胆碱对湖羊瘤胃发酵参数和血浆TMAO含量的影响 如表4所示,添加氯化胆碱没有对瘤胃内容物中古菌16S rRNA基因(P=0.452)和细菌cutC基因(P=0.462)丰度产生显著影响,但显著提高了Mmc的16S rRNA基因(P=0.016)的丰度以及Mmc占古菌的比例(P=0.008)。 表4 添加氯化胆碱对湖羊瘤胃古菌和Mmc 16S rRNA基因以及细菌cutC基因丰度的影响 如表5所示,测序覆盖度大于0.99,表明测序数据量可以代表样品中的细菌菌群。添加氯化胆碱没有显著影响OTUs、Chao1、Shannon和Simpson指数(P>0.05)。PCoA结果显示,添加氯化胆碱对瘤胃菌群结构产生了显著影响(图1,ANOSIM,P<0.009)。 相似性分析(ANOSIM),P=0.009; 红色: 试验组,绿色: 对照组。 表5 添加氯化胆碱对湖羊瘤胃菌群α多样性的影响 如图2所示,在相对丰度大于0.1%的条件下,2个组共有9个门。2个组的优势菌群主要为厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)。添加氯化胆碱未显著影响细菌门水平上的相对丰度(P>0.05)。 Firmicutes:厚壁菌门;Bacteroidetes:拟杆菌门;Actinobacteria:放线菌门;Spirochaetae:螺旋体门;Candidate_division_TM7:被分类为细菌域候选TM7;Proteobacteria:变形菌门;Tenericutes:无壁菌门;Fibrobacteres: 纤维杆菌门;Cyanobacteria:蓝藻菌门。 如图3所示,相对丰度大于0.5%的属有29个。2组优势菌属均为普雷沃氏菌属(Prevotella)、丁酸弧菌属(Butyrivibrio)、瘤胃球菌科中1个未分类的属Unclassified S24-7和瘤胃球菌属(Ruminococcus),这4个属相对丰度均在5%以上。2组之间的细菌相对丰度在属水平上无显著差异(P>0.05)。 Syntrophococcus:互营球菌属;Unclassified Erysipelotrichaceae:未分类丹毒丝菌科;Unlassified Veillonellaceae:未分类韦荣球菌科;Succiniclasticum:琥珀酸菌属;Unclassified Lachnospiraceae:未分类毛螺菌科;Unclassified Christensenellaceae:未分类的克里斯滕森菌科;Roseburia:罗氏菌属;Acetitomaculum:聚乙酸菌属;Treponema:螺旋体菌属;RC9_gut_group:理研菌科RC9 gut群;Unclassified Prevotellaceae:未分类普雷沃氏菌科;Lachnospiraceae-Incertae-Sedis:毛螺菌属;Unclassiied Ruminococcaceae:未分类瘤胃球菌科;Ruminococcus:瘤胃球菌属;Unclassified S24_7:未分类S24_7;Butyrivibrio:丁酸弧菌属;Prevotella:普雷沃氏菌属。 如图4所示,当阈值设定为3.0时,通过LDA分析发现韦荣球菌科(Veillonellaceae)和Oribacterium在对照组中富集,拟杆菌科(Bacteroidaceae)、拟杆菌属(Bacteroides)、柔膜菌纲(Mollicutes)、无壁菌门(Tenericutes)、γ-变形菌纲(Gammaproteobacteria)、柔膜细菌RF9在试验组中富集。 Veillonellaceae:韦荣球菌科;Rickettsiales:立克次氏体目;Quinella:奎因氏菌属;Anaerovorax:厌氧弧菌属;Enteroccus:肠球菌属;Enterococcaceae:肠球菌科;Erysipelothrix:丹毒丝菌属;Bacilli:芽孢杆菌属;Lactobacillales:乳酸杆菌属;Anaerotruncus:厌氧球菌属;Rhodospirillales:红螺菌目;Thalassospira:海旋菌属;Rhodospirillaceae: 红螺菌科;Betaproteobacteria:β-变形菌纲;Burkholderiales:伯克氏菌目;Parabacteroides:副拟杆菌属;Porphyromonadaceae:紫单孢菌科;Enterobacteriaceae:肠杆菌科;Enterobacteriales:肠杆菌目;Escherichia-Shigella:埃希氏杆菌属-志贺氏菌;Blautia:布劳特氏菌属;Parasutterella:毛螺璇菌属;Alcaligenaceae:产碱杆菌科;Gammaproteobacteria: γ-变形菌纲;Tenericutes:无壁菌门;Mollicutes:柔膜菌纲;Bacteroides:拟杆菌属。 本研究在饲粮中添加0.05%的氯化胆碱没有显著影响湖羊的生长性能。胆碱在瘤胃中会被微生物快速降解成三甲胺,只有少量胆碱能够到达小肠并被动物吸收[18],因此添加的氯化胆碱基本不能被动物利用。添加的氯化胆碱对饲粮粗蛋白质增加量仅为0.031%,没有对动物生长性能产生显著影响。 添加0.05%的氯化胆碱没有显著影响湖羊瘤胃pH、VFA和氨氮含量,但改变了湖羊瘤胃细菌和甲烷菌菌群结构。Kelly等[19]通过利用胆碱三甲胺裂解酶检索瘤胃微生物宏基因组数据,发现瘤胃中胆碱降解菌主要分布在放线菌门(Actinobacteria)、Firmicutes和变形菌门(Proteobacteria)3个门中,虽然分布较广,但目前比对出来的7个细菌属都不是瘤胃菌群中丰富和普遍的成员。瘤胃中主要的胆碱降解菌是欧尔森氏菌属(Olsenellaumbonata)和Caecibacter,但主要菌属存在动物物种差异,羊瘤胃中主要是Olsenella和Caecibacter,牛瘤胃中是Olsenella、Caecibacter和真杆菌属(Eubacterium)。本研究湖羊瘤胃中Olsenella和Eubacterium的相对丰度均较低,未检测到Caecibacter的存在,本研究的结果进一步证实了胆碱降解菌在瘤胃中并不是优势菌群。本研究中对试验组菌群变异贡献最大的是拟杆菌门的拟杆菌属和软壁菌门的RF9,然而目前尚未发现在这2个门中有编码胆碱三甲胺裂解酶的cutC基因分布[19-20],引起这2个菌群变化的原因尚不清楚。这些变化的菌群可能与胆碱利用有关,如原虫可利用瘤胃中游离胆碱合成自身的磷脂酰胆碱[21],仍需进一步试验证实。 添加氯化胆碱促进了瘤胃中Mmc甲烷菌的增殖。Mmc是瘤胃中利用三甲胺的主要甲烷菌[22],这一甲烷菌的增殖暗示瘤胃中三甲胺增多,这表明添加的氯化胆碱在瘤胃中被降解为三甲胺。将胆碱降解为三甲胺和乙醛需要细菌胆碱三甲胺裂解酶的作用[6],然而实时荧光定量PCR结果显示瘤胃内容物中编码胆碱三甲胺裂解酶的cutC基因丰度没有显著变化,这可能是由于添加的氯化胆碱未达到引起胆碱降解细菌增殖的量;另一个可能的原因是cutC基因的表达量增加了,然而本研究未能对此进行证实。 在血浆中检测到TMAO,表明三甲胺从胃肠道转移到了湖羊的血液循环。尽管饲粮中氯化胆碱含量增加促进了瘤胃中三甲胺利用菌Mmc甲烷菌的增殖,但由Mmc甲烷菌增殖而提升的三甲胺的利用能力未能完全抵消瘤胃中三甲胺增加的量,导致试验组湖羊血浆中TMAO含量有升高的趋势。这暗示饲粮中胆碱水平升高可能会导致更多的三甲胺进入动物机体,这可能会对动物健康造成潜在的危害。虽然未包被的氯化胆碱已经不在反刍动物的饲粮中使用,但饲料原料中含有丰富的三甲胺前体物质,如胆碱、甜菜碱、卵磷脂等。不同的饲料原料中这些物质含量不同,在饲料配方设计的时候需要综合考虑,尽量减少瘤胃中三甲胺的生成,降低对动物健康的危害。 此外,目前在反刍动物饲料添加剂上广泛使用的是过瘤胃氯化胆碱,但我们需要注意的是即便胆碱能够到达小肠,大部分的胆碱也有可能不能被动物吸收利用。有文献报道,到达小肠的胆碱仅有1/3被吸收进入肠细胞,2/3的胆碱被肠道微生物降解成三甲胺,以三甲胺的形式很快地被吸收进入门静脉[4]。 添加0.05%的氯化胆碱未对湖羊生长性能和瘤胃发酵产生影响,但改变了瘤胃细菌和甲烷菌的菌群结构,有提高血浆中TMAO含量的趋势,这一结果暗示饲粮中胆碱含量的变化能够影响进入动物机体的三甲胺的量。进入机体的三甲胺增多,不但增加肝脏的解毒负担,产生的TMAO还对动物的健康造成潜在的危害。2 结 果
2.1 添加氯化胆碱对湖羊生长性能的影响
2.2 添加氯化胆碱对湖羊瘤胃发酵参数和血浆TMAO含量的影响

2.3 添加氯化胆碱对湖羊瘤胃古菌和Mmc 16S rRNA基因以及细菌cutC基因丰度的影响
2.4 添加氯化胆碱对湖羊瘤胃菌群结构的影响


3 讨 论
4 结 论
