单胃动物肠道气体的代谢、生理功能及营养调控
2021-06-05陈代文罗玉衡
王 丹 陈代文 罗玉衡
(四川农业大学动物营养研究所,农业部动物抗病营养与饲料重点实验室,动物抗病营养教育部、四川省重点实验室,动物营养与饲料工程四川省高校重点实验室,雅安 625014)
消化道不仅是动物养分摄入、转运、消化和吸收的主要场所[1],也是微生物定植的主要场所[2]。动物消化道微生物对内环境稳态与肠道健康的维持有重要意义[3]。无法在单胃动物小肠(前肠)被消化吸收的膳食/饲粮成分,可在大肠(后肠)多种菌群的协同作用下被进一步发酵分解,这方面最为熟知的例子是复杂碳水化合物的后肠发酵。微生物分泌的胞内酶可将复杂碳水化合物降解为低聚体或单体,同时产生短链脂肪酸(short-chain fatty acids,SCFAs)、气体、其他有机酸和小分子物质[4]。迄今为止,对SCFAs、有机酸等微生物代谢产物及其功能的研究较为丰富,但发酵气体对单胃动物的具体生物学功能仍有待探索。
氢气(H2)、甲烷(CH4)和二氧化碳(CO2)是单胃动物肠道内的主要气体,而硫化氢(H2S)、一氧化氮(NO)和一些含硫化合物[5]的浓度较低,属于微量气体,它们中的大部分都来源于消化道微生物的代谢反应。这些气体大部分属于微生物发酵终产物,但是对其作用认识还不够充分。随着研究的深入,人们发现这些气体对肠道健康有直接或间接的影响[6],例如,与肠道气体相关的疾病包括小肠细菌过度生长、碳水化合物消化不良如肠易激综合征(irritable bowel syndrome,IBS)、乳糖不耐症和肝脂肪变性[7]等。因此,肠道气体亦可作为某些胃肠道疾病诊断的生物标记[8]。
碳水化合物、蛋白质、脂肪等多种营养物质,均已被证实可通过多种机制改变肠道的运动、分泌、免疫,且这些变化均与肠道微生物区系密切相关。鉴于气体是菌群代谢的重要产物之一,肠道内气体的组成和分布也会受到膳食/饲粮营养成分的影响[9]。因此,肠道气体不仅是微生物发酵产物,还可能是动物生理活动的重要介导分子。本文将从代谢过程、生物学活性、测量方法、营养调控等方面,系统综述单胃动物肠道气体对机体健康的影响,同时也讨论肠道气体在畜牧生产中作为生物标记物判断微生物功能和活性的可行性,为降低规模化养殖过程的废弃物排放、促进精准营养手段的研发提供新思路。
1 肠道气体代谢过程及气体的生物学特性
肠道气体代谢是肠道生理学的一个复杂而有趣的分支。目前,对肠道内各种气体的代谢途径有大概了解,但对其具体的作用机制还缺乏系统认知[10]。总体而言,肠道气体有3种来源——吞咽的空气、肠道内生成(主要包括化学反应和微生物代谢,后者的特点是同时产生和消耗气体)、血液扩散(气体从血液扩散到管腔内)。其中,大部分气体在肠道内产生,少量可能通过吞咽进入肠道,例如肠道内所有的氧气(O2)和大部分氮气(N2)(少量N2由结肠微生物脱氮作用产生)都是通过吞咽进入肠道[11]。肠道内气体的排出是通过打嗝、肠壁吸收、菌群代谢和肛门排空来实现的。如图1所示,呼吸作用以及胃内化学反应生成的CO2,以及吞咽的O2和N2,部分被小肠上皮吸收进入血液循环系统,剩余部分进入后肠。后肠(尤其是近端结肠)细菌发酵产生大量H2和CO2,并进一步被其他微生物利用生成CH4(产甲烷菌)和H2S(硫酸盐还原菌)。小部分的气体经大肠上皮细胞进入毛细血管,大部分气体随未消化的营养物质经过肛门排出体外。毛细血管内的气体也可分泌到肠腔中。吞咽进入胃内的空气大部分通过打嗝排出体外,少部分空气在仰卧时被胃推送进入小肠。
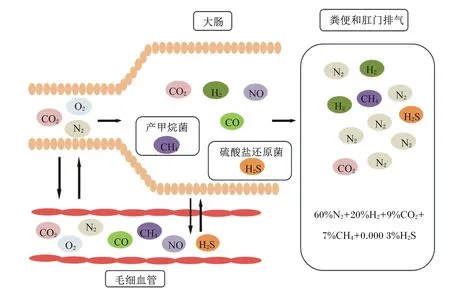
CO2:二氧化碳 carbon dioxide;O2:氧气 oxygen;N2:氮气 nitrogen;H2:氢气 hydrogen;NO:一氧化氮 nitric oxide;CO:一氧化碳 carbon monoxide;CH4:甲烷 methane;H2S:硫化氢 hydrogen sulfide。下图同 The same as below。
1.1 CO2
1.2 H2
与CO2生成方式不同,肠道中所有H2和CH4都来自微生物代谢。研究发现,在新生婴儿和无菌仔鼠出生后的12 h内,肠道内都没有H2和CH4产生[16-17]。对人类结肠中编码氢化酶的基因组和宏基因组的分析发现,约70%的人类结肠微生物具有生成H2的能力[18]。
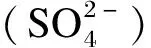
NAD+:二磷酸吡啶核苷酸 pyridine diphosphate nucleotide;NADH+:三磷酸吡啶核苷酸 pyridine triphosphate nucleotide;Fdox:氧化铁氧还蛋白 oxidized ferredoxin;Fdred:还原铁氧还蛋白 reduced ferredoxin。①:通路① pathway ①;②:通路② pathway ②;③:通路③ pathway ③。
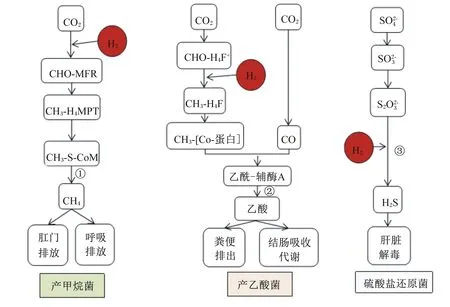
CHO-MFR:N-甲酰甲烷呋喃 N-formylmethane furan;CH3-H4MPT:甲基-四氢甲烷蝶呤 methyl tetrahydro methotrexate;CH3-S-CoM:甲硫基辅酶M methylthiol coenzyme M;CHO-H4F+:甲酰-四氢叶酸 formyl tetrahydrofolate;CH3-H4F:甲基-四氢叶酸 methyl tetrahydrofolate。:硫酸根离子 sulfate ion;:亚硫酸根离子 sulfite ion;:硫代硫酸根离子 thiosulfate ion;①:甲基辅酶M还原酶途径 methyl coenzyme M reductase pathway;②:乙酸激酶途径 acetic kinase pathway;③:亚硫酸还原酶途径 sulfite reductase pathway。
1.3 CH4
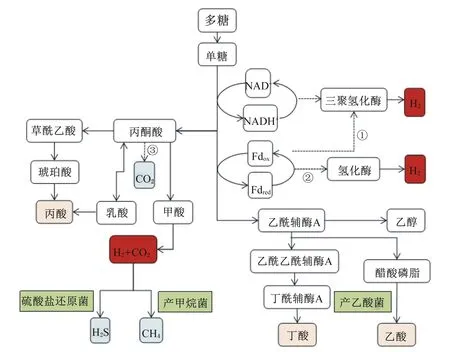
单胃动物肠道内的CH4主要由产甲烷菌产生(图2、图3)。产甲烷菌是古细菌领域的厌氧原核生物,其与细菌、真菌是单胃动物肠道内的3类主要微生物(三域系统)[25]。反刍动物瘤胃中存在大量产甲烷菌,但在单胃动物肠道中,产甲烷菌相比于细菌受到的关注要少得多,其功能研究极少。人和猪肠道中的产甲烷菌主要存在于结肠[26-27],由于其可利用细菌发酵的终产物(如H2、CO2、甲酸、乙醇等),对降低肠腔内氢分压、维持微生物发酵效率和肠道正常生理功能有重要意义。
在很长一段时间内,CH4被认为仅仅是一种代谢废气,但有研究重新评估了产甲烷菌和CH4对人类的生物学意义,发现二者与胃肠道疾病(如IBS、结直肠癌等)和肥胖息息相关[28-30](表1)。有研究认为,产甲烷菌导致肥胖的机制可能是因为甲烷菌作为氢营养型微生物,可促进后肠细菌发酵产生更多的SCFAs参与宿主能量代谢,从而导致肥胖[31]。炎症性肠病(inflammatory bowel disease,IBD)患者不仅肠道中定植的产甲烷菌数量相对较少,且其呼出气体中CH4浓度也较低,推测其可能原因是腹泻导致肠道微生物总量减少[32]。此外,产甲烷菌在便秘严重的神经性厌食症患者肠道中的丰度极高[33],进一步分析表明,肠腔中高浓度的CH4可能会减缓肠道运动,延长食糜在肠道中的运输时间,从而导致便秘的产生。

表1 可能与CH4/产甲烷菌相关的疾病(人和模式动物)
1.4 H2S
单胃动物肠道内H2S的生成也主要有3条途径:其一,硫酸盐还原菌利用硫酸盐作为终端电子受体,H2作为终端电子供体,生成H2S[39];其二,依靠细菌发酵蛋白质或氨基酸(如含硫氨基酸)产生。研究表明,在粪便匀浆中添加半胱氨酸可促进H2S生成,添加低聚糖则会抑制H2S生成,猜想其原因可能是低聚糖可以作为半胱氨酸的竞争底物优先被细菌发酵[30];其三,某些细胞或组织(如血管组织)可以通过不同的酶生成H2S[40]。如大部分哺乳动物产生内源性H2S的主要途径是通过2种依赖5-磷酸吡哆醛的酶(胱硫醚β-合酶和胱硫醚γ-裂合酶),并利用L-半胱氨酸为主要底物来完成的[41-43]。其中,细菌来源的H2S占主导,也与单胃动物肠道健康密切相关[44]。
H2S同时具有有益作用和毒性作用。当H2S浓度较高时,特别是与NO同时存在时,会损害β-氧化以及脂质和蛋白质的合成[45]。例如,在某些临床研究中发现,肠道中H2S的存在与炎症性肠病和结直肠癌密切相关[46-47]。并且体外研究发现,一定浓度的H2S会对中国仓鼠卵巢细胞和人类HT-29结肠上皮细胞基因组DNA造成损伤[48]。浓度为50 μmol/L的硫化物可使中国仓鼠卵巢细胞核完全降解[49]。反之,当H2S浓度较低时,则具有重要的细胞信号传导特性[50]。例如,硫化物可通过抑制KATP通道的开放[51],阻断L型钙通道[52],抑制环磷酸腺苷/蛋白激酶A(cAMP/PKA)途径[53],从而对心肌细胞产生负性肌力作用[54]。
2 肠道气体的测量方法
肠道气体的测量方法最早可以追溯到1781年[9]。目前在临床应用中已开发的肠道气体测量方法可分为直接法和间接法。直接法主要指采用集气袋收集肛门排出气体,或以专用软管插入直肠收集气体进行测量。间接法则主要指采用体热测定、呼吸测定和成像技术等手段进行分析。其中,成像技术包括腹部平片、计算机断层扫描(CT)和磁共振成像(MRI)[55-57]。肠道微生物产生的CH4和H2一旦进入循环系统,现已知唯一的代谢方式是通过肺呼出体外[13]。研究发现,肠道内H2和CH4总产量与呼出的H2、CH4含量成正比,并且其中14%的H2和20%的CH4经由肺呼出体外[58-59]。因此,通过检测呼出气体中H2和CH4的浓度和比例,可以间接评估肠道内微生物的发酵活性。需要注意的是,现有的肠道气体测量方法都存在其弱点。例如,间接法虽然是无创的,但因为气体的检测过程通常暴露于干扰信号,故方法的严谨性和结果的准确性存在争议;直接法虽然获得的数据较为准确,但因测量方法有较大侵入性,机体不适感强烈,因此在临床应用上也有一定困难。
在畜牧行业中,肠道气体的测量方法更为落后。呼吸测热室是用于动物代谢产热试验的较为经典的方法,但其测定的气体仅为终端气体,即动物通过呼吸和肛门排出的气体,无法实时反映肠道内气体的代谢情况。研究发现,随机收集新鲜的粪便样本在32 ℃发酵48 h后,收集气体检测其中的有害气体浓度[60-61],可在一定程度上反映肠道内关键气体的产生情况,但该方法与在体内情况相差甚远,分析结果只能粗略反映有害气体浓度,不能准确反映饲粮成分对肠道气体代谢的影响,故不具有代表性。
近期研究表明,可摄入的气体传感胶囊可能是一种较为精确、安全的肠道气体测量方法[62]。这种可摄入胶囊可以同时测量消化道中O2、CO2、H2和CH4的浓度,并将数据无线传输到外部接收器,从而评估气体的分布[23,63],且可以通过气体的实时浓度确定胶囊所在位置。经腹部超声成像表明,O2浓度可准确反映胶囊离开胃部以及从回肠末端移动到盲肠的时间,这使研究者能够推断出其他气体的生成部位。胶囊从体内排出后因温度从体温降到环境温度,温度传感器检测到温差后即可知道胶囊排出的时间[62]。
因此,先进的肠道气体测量方法可以准确反映肠道气体的产生和代谢过程,不仅可以作为消化道疾病诊断、治疗的辅助手段,还可以帮助判断肠道微生物的功能和活性,为个体化和精准营养提供参考。
3 肠道气体与营养调控
大量证据表明膳食结构与消化道微生物区系密切相关[64]。如前所述,肠道内大部分气体为菌群的代谢产物,所以菌群结构的改变可能直接影响肠道气体的分布和浓度,从而改变与气体相关的腹部症状,如胀气、腹痛、便秘、肛门排气过多等[65]。基于此,通过定性和定量分析肠道气体,可以为营养调控改善肠道健康提供思路。
IBS是一种常见的功能性肠病,以腹胀、腹痛为主要症状,且餐后症状明显,严重影响患者生活质量[66]。西方国家患病率为5%~24%,我国人群患病率为5%~15%[67]。饮食管理是IBS治疗中的重要一环[68],其中又以控制肠内微生物发酵气体的浓度与生成速度为主。研究表明,IBS患者摄入易发酵短链碳水化合物之后,呼吸中的H2减少,CH4增加,胃肠道症状加重;摄入不可发酵碳水化合物则相反[66,69-70],说明肠道气体不仅可以作为疾病诊断标记物,且在IBS的发病机制中也扮演重要角色。
虽然肠道气体对猪等单胃动物的生物学功能仍不清楚,但综上所述,肠道气体可以作为养分利用率和动物机体健康的参考标准之一。由于发酵体系中的产气量通常与微生物发酵底物的程度成正比,因此肠道气体的产量、分布、移动速率很可能与饲料组分的利用程度相关(图4)。
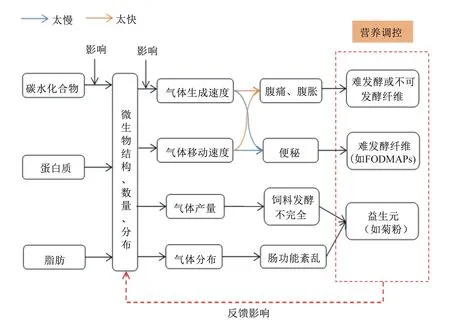
FODMAPs:易发酵的低聚糖、双糖、单糖和多元醇 fermentable oligosaccharides, disaccharides, monosaccharides and polyols。
目前,关于膳食/饲粮营养成分与单胃动物肠道气体关系的研究主要集中于碳水化合物和蛋白质,其他营养成分与肠道气体之间的关系仍属未知。
3.1 碳水化合物与肠道气体
单胃动物肠道微生物对碳水化合物的利用途径相对比较简单。大多数肠道细菌对碳水化合物的发酵始于糖酵解途径,生成的丙酮酸进而被下游细菌利用产生SCFAs和气体等[10](图5)。细菌对碳水化合物的分解取决于其胞内酶的种类,实质上是1种或多种酶促反应,因此可利用多种底物的细菌能迅速适应不断变化的营养条件,具有较大的竞争优势,而对底物专一的细菌竞争力相对较弱[76]。细菌的这种底物偏好性和竞争性造成肠道气体组成和分布的差异,最后影响肠道健康和营养物质利用率。
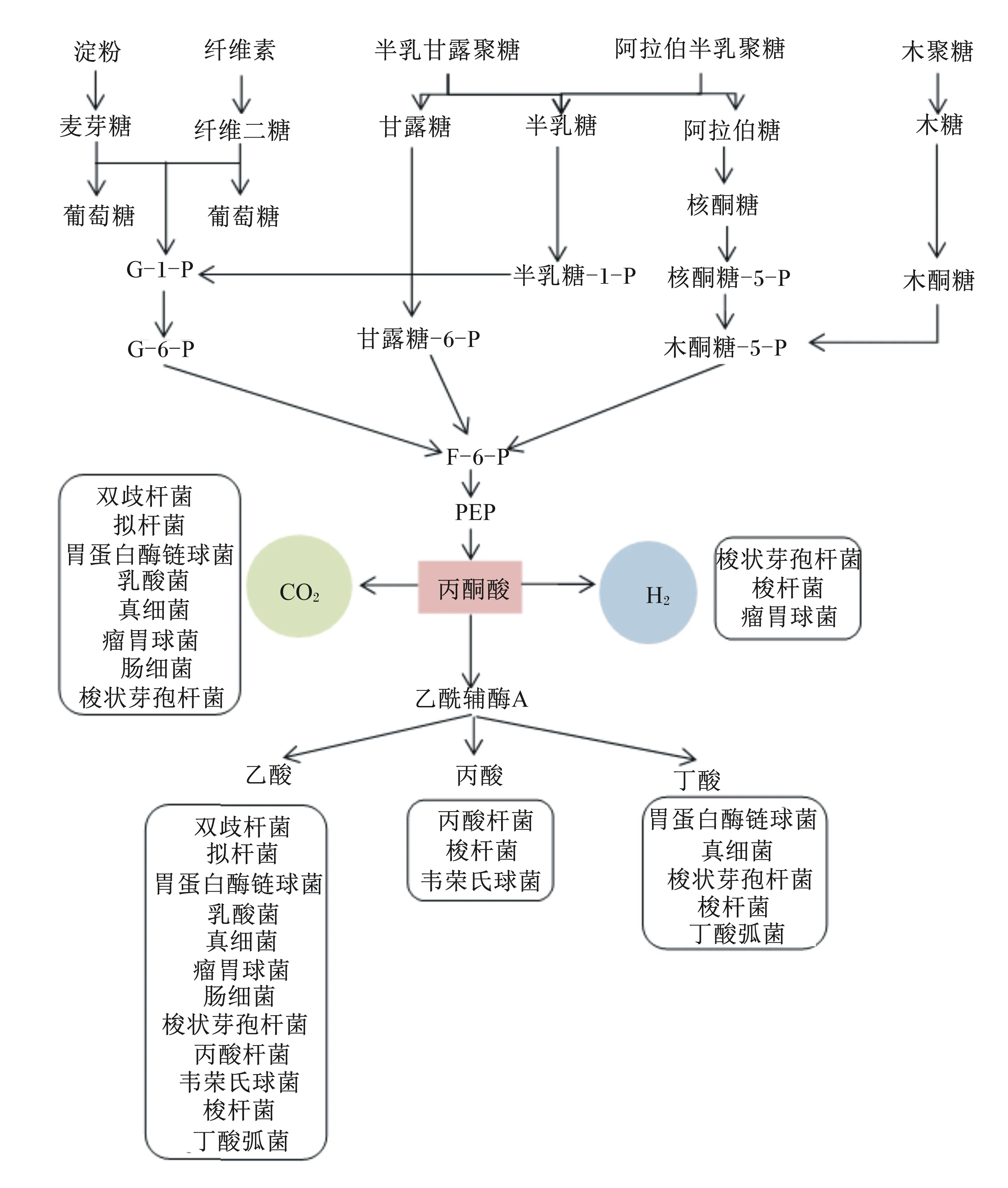
G-1-P:葡萄糖-1-磷酸 glucose-1-phosphate;G-6-P:葡萄糖-6-磷酸 glucose-6-phosphate;F-6-P:果糖-6-磷酸 fructose-6-phosphate;PEP:磷酸烯醇式丙酮酸 phosphoenolpyruvate。
根据链长的不同,碳水化合物可分为易发酵的低聚糖、双糖、单糖和多元醇(fermentable oligosaccharides, disaccharides, monosaccharides and polyols,FODMAPs)和纤维。FODMAPs聚合度(degree of polymerization,DP)小于10,其特点为难吸收、发酵快并具有渗透活性,发酵部位通常为近端结肠[77]。体外研究发现,短链低聚糖(如低聚果糖和低聚半乳糖)的发酵速度最快,程度最深,而短链混合长链低聚糖发酵速度和程度明显减弱,说明短链碳水化合物比长链碳水化合物(DP>10)发酵更快,在更短的时间内产生更多的气体[71]。这在体内试验中被进一步验证。健康志愿者摄入高FODMAPs含量膳食后,呼气中的H2浓度在短时间内显著增长[78]。同时,因为FODMAPs具有渗透活性,可使肠道内水分含量升高,增加管腔内容物流动性[79],有助于缓解便秘。但IBS患者的内脏存在超敏反应,管腔的膨大和气体量过多会导致患者腹胀和腹痛[72]。膳食/饲粮纤维的定义繁多,但通常为DP>2的不易消化碳水化合物,因此包含大部分FODMAPs,也具有持水性强的特点,但有些纤维(如纤维素含量较高或结晶程度较高)发酵速度缓慢甚至不发酵,且发酵的位置靠近横结肠或降结肠,使气体生成速度变缓,体积变少,对肠壁刺激较小。通常而言,溶解度高、链长较短的碳水化合物一般在升结肠或横结肠被发酵;溶解度低、链长较长或有分支的碳水化合物一般难以被发酵[72-73]。因此,混合摄入不可发酵(如纤维素)或慢速发酵的碳水化合物与易于发酵(如菊粉)的碳水化合物,可使发酵位置往结肠或后肠远端移动,同时改善大肠内气体分布,缓解IBS等疾病症状。
综上所述,膳食/饲粮中的碳水化合物来源、结构、组成等,都与单胃动物肠道微生物的发酵活性和气体组成密切相关。针对不同动物、不同肠道健康状况,构建适宜的碳水化合物“平衡模式”,是从源头控制肠道气体的生成、促进肠道健康的有效营养调控手段。
3.2 蛋白质与肠道气体
前肠未被完全利用的蛋白质进入单胃动物后肠(主要是结肠)被细菌分解,并利用产生的氨基酸合成其结构蛋白或其他微生物蛋白[80]。蛋白质的微生物代谢产物比碳水化合物更加多样化[81]。例如,梭菌属和梭杆菌属细菌均可在厌氧条件下发酵氨基酸,生成SCFAs、支链脂肪酸(如异丁酸、2-甲基丁酸和异戊酸)、H2、CO2和氨气(NH3),以及少量的H2S、甲基硫醇、酚类、醇类和有机酸[82]。
在畜牧领域,大部分有关肠道气体的研究集中在减少规模化养殖场有害气体的排放。其中,粪便NH3浓度可以作为肠道内蛋白质发酵程度的生物标志物,因为有研究表明粪便中的NH3浓度会随着蛋白质摄入量的增加而增多[83]。还有研究认为,H2S也可以替代NH3作为生物标志物来衡量蛋白质的发酵情况,因为长期摄入动物性蛋白质的健康人群肠道内H2S浓度较高[83]。
在调控肠道气体生成方面,碳水化合物与蛋白质之间可能存在某种互作。在断奶仔猪饲粮中添加低聚木糖或乳糖均可明显降低断奶仔猪粪便中的NH3浓度[61,82],但其具体机制尚属未知。关于饲粮蛋白质与单胃动物肠道气体生成、种类、比例和分布的关系,及其对肠道健康的影响仍有待探明。
4 小 结
综上所述,膳食/饲粮结构可通过改变菌群组成来改变肠道内的气体状态。一方面,不同的营养素影响气体生成的终体积和速度;另一方面,膳食/饲粮原料类型影响气体转运。针对动物营养领域,肠道气体是了解肠道微生物代谢机制的一个重要窗口。探索不同饲粮组分与肠道气体之间的联系,寻找反映肠道健康的标志性气体或气体组成,或根据气体组成情况形成个性化饲料配方,充分发挥肠道微生物对宿主不可消化的饲粮组分的利用潜力,是值得期待的发展方向。
对气体组分的监测离不开先进的测量手段。然而目前人们对肠道气体的分布及其随时间和肠道长度变化情况的了解还很肤浅,这主要是因为对肠道气体的测量手段大多是间接的或具有高度侵入性的。可摄入的气体传感胶囊虽然具有无创、灵敏、结果准确、成本较低等优点,但其检测的气体种类有限,无法根据结果推测或反映特定菌群活性,不能确定底物的发酵程度,且其操作和数据处理流程仍有待标准化。
最后,有关蛋白质、脂肪等重要营养物质与单胃动物肠道气体之间的关系研究甚少,前者与动物生长、免疫和有害物排放密切相关,后者与能量代谢、肉品质、繁殖等生理机能的维持密不可分。肠道气体能否作为三大营养素与肠道微生物互作情况的指示物,以反映动物的生长和健康程度仍有待探索。总之,关于单胃动物肠道气体的产生和调控机制,及其对肠道疾病和健康的影响机理的相关研究仍处于起步阶段。肠道气体是微生物代谢的重要产物之一,其种类、组成、浓度和分布与肠道微生物区系和活性息息相关。因此,从营养学和微生态角度出发,开发更为先进的肠道气体测量方法,探究能否通过营养手段调控肠道内气体的组成和分布,以促进动物肠道健康,提高饲料利用率,同时减少有害物排放,将会是动物营养的一个全新研究领域。
